名校
解题方法
1 . 为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念:AG=lg 。常温下,用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1HCN溶液,溶液的酸度(AG)随滴入的NaOH溶液体积的变化如图所示(滴定过程中温度的变化忽略不计),已知100.8≈6.3,下列说法正确的是
。常温下,用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1HCN溶液,溶液的酸度(AG)随滴入的NaOH溶液体积的变化如图所示(滴定过程中温度的变化忽略不计),已知100.8≈6.3,下列说法正确的是

 。常温下,用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1HCN溶液,溶液的酸度(AG)随滴入的NaOH溶液体积的变化如图所示(滴定过程中温度的变化忽略不计),已知100.8≈6.3,下列说法正确的是
。常温下,用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1HCN溶液,溶液的酸度(AG)随滴入的NaOH溶液体积的变化如图所示(滴定过程中温度的变化忽略不计),已知100.8≈6.3,下列说法正确的是
A.滴定过程中 逐渐增大 逐渐增大 |
| B.常温下,HCN的电离常数Ka≈6.3×10-10 |
| C.滴定过程中水电离出c(H+)先减小后增大 |
| D.当V=10mL时,溶液中存在c(H+)+c(HCN)=c(OH-)+c(CN-) |
您最近一年使用:0次
2023-04-13更新
|
305次组卷
|
2卷引用:宁夏回族自治区银川市2023届高三教学质量检测(一模)理科综合化学试题
名校
解题方法
2 . 硫脲(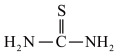 )是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
)是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
(1)硫脲中硫的化合价为_______ ;与硫脲互为同分异构且能与FeCl3溶液发生显色反应的化合物的化学式为_______
(2)可用H2NCN(氨基腈)与C2H5SH (乙硫醇)反应制备硫脲。氨基腈的电子式为_____
(3)制取氨基腈的传统工艺流程如下:
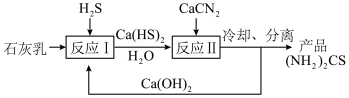
①反应Ⅱ的化学方程式为______
②测定硫脲含量的方法如下:
步骤1 :准确称取a g产品,经溶解等步骤最后在500 mL容量瓶中定容。
步骤2:准确量取20.00 mL配制好的溶液注入碘量瓶中,加入V1 mL c1 mol/L I2的标
准溶液及适量的NaOH溶液,于暗处放置10 min(2NaOH+I2=NaIO+NaI+H2O,
4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO2)。
步骤3:加水及适量的盐酸,摇匀。
步骤4:用c2 mol/L标准Na2S2O2溶液滴定剩余的I2( I2+2Na2S2O2=2NaI+Na2S4O6) ,加入淀粉溶液,滴定至终点时消耗Na2S2O2溶液V2mL。
“步骤3”加入盐酸的目的_________ (用离子方程式说明)。
“步骤4”滴定至终点时的颜色变化是________ 。
③产品中(NH2)2CS的质量分数为_______ (列出计算式)。
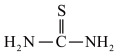 )是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:
)是一种白色而有光泽的晶体,味苦,可用于制造树脂,也用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:(1)硫脲中硫的化合价为
(2)可用H2NCN(氨基腈)与C2H5SH (乙硫醇)反应制备硫脲。氨基腈的电子式为
(3)制取氨基腈的传统工艺流程如下:

①反应Ⅱ的化学方程式为
②测定硫脲含量的方法如下:
步骤1 :准确称取a g产品,经溶解等步骤最后在500 mL容量瓶中定容。
步骤2:准确量取20.00 mL配制好的溶液注入碘量瓶中,加入V1 mL c1 mol/L I2的标
准溶液及适量的NaOH溶液,于暗处放置10 min(2NaOH+I2=NaIO+NaI+H2O,
4NaIO+(NH2)2CS+H2O =(NH2)2CO+4NaI+H2SO2)。
步骤3:加水及适量的盐酸,摇匀。
步骤4:用c2 mol/L标准Na2S2O2溶液滴定剩余的I2( I2+2Na2S2O2=2NaI+Na2S4O6) ,加入淀粉溶液,滴定至终点时消耗Na2S2O2溶液V2mL。
“步骤3”加入盐酸的目的
“步骤4”滴定至终点时的颜色变化是
③产品中(NH2)2CS的质量分数为
您最近一年使用:0次
解题方法
3 . 25℃时,体积均为25. 00 mL,浓度均为0.0100 mol/L的HA、H3B溶液分别用0.0100mol/L NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法中正确的是


| A.NaOH溶液滴定HA溶液可选甲基橙作指示剂 |
| B.均为0. 0100 mol/L HA、H3B溶液中,酸性较强的是HA |
| C.25℃时,0. 0100 mol/L Na2HB溶液的pH >7 |
| D.25℃时,向Na2HB溶液中滴加HA溶液反应的离子方程式为:HB2- + HA == H2B- + A- |
您最近一年使用:0次
2020-04-05更新
|
216次组卷
|
2卷引用:宁夏石嘴山市2020届高三4月适应性(二模)考试理综化学试题
名校
4 . 下列有关叙述中正确的是( )
| A.滴定管下端连有橡皮管的为酸式滴定管 |
| B.在滴定时,左手操作锥形瓶,右手操作滴定管开关 |
| C.滴定前应首先排除尖嘴部分的气泡 |
| D.滴定过程中两眼应注视滴定管内液面的变化 |
您最近一年使用:0次
2018-12-12更新
|
862次组卷
|
14卷引用:宁夏回族自治区吴忠中学2018-2019学年高二上学期期末模拟化学试题
宁夏回族自治区吴忠中学2018-2019学年高二上学期期末模拟化学试题云南省昭通市水富县第二中学2019-2020学年高二上学期期末考试化学试题吉林省白城市洮南市第一中学2020-2021学年高二上学期第一次月考化学试题新疆吾尔自治区沙雅县第一中学2019-2020学年高二下学期期末考试化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第4节 离子反应 课时2 离子反应的应用——酸碱中和滴定海南省万宁市民族中学2019-2020学年度高二上学期期末考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)课时41 酸碱中和滴定及拓展应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)云南省玉溪市江川区第二中学2021-2022学年高二上学期12月考试化学试题作业(十六) 酸碱中和滴定甘肃省天水市秦安县第一中学2022-2023学年高二上学期期末考试化学试题
名校
5 . 常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如下图所示。下列叙述正确的是
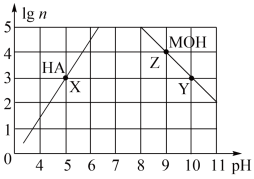

| A.MOH为弱碱,HA为强酸 |
| B.水的电离程度:X=Z>Y |
| C.若升高温度,Y、Z点对应溶液的pH均不变 |
| D.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性 |
您最近一年使用:0次
2018-04-14更新
|
1514次组卷
|
15卷引用:宁夏银川市2018届高三4月高中教学质量检测理科综合化学试题
宁夏银川市2018届高三4月高中教学质量检测理科综合化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题【百强校】天津市静海区第一中学2020届高三下学期第七周周末训练化学试题天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题广东省佛山市第一中学2021-2022学年高二上学期期中考试化学(选考) 试题湖南省怀化市沅陵县第一中学2021-2022学年高三下学期期中考试化学试题新疆乌鲁木齐市第八中学2021-2022学年高二上学期第三次月考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)【2022】【高二上】【期中考】【高中化学】59(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(讲)广东省广州市第二中学2023-2024学年高二上学期期中考试化学试题云南省腾冲市第八中学2022-2023学年高二下学期第三次月考化学试题
名校
6 . 室温下,用0.10mol/L的盐酸分别滴定20.00mL浓度均为0.10mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示。
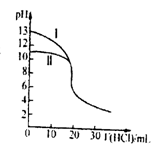
下列说法不正确的是

下列说法不正确的是
| A.Ⅱ表示的是滴定氨水的曲线,当V(HCl)=20mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B.当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且c(NH4+)=c(Cl-) |
| C.滴定氢氧化钠溶液,V(HCl) >20 mL 时一定有: c(Cl-) >c(Na+) >c(H+) >c(OH-) |
| D.当滴定氨水消耗V(HCl)=10 mL 时,有: 2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O) |
您最近一年使用:0次
2017-11-29更新
|
383次组卷
|
4卷引用:宁夏银川市第二中学2017届高三下学期第三次模拟考试理综化学试题



