解题方法
1 . 25℃时,用 溶液滴定
溶液滴定 溶液,加入NaOH溶液的体积、混合溶液中的离子浓度与pH的变化关系如图所示。
溶液,加入NaOH溶液的体积、混合溶液中的离子浓度与pH的变化关系如图所示。
 溶液滴定
溶液滴定 溶液,加入NaOH溶液的体积、混合溶液中的离子浓度与pH的变化关系如图所示。
溶液,加入NaOH溶液的体积、混合溶液中的离子浓度与pH的变化关系如图所示。
A. 的第二步电离常数 的第二步电离常数 的数量级为 的数量级为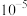 |
| B.第一步电离和第二步电离的滴定所选指示剂不同 |
C.P点溶液中存在 |
D.M点和N点溶液中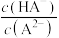 相等 相等 |
您最近一年使用:0次
2023-05-20更新
|
474次组卷
|
5卷引用:山西省吕梁市2023届高三下学期三模理科综合化学试题
山西省吕梁市2023届高三下学期三模理科综合化学试题河北省张家口市2023届高三高考三模化学试题河北省沧州市泊头市八县2023届高三下学期二模联考化学试题(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)重庆市2023-2024学年高三下学期3月月考化学试题
解题方法
2 . Co(III)盐溶液不能稳定存在,以氨为配位剂,可将Co(III)转化为稳定的Co(III)配合物。实验室利用CoCl2、NH3·H2O、NH4Cl、H2O2制备三氯化六氨合钴[Co(NH3)6]Cl3,装置(夹持仪器已省略)如图所示:
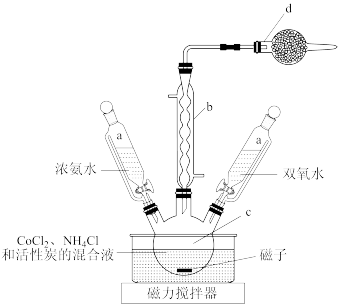
实验步骤:
①将研细的6gCoCl2·6H2O晶体、4gNH4Cl固体、适量活性炭催化剂充分混合后加入c中,滴加13.5mL浓氨水使溶液颜色变为黑紫色;
②置于冰水浴中冷却至10℃以下,缓慢滴加13.5mL5%H2O2溶液并不断搅拌;
③转移至60℃热水浴中,恒温加热20min,同时缓慢搅拌;
④将反应后的混合物冷却到0℃左右,抽滤得到三氯化六氨合钴粗产品;
⑤粗产品需要经过热的盐酸溶解、趁热过滤、冷却到0℃左右并滴加浓盐酸洗涤、干燥等操作得到较纯的三氯化六氨合钴。
回答下列问题:
(1)使用仪器a代替分液漏斗滴加液体的优点是_______ 。
(2)步骤①中将固体药品研细,常在_______ (填仪器名称)中进行。
(3)制取1mol[Co(NH3)6]Cl3,理论上需要H2O2的物质的量为_______ ,实际上消耗量比理论消耗量要多,其主要原因是_______ 。
(4)CoCl2遇浓氨水生成Co(OH)2沉淀,加入浓氨水前先加入NH4Cl可避免沉淀生成,原因是_______ (结合必要的离子方程式说明)。
(5)沉淀滴定法测定产品中Cl-的质量分数:
i.准确称取ag步骤⑤中的产品,配制成100mL溶液,移取25mL溶液于锥形瓶中;
ii.滴加少量0.005mol·L-1的K2CrO4溶液作为指示剂,用cmol·L-1的AgNO3溶液滴定至终点;
iii.平行测定三次,消耗AgNO3溶液的体积的平均值为VmL。
已知Ag2CrO4为砖红色沉淀。
①ii中,滴定至终点的现象是_______ 。
②产品中C1-的质量分数是_______ (列出计算式即可)。

实验步骤:
①将研细的6gCoCl2·6H2O晶体、4gNH4Cl固体、适量活性炭催化剂充分混合后加入c中,滴加13.5mL浓氨水使溶液颜色变为黑紫色;
②置于冰水浴中冷却至10℃以下,缓慢滴加13.5mL5%H2O2溶液并不断搅拌;
③转移至60℃热水浴中,恒温加热20min,同时缓慢搅拌;
④将反应后的混合物冷却到0℃左右,抽滤得到三氯化六氨合钴粗产品;
⑤粗产品需要经过热的盐酸溶解、趁热过滤、冷却到0℃左右并滴加浓盐酸洗涤、干燥等操作得到较纯的三氯化六氨合钴。
回答下列问题:
(1)使用仪器a代替分液漏斗滴加液体的优点是
(2)步骤①中将固体药品研细,常在
(3)制取1mol[Co(NH3)6]Cl3,理论上需要H2O2的物质的量为
(4)CoCl2遇浓氨水生成Co(OH)2沉淀,加入浓氨水前先加入NH4Cl可避免沉淀生成,原因是
(5)沉淀滴定法测定产品中Cl-的质量分数:
i.准确称取ag步骤⑤中的产品,配制成100mL溶液,移取25mL溶液于锥形瓶中;
ii.滴加少量0.005mol·L-1的K2CrO4溶液作为指示剂,用cmol·L-1的AgNO3溶液滴定至终点;
iii.平行测定三次,消耗AgNO3溶液的体积的平均值为VmL。
已知Ag2CrO4为砖红色沉淀。
①ii中,滴定至终点的现象是
②产品中C1-的质量分数是
您最近一年使用:0次
解题方法
3 . 室温下用等浓度的NaOH溶液滴定25.00mL0.1000mol·L-1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系正确的是( )
已知:①Ka1(H2C2O4)=5.4×10-2 Ka2(H2C2O4)=5.4×10-5
②设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
已知:①Ka1(H2C2O4)=5.4×10-2 Ka2(H2C2O4)=5.4×10-5
②设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
| A.滴入NaOH溶液体积为25.00mL时:c(Na+)>c(H2C2O4)>c(C2O42-)>c(H+) |
| B.pH=7的溶液:c(Na+)=c(C2O42-)+c(HC2O4-) |
| C.当c(Na+)=2c(总)时:c(OH-)=c(H+)+c((HC2O4-)+c(H2C2O4) |
| D.0.1000mol·L-1H2C2O4溶液:c(H+)=0.1000mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4) |
您最近一年使用:0次
名校
4 . 25℃时,向0.1mol/LCH3COOH溶液中逐渐加入NaOH固体,恢复至原温度后溶液中的关系如图所示(忽略溶液体积变化)。下列有关叙述不正确的是( )


| A.CH3COOH的Ka=1.0×10-4.7 |
| B.C点的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C.B点的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) |
| D.A点的溶液中:c(CH3COO-)+c(H+)+c(CH3COOH)-c(OH-)=0.1mol/L |
您最近一年使用:0次
2020-02-09更新
|
592次组卷
|
5卷引用:山西省大同市2020届高三第一次联合考试(市直)化学试题
名校
5 . 常温时,下列说法正确的是
| A.中和等体积、等浓度的氨水和氢氧化钠溶液至pH=7,前者消耗的盐酸多 |
| B.0.1mol/L 的NaHA溶液,其pH=4,则:c(HA-)>c((H+)>c(H2A)>c(A2-) |
| C.已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7、Ka2=4.7×10-11,据此可推测出将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 |
| D.将0.2mol/L的某一元酸HA溶液和0.1mol/LNaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液2c(OH-)+c(A-)=2c(H+)+c(HA) |
您最近一年使用:0次
2018-12-06更新
|
898次组卷
|
4卷引用:山西省运城市2019届高三12月份化学测试题
2012·山西·一模
6 . 在t℃时某 的稀溶液中
的稀溶液中 已知
已知 向该溶液中逐滴加入PH=c的盐液,测得混合溶液的部分PH如下表所示
向该溶液中逐滴加入PH=c的盐液,测得混合溶液的部分PH如下表所示
混合溶液的部分PH
假设溶液混合前后的体积变化忽略不计,则c的数值为
 的稀溶液中
的稀溶液中 已知
已知 向该溶液中逐滴加入PH=c的盐液,测得混合溶液的部分PH如下表所示
向该溶液中逐滴加入PH=c的盐液,测得混合溶液的部分PH如下表所示混合溶液的部分PH
 溶液体积/ml 溶液体积/ml | 盐液的体积/ml | 溶液的PH | |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.0 | 22.00 | 6 |
| A.3 | B.4 | C.5 | D.6 |
您最近一年使用:0次



