名校
解题方法
1 . 用 溶液滴定
溶液滴定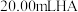 溶液过程中的
溶液过程中的 变化如图所示:
变化如图所示:

下列叙述正确的是
 溶液滴定
溶液滴定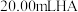 溶液过程中的
溶液过程中的 变化如图所示:
变化如图所示:
下列叙述正确的是
A.初始 溶液中的电离度 溶液中的电离度 : : |
B.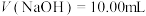 时,混合溶液中有 时,混合溶液中有 |
C.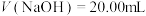 时,混合溶液中有 时,混合溶液中有 |
| D.该滴定过程选甲基橙作指示剂比选酚酞作指示剂,产生的误差更小 |
您最近一年使用:0次
名校
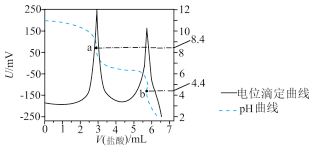
2 . 电位滴定法是根据滴定过程中被测离子浓度发生突跃,指示电极电位也产生突跃,从而确定滴定终点的一种滴定分析方法。常温下,利用盐酸滴定一定物质的量浓度的碳酸钠溶液,其电位滴定曲线与pH曲线如图所示(已知:碳酸的电离常数 )。下列说法不正确的是
)。下列说法不正确的是
 )。下列说法不正确的是
)。下列说法不正确的是
| A.该实验中,需先后用酚酞和甲基橙作指示剂 |
B.a点: |
| C.水的电离程度:a点>b点 |
D.b点: 比值为 比值为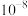 |
您最近一年使用:0次
名校
解题方法
3 . 碱式氯化铜是重要的无机杀菌剂,是一种绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
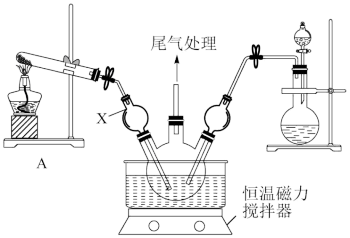
(1)仪器X的名称是___________ ,其主要作用有导气、___________ 。
(2)实验室利用装置A制NH3,发生反应的化学方程式为___________ 。
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象有___________ 。
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.29 g,加硝酸溶解,并加水定容至200 mL,得到待测液。
(4)铜的测定:取20.00 mL待测液,经测定Cu2+浓度为0.2 mol·L-1.则称取的样品中 n(Cu2+)=___________ mol。
(5)采用沉淀滴定法测定氯:用NH4SCN标准溶液滴定过量的AgNO3(已知:AgSCN是一种难溶于水的白色固体),实验如下图:

①滴定时,应选用下列哪种物质作为指示剂___________ (填标号)。
a.FeSO4 b.Fe(NO3)3 c.FeCl3
②重复实验操作三次,消耗NH4SCN溶液的体积平均为10.00 mL。则称取的样品中n(Cl-)=___________ mol。
(6)根据上述实验结果可推知无水碱式氯化铜的化学式为___________ 。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。

(1)仪器X的名称是
(2)实验室利用装置A制NH3,发生反应的化学方程式为
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象有
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.29 g,加硝酸溶解,并加水定容至200 mL,得到待测液。
(4)铜的测定:取20.00 mL待测液,经测定Cu2+浓度为0.2 mol·L-1.则称取的样品中 n(Cu2+)=
(5)采用沉淀滴定法测定氯:用NH4SCN标准溶液滴定过量的AgNO3(已知:AgSCN是一种难溶于水的白色固体),实验如下图:

①滴定时,应选用下列哪种物质作为指示剂
a.FeSO4 b.Fe(NO3)3 c.FeCl3
②重复实验操作三次,消耗NH4SCN溶液的体积平均为10.00 mL。则称取的样品中n(Cl-)=
(6)根据上述实验结果可推知无水碱式氯化铜的化学式为
您最近一年使用:0次
2021-07-24更新
|
803次组卷
|
8卷引用:重庆育才中学高2021届高亖下学期二诊模拟考试化学试题
重庆育才中学高2021届高亖下学期二诊模拟考试化学试题重庆市第七中学校2022届高三第二次月考化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】01(已下线)理综化学-2021年秋季高三开学摸底考试卷03(课标全国专用)(已下线)第八单元 水溶液中的离子平衡(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)福建省泉州市安溪一中、泉州实验中学、养正中学2021-2022学年高三下学期期初联考化学试题吉林省四平市第一高级中学2022-2023学年高三上学期第三次月考化学试题(已下线)实验综合题
解题方法
4 . 常温下,分别用 0.01mol/L 的 NaOH 溶液滴定与之等浓度的体积均为 25.00mL 的 HA、H3B(三元酸)溶液,溶液的 pH 随V(NaOH)变化曲线如图所示,下列说法错误的是
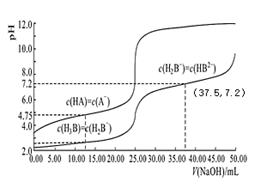

| A.常温下 K(HA)数量级约为10-5 |
| B.常温下 0.01mol/L 的 NaH2B溶液的 pH 大于 7 |
| C.NaOH 溶液滴定 HA 溶液应选择酚酞作为指示剂 |
| D.当横坐标为 37.50时,溶液中存在:2c(H+)+c(H2B-)+3c(H3B)=2c(OH-)+3c(B3-)+c(HB2-) |
您最近一年使用:0次
2020-04-06更新
|
465次组卷
|
4卷引用:重庆市直属校(重庆市第八中学等)2020届高三3月月考理综化学试题
重庆市直属校(重庆市第八中学等)2020届高三3月月考理综化学试题湖南省邵阳市重点学校2020届高三综合模拟考试理综化学试题(已下线)考点12 盐类水解及其应用-2020年高考化学命题预测与模拟试题分类精编(已下线)课时44 滴定曲线、分布系数曲线的分析-2022年高考化学一轮复习小题多维练(全国通用)
名校
5 . 用AG表示溶液酸度: 。在室温下,用 0.1mol•L-1的NaOH溶液滴定20.00mL 0.1mol•L-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
。在室温下,用 0.1mol•L-1的NaOH溶液滴定20.00mL 0.1mol•L-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是

 。在室温下,用 0.1mol•L-1的NaOH溶液滴定20.00mL 0.1mol•L-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
。在室温下,用 0.1mol•L-1的NaOH溶液滴定20.00mL 0.1mol•L-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
| A.0.1mol•L-1的CH3 COOH溶液的pH=3.4 |
| B.A点加入的NaOH溶液的体积为20.00mL |
| C.滴定过程中,c(CH3COO-)/c(H+)逐渐减小 |
| D.B点溶液中可能存在c(Na+)>c(CH3COO-)> c(OH-)>c(H+) |
您最近一年使用:0次
2019-04-10更新
|
735次组卷
|
2卷引用:【全国百强校】重庆南开中学高2019届高三下学期4月考试理科综合化学试题
6 . NaOH和盐酸都是中学化学常见的试剂
(一)某同学用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液浓度
(1)将5.0g烧碱样品( 杂质不与酸反应)配成250 mL待测液,取10.00 mL待测液,用________ 式滴定管量取,下图是某次滴定时的滴定管中的液面,其读数为________ mL。

(2)由下表数据, NaOH的百分含量是________ 。
(3)用标准盐酸滴定某浓度的NaOH溶液,下列操作可能使测定结果偏高的是( )
A.用蒸馏水洗锥形瓶后,直接取10.00 mL待测液注入锥形瓶中
B.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次
C.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
D.对酸式滴定管,滴定前正确读数,滴定后俯视读数
(二)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液测定计算中和反应的反应热。回答下列问题:

(4)从实验装置上看,图中缺少的一种玻璃用品是__________ 。如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将________ ( 填“偏大”、“偏小”或“无影响”)。
(5)已知盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73 kJ的热量,则表示该反应中和热的热化学方程式为:_______________ 。
(三)常温时,向盛有0.1 mol·L-1Mg2+溶液的试管中滴加适量的NaOH溶液,到pH为11.0时(已知Ksp Mg(OH)2=5.61×10‾12)
(6)此时上层清液中c(Mg2+)=________ mol·L-1
(一)某同学用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液浓度
(1)将5.0g烧碱样品( 杂质不与酸反应)配成250 mL待测液,取10.00 mL待测液,用

(2)由下表数据, NaOH的百分含量是
| 滴定次数 | 待测NaOH溶液体积(mL) | 标准盐酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
(3)用标准盐酸滴定某浓度的NaOH溶液,下列操作可能使测定结果偏高的是
A.用蒸馏水洗锥形瓶后,直接取10.00 mL待测液注入锥形瓶中
B.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次
C.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
D.对酸式滴定管,滴定前正确读数,滴定后俯视读数
(二)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液测定计算中和反应的反应热。回答下列问题:

(4)从实验装置上看,图中缺少的一种玻璃用品是
(5)已知盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73 kJ的热量,则表示该反应中和热的热化学方程式为:
(三)常温时,向盛有0.1 mol·L-1Mg2+溶液的试管中滴加适量的NaOH溶液,到pH为11.0时(已知Ksp Mg(OH)2=5.61×10‾12)
(6)此时上层清液中c(Mg2+)=
您最近一年使用:0次
2018-04-13更新
|
376次组卷
|
3卷引用:重庆市綦江区2017-2018学年高二上学期期末联考化学试题
重庆市綦江区2017-2018学年高二上学期期末联考化学试题【懂做原理题】2020届高三化学选修4二轮专题练——中和热及其测定【精编25题】(已下线)专题6.2 实验综合题(必考)(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升
名校
解题方法
7 . 甲胺(CH3NH2) 的性质与氨相似。25℃时,向10mL1.0000mol·L-1甲胺溶液中滴入0.5000mol·L-1的稀硫酸,溶液的pOH 与所加稀硫酸的体积(V)关系如图所示。
已知:pOH=-lgc(OH-),Kb(CH3NH2·H2O)=4.0×10-4。下列说法正确的是
已知:pOH=-lgc(OH-),Kb(CH3NH2·H2O)=4.0×10-4。下列说法正确的是

| A.pOH=7 时,2c(CH3NH3+)=c(SO42-) |
| B.水的电离程度:c>b>a |
| C.a点溶液中存在:c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-) |
| D.25℃时1.000 mol·L-1甲胺溶液中CH3NH2·H2O的电离度约为2.0% |
您最近一年使用:0次
2018-03-06更新
|
259次组卷
|
2卷引用:2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题
8 . 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是
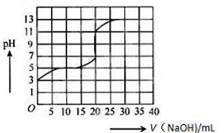

| A.该弱酸在滴定前的浓度大于0.001mol/L |
| B.由滴定起点数据可计算该弱酸的Ka(电离平衡常数)为2×10-5 |
| C.滴定过程为求滴定终点,最合适的指示剂是酚酞 |
| D.滴定终点时,c(Na+) >c(A-) > c(OH-) >c(H+) |
您最近一年使用:0次
2016-05-24更新
|
706次组卷
|
4卷引用:2016届重庆市一中高三下学期模拟考试理综化学试卷



