2021·全国·模拟预测
名校
解题方法
1 . 电位滴定是利用溶液电位突变指示终点的滴定法。常温下,用cmol·L−1HCl标准溶液测定VmL某生活用品中Na2CO3的含量(假设其它物质均不反应,且不含碳、钠元素),得到滴定过程中溶液电位与V(HCl)的关系如图所示。已知:两个滴定终点时消耗盐酸的体积差可计算出Na2CO3的量。
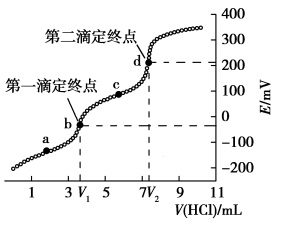
下列说法正确的是

下列说法正确的是
A.a至c点对应溶液中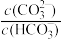 逐渐增大 逐渐增大 |
| B.水的电离程度:a>b>d>c |
C.a溶液中存在:c(Na+)+c(H+)=c( )+2c( )+2c( )+c(OH−) )+c(OH−) |
| D.VmL生活用品中含有Na2CO3的质量为0.106c(V2−V1)g |
您最近一年使用:0次
2021-05-14更新
|
1904次组卷
|
15卷引用:2021年湖南省高考化学试卷变式题1-10
2021年湖南省高考化学试卷变式题1-10湖南师范大学附属中学2021-2022学年高三下学期高考模拟(一)化学试题(已下线)化学-学科网2021年高三5月大联考(新课标Ⅰ卷)(已下线)化学-学科网2021年高三5月大联考(新课标Ⅲ卷)(已下线)2021年高考化学押题预测卷(广东卷)(03)(已下线)化学-学科网2021年高三5月大联考(新课标Ⅱ卷)辽宁省东北育才学校高中部高三2021-2022下学期开学初第六次模拟考试化学试题福建省龙岩第一中学2022届高三毕业班模拟训练(二)化学试题湖南省岳阳县第一中学2022届高三下学期5月月考化学试题江西省南昌市八一中学2022届高三下学期第三次模拟考试理科综合化学试题(已下线)专题19 沉淀溶解平衡的图像问题分析-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)辽宁省沈阳市第五中学2021-2022学年高三下学期3月月考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)辽宁省沈阳市第二中学2022-2023学年高三上学期12月阶段测试化学试题巩固训练10
名校
2 . 常温下,将0.1000 mol·L-1的KOH溶液分别滴加到20.00 mL浓度均为0.1000 mol·L-1的一元酸HX和HY溶液中,溶液的pH与所加 KOH 溶液体积的关系如图所示,下列叙述错误的是


| A.M点溶液中c(K+)>c(X-)>c(OH-)>c(H+) |
| B.常温下用0.1000 mol·L-1的氨水(Kb=1.8x10-5)滴定0.1000 mol·L-1HX溶液可用酚酞做指示剂 |
| C.N点溶液中,c(Y-)+2c(OH-)=2c(H+)+c(HY) |
| D.常温下,将0.1000 mol·L-1HX溶液和0.2000mol·L-1KY溶液等体积混合,混合液呈酸性 |
您最近一年使用:0次
2021-04-04更新
|
718次组卷
|
5卷引用:湖南省大联考雅礼十六校2021-2022学年高三第二次联考化学试题
湖南省大联考雅礼十六校2021-2022学年高三第二次联考化学试题安徽省池州市2021届高三下学期4月普通高中教学质量统一监测(二模)理综化学试题(已下线)化学-2022年高考考前押题密卷(广东卷)湖南省长沙市麓山国际实验学校2022-2023学年高三下学期3月月考化学试题(已下线)难点7 溶液稀释与酸碱中和滴定曲线分析-2021年高考化学【热点·重点·难点】专练(山东专用)
解题方法
3 . 25℃时,0.10 L某二元弱酸H2A用1.00 mol·L-1NaOH溶液调节其pH,溶液中H2A、HA-及A2-的物质的量浓度变化如图所示:

下列说法错误 的是

下列说法
| A.H2A的Ka1=1×10-4 |
| B.溶液在X点和Z点时水的电离程度相同 |
| C.在Y点时,c(Na+)>3c(A2-) |
| D.0.1 mol·L-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-) |
您最近一年使用:0次
2020-11-11更新
|
641次组卷
|
2卷引用:湖南省永州市2021届高三第二次模拟考试理综化学试题
解题方法
4 . 常温下,分别用 0.01mol/L 的 NaOH 溶液滴定与之等浓度的体积均为 25.00mL 的 HA、H3B(三元酸)溶液,溶液的 pH 随V(NaOH)变化曲线如图所示,下列说法错误的是
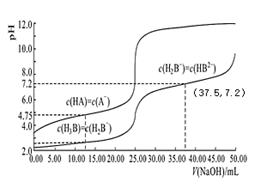

| A.常温下 K(HA)数量级约为10-5 |
| B.常温下 0.01mol/L 的 NaH2B溶液的 pH 大于 7 |
| C.NaOH 溶液滴定 HA 溶液应选择酚酞作为指示剂 |
| D.当横坐标为 37.50时,溶液中存在:2c(H+)+c(H2B-)+3c(H3B)=2c(OH-)+3c(B3-)+c(HB2-) |
您最近一年使用:0次
2020-04-06更新
|
465次组卷
|
4卷引用:湖南省邵阳市重点学校2020届高三综合模拟考试理综化学试题
湖南省邵阳市重点学校2020届高三综合模拟考试理综化学试题重庆市直属校(重庆市第八中学等)2020届高三3月月考理综化学试题(已下线)考点12 盐类水解及其应用-2020年高考化学命题预测与模拟试题分类精编(已下线)课时44 滴定曲线、分布系数曲线的分析-2022年高考化学一轮复习小题多维练(全国通用)
解题方法
5 . 工业生产中产生的 、NO直接排放将对大气造成严重污染.利用电化学原理吸收
、NO直接排放将对大气造成严重污染.利用电化学原理吸收 和NO,同时获得
和NO,同时获得  和
和  产品的工艺流程图如下
产品的工艺流程图如下 为铈元素
为铈元素 。
。
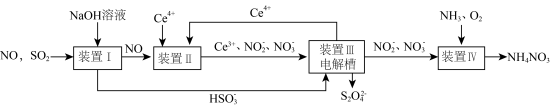
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成 的离子方程式
的离子方程式 ______ .
(2)含硫各微粒 、
、 和
和 存在于
存在于 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数 与溶液pH的关系如图1所示.
与溶液pH的关系如图1所示.
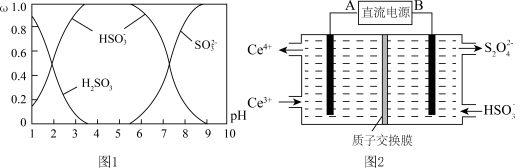
①下列说法正确的是______  填标号
填标号 .
.
A 时,溶液中
时,溶液中


B 由图中数据,可以估算出 的第二级电离平衡常数
的第二级电离平衡常数
C 为获得尽可能纯的 ,应将溶液的pH控制在
,应将溶液的pH控制在  为宜
为宜
D 和
和  时的溶液中所含粒子种类不同
时的溶液中所含粒子种类不同
②若 的NaOH溶液完全吸收
的NaOH溶液完全吸收 标况下
标况下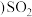 ,则反应的离子方程式为
,则反应的离子方程式为 ______ .
③取装置Ⅰ中的吸收液vmL,用 的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在
的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在 ______  填“酸式”或“碱式”
填“酸式”或“碱式” 滴定管中,判断滴定终点的方法是
滴定管中,判断滴定终点的方法是 ______ .
(3)装置Ⅲ的作用之一是再生 ,其原理如图2所示.图中A为电源的
,其原理如图2所示.图中A为电源的 ______  填“正”或“负”
填“正”或“负” 极.右侧反应室中发生的主要电极反应式为
极.右侧反应室中发生的主要电极反应式为 ______ .
(4)已知进入装置Ⅳ的溶液中 的浓度为
的浓度为 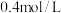 ,要使
,要使  该溶液中的
该溶液中的 完全转化为
完全转化为  ,需至少向装置Ⅳ中通入标准状况下的
,需至少向装置Ⅳ中通入标准状况下的  的体积为
的体积为 ______ L.
 、NO直接排放将对大气造成严重污染.利用电化学原理吸收
、NO直接排放将对大气造成严重污染.利用电化学原理吸收 和NO,同时获得
和NO,同时获得  和
和  产品的工艺流程图如下
产品的工艺流程图如下 为铈元素
为铈元素 。
。
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成
 的离子方程式
的离子方程式 (2)含硫各微粒
 、
、 和
和 存在于
存在于 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数 与溶液pH的关系如图1所示.
与溶液pH的关系如图1所示.
①下列说法正确的是
 填标号
填标号 .
.A
 时,溶液中
时,溶液中


B 由图中数据,可以估算出
 的第二级电离平衡常数
的第二级电离平衡常数
C 为获得尽可能纯的
 ,应将溶液的pH控制在
,应将溶液的pH控制在  为宜
为宜D
 和
和  时的溶液中所含粒子种类不同
时的溶液中所含粒子种类不同②若
 的NaOH溶液完全吸收
的NaOH溶液完全吸收 标况下
标况下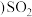 ,则反应的离子方程式为
,则反应的离子方程式为 ③取装置Ⅰ中的吸收液vmL,用
 的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在
的酸性高锰酸钾溶液滴定.酸性高锰酸钾溶液应装在  填“酸式”或“碱式”
填“酸式”或“碱式” 滴定管中,判断滴定终点的方法是
滴定管中,判断滴定终点的方法是 (3)装置Ⅲ的作用之一是再生
 ,其原理如图2所示.图中A为电源的
,其原理如图2所示.图中A为电源的  填“正”或“负”
填“正”或“负” 极.右侧反应室中发生的主要电极反应式为
极.右侧反应室中发生的主要电极反应式为 (4)已知进入装置Ⅳ的溶液中
 的浓度为
的浓度为 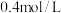 ,要使
,要使  该溶液中的
该溶液中的 完全转化为
完全转化为  ,需至少向装置Ⅳ中通入标准状况下的
,需至少向装置Ⅳ中通入标准状况下的  的体积为
的体积为
您最近一年使用:0次
2020-02-23更新
|
360次组卷
|
3卷引用:2015届湖南省怀化市高三第二次模拟考试理综化学试卷
名校
6 . 25℃时,用NaOH溶液滴定H2C2O4溶液,溶液中 和
和 [或
[或 和
和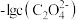 ]的关系如图所示。下列说法不正确的是
]的关系如图所示。下列说法不正确的是

 和
和 [或
[或 和
和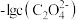 ]的关系如图所示。下列说法不正确的是
]的关系如图所示。下列说法不正确的是
A.曲线M表示 和 和 的关系 的关系 |
| B.Ka1(H2C2O4)的数量级为10-2 |
| C.向NaHC2O4溶液中加少量NaOH至c(HC2O4-)和c(C2O42-)相等,此时溶液pH约为5 |
| D.在NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) |
您最近一年使用:0次
2018-12-06更新
|
1161次组卷
|
3卷引用:【全国百强校】湖南省长沙市长郡中学2019届高三上学期第五次调研考试化学试题
7 . 25℃时,用0.10m/L的弱碱BOH滴定10.00 ml a mol/L的盐酸,溶液的pH与所加BOH溶液体积(V)的关系如图所示。已知N点溶液中存在关系式:c(C1—)=c(B+)+c(BOH)。下列说法正确的是
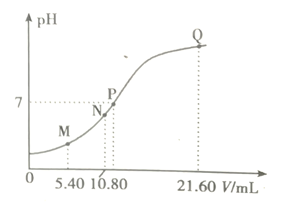

| A.M点溶液中存在c(H+)=c(OH—)+2c(BOH)+c(B+) |
| B.N、Q两点溶液中BOH电离平衡常数:N<Q |
| C.P点BOH过量,此时溶液中c(B+)>c(Cl—) |
| D.a<0.108 |
您最近一年使用:0次
2018-03-10更新
|
351次组卷
|
2卷引用:湖南省衡阳市2018届高三第一次联考(一模)理综化学试题
名校
解题方法
8 . 肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O):CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。
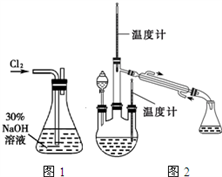
实验一:制备NaClO溶液(实验装置如图1所示)
(1)锥形瓶中发生反应的离子方程式是________________________________________________ 。
实验二:制取水合肼.(实验装置如图2所示)
已知水合肼具有还原性,被氧化生成氮气。
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。
(2)分液漏斗中的溶液是______ (填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________________________________________________ 。
实验三:测定馏分中水合肼的质量分数。采用下列步骤:
A.称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液。
B.移取25.00mL溶液于锥形瓶中,加入10 mL水,摇匀。
C.用0.2000 mol·L-1的I2溶液滴定,至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右,记录消耗碘的标准溶液的体积。
d.进一步操作与数据处理。
(3)水合肼与碘溶液反应的化学方程式为:_______________________ ;
(4)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是_______________ 。
(5)滴定时,碘的标准溶液盛放在___________ (填“酸式”或“碱式”)滴定管中;若三次滴定消耗碘的标准溶液的平均体积为18.00 mL,则馏分中水合肼(N2H4·H2O)的质量分数为____________________ (保留三位有效数字)。

实验一:制备NaClO溶液(实验装置如图1所示)
(1)锥形瓶中发生反应的离子方程式是
实验二:制取水合肼.(实验装置如图2所示)
已知水合肼具有还原性,被氧化生成氮气。
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。
(2)分液漏斗中的溶液是
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是
实验三:测定馏分中水合肼的质量分数。采用下列步骤:
A.称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液。
B.移取25.00mL溶液于锥形瓶中,加入10 mL水,摇匀。
C.用0.2000 mol·L-1的I2溶液滴定,至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右,记录消耗碘的标准溶液的体积。
d.进一步操作与数据处理。
(3)水合肼与碘溶液反应的化学方程式为:
(4)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是
(5)滴定时,碘的标准溶液盛放在
您最近一年使用:0次
2017-12-04更新
|
354次组卷
|
6卷引用:湖南省娄底市第一中学2022届高三下学期第三次模拟考试化学试题
名校
9 . 温度为t℃时,在l0mLl.0mol·L-1的盐酸中,逐滴滴入xmol·L-1的氨水,随着氨水逐渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如下图所示(忽略混合时溶液体积的变化)。下列有关判断正确的是
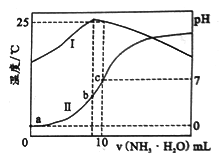

| A.x=1.0 |
| B.a点时,水的电离程度最大 |
| C.b点时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
D.c 点时,c(NH3·H2O)= mol·L-1 mol·L-1 |
您最近一年使用:0次
2017-09-25更新
|
686次组卷
|
2卷引用:湖南省永州市2018届高三上学期第一次模拟考试化学试题
2014·河北石家庄·一模
名校
10 . 关于下列图象的叙述正确的是
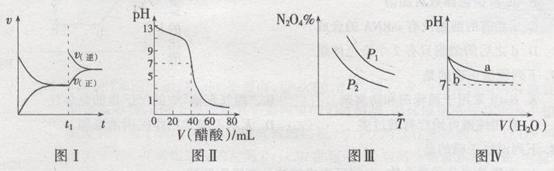

A.图I表示:反应I2(g)+H2(g) 2HI(g) ΔH<0的υ-t关系,其中t1时刻改变的条件为升高温度 2HI(g) ΔH<0的υ-t关系,其中t1时刻改变的条件为升高温度 |
| B.图Ⅱ表示:25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol/L |
C.图Ⅲ表示:反应2NO2(g) N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2 N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2 |
| D.图Ⅳ表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水 |
您最近一年使用:0次
2016-12-09更新
|
1318次组卷
|
4卷引用:湖南省长沙市雅礼中学2017届高考模拟试卷(二)理综化学试题
湖南省长沙市雅礼中学2017届高考模拟试卷(二)理综化学试题(已下线)2014届河北省石家庄市高中毕业班教学质量检测(二)理综化学试卷2020届高三化学知识点强化训练—化学平衡的移动及影响因素夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——酸碱中和滴定(基础过关)



