名校
1 . 用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
I.准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100mL0.1000mol•L-1NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中。
b.加入25.00mL0.1000mol•L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000mol•L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的玻璃仪器除烧杯、玻璃棒和胶头滴管外还需要___________ 。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是___________ 。
(3)滴定应在pH<0.5的条件下进行,其原因是___________ 。
(4)b和c两步操作是否可以颠倒___________ (填“是”或“否”),说明理由___________ 。
(5)所消耗的NH4SCN标准溶液平均体积为________ mL,测得c(I-)=_________ mol•L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为___________ 。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________ ;
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________ 。
I.准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100mL0.1000mol•L-1NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中。
b.加入25.00mL0.1000mol•L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000mol•L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的玻璃仪器除烧杯、玻璃棒和胶头滴管外还需要
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是
(3)滴定应在pH<0.5的条件下进行,其原因是
(4)b和c两步操作是否可以颠倒
(5)所消耗的NH4SCN标准溶液平均体积为
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果
您最近半年使用:0次
名校
2 . 滴定法是化学分析常用方法,是一种简便、快速和应用广泛的定量分析方法。
I.某实验小组用已知浓度的NaOH标准液来滴定未知浓度的醋酸溶液。
(1)实验室先用NaOH固体配制0.1000mol/L的NaOH溶液240mL。
①本实验必须用到的仪器有天平、药匙、玻璃棒、胶头滴管、烧杯、_____ 。
②要完成本实验该同学应称出NaOH的质量为_____ g。
(2)取25.00mL待测液于250mL锥形瓶中,加入2~3滴指示剂,用0.1000mol/LNaOH标准溶液滴定至终点,按上述操作重复3次。回答下列问题。
①滴定过程中加入的指示剂为_____ ;
②滴定时边滴边摇动锥形瓶,眼睛注视_____ ;
③三次实验数据记录如表所示:
根据表中数据计算出醋酸待测液的浓度为_____ 。
④在上述实验过程中,出现下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有_____ (填序号)。
a.量取标准液的碱式滴定管未用标准液润洗
b.取醋酸的酸式滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失
c.锥形瓶用蒸馏水洗涤后,水未倒尽,仍残留一定量水
d.当滴定结束时,俯视碱式滴定管读数
II.氧化还原滴定与酸碱中和滴定类似,可用于KIO₃粗产品的纯度测定。
称取mg产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀硫酸,充分反应后加入淀粉溶液作指示剂,用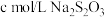 标准溶液滴定至终点(
标准溶液滴定至终点(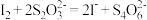 ),平均消耗标准溶液的体积为VmL。
),平均消耗标准溶液的体积为VmL。
(3)加入KI和稀H₂SO₄后发生反应的离子方程式为_____ 。
(4)滴定终点的现象为_____ ,则产品中KIO3的质量分数为_____ %。
I.某实验小组用已知浓度的NaOH标准液来滴定未知浓度的醋酸溶液。
(1)实验室先用NaOH固体配制0.1000mol/L的NaOH溶液240mL。
①本实验必须用到的仪器有天平、药匙、玻璃棒、胶头滴管、烧杯、
②要完成本实验该同学应称出NaOH的质量为
(2)取25.00mL待测液于250mL锥形瓶中,加入2~3滴指示剂,用0.1000mol/LNaOH标准溶液滴定至终点,按上述操作重复3次。回答下列问题。
①滴定过程中加入的指示剂为
②滴定时边滴边摇动锥形瓶,眼睛注视
③三次实验数据记录如表所示:
| 滴定次数 | 滴定前碱式滴定管读数/mL | 滴定后碱式滴定管读数/mL |
| 1 | 1.00 | 30.95 |
| 2 | 2.03 | 29.23 |
| 3 | 0.56 | 30.61 |
④在上述实验过程中,出现下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有
a.量取标准液的碱式滴定管未用标准液润洗
b.取醋酸的酸式滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失
c.锥形瓶用蒸馏水洗涤后,水未倒尽,仍残留一定量水
d.当滴定结束时,俯视碱式滴定管读数
II.氧化还原滴定与酸碱中和滴定类似,可用于KIO₃粗产品的纯度测定。
称取mg产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀硫酸,充分反应后加入淀粉溶液作指示剂,用
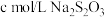 标准溶液滴定至终点(
标准溶液滴定至终点(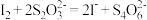 ),平均消耗标准溶液的体积为VmL。
),平均消耗标准溶液的体积为VmL。(3)加入KI和稀H₂SO₄后发生反应的离子方程式为
(4)滴定终点的现象为
您最近半年使用:0次
2023-11-09更新
|
327次组卷
|
3卷引用:新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题
名校
3 . 乙二酸是一种有机酸,俗名草酸,化学式为H2C2O4,广泛分布于植物、动物和真菌体中,常温下,用pH试纸测得0.2mol/L的H2C2O4溶液的pH=3。
(1)乙二酸的电离方程式为___________ 。
(2)测定血液样品中Ca2+的浓度。取血液样品50.00mL,加适量的草酸铵[(NH4)2C2O4]溶液可析出CaC2O4沉淀,将洗涤后的CaC2O4沉淀溶于强酸可得H2C2O4,将H2C2O4溶液稀释成250mL。再用0.010mol/L酸性KMnO4溶液进行滴定。
①滴定过程中操作滴定管的图示正确的是___________ 。
A.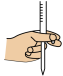 B.
B.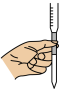
②滴定达到终点的判断是___________ 。
③如图是第一次滴定结束时滴定管中的液面,读数为a=___________ mL。
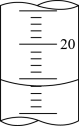
④根据下列数据计算:
滴定时MnO 被还原为Mn2+的离子方程式为
被还原为Mn2+的离子方程式为___________ 。计算血液样品中Ca2+的浓度为___________ mol/L。
⑤下列操作可能造成测得的Ca2+浓度偏高的是___________ 。
A.滴定前平视,滴定后俯视 B.滴定管未润洗即装入标准液
B.滴定过程中锥形瓶中不慎有液体溅出 D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
(1)乙二酸的电离方程式为
(2)测定血液样品中Ca2+的浓度。取血液样品50.00mL,加适量的草酸铵[(NH4)2C2O4]溶液可析出CaC2O4沉淀,将洗涤后的CaC2O4沉淀溶于强酸可得H2C2O4,将H2C2O4溶液稀释成250mL。再用0.010mol/L酸性KMnO4溶液进行滴定。
①滴定过程中操作滴定管的图示正确的是
A.
 B.
B.
②滴定达到终点的判断是
③如图是第一次滴定结束时滴定管中的液面,读数为a=

④根据下列数据计算:
| 滴定次数 | 草酸溶液体积(mL) | 标准液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.60 | a |
| 第二次 | 25.00 | 0.10 | 24.10 |
| 第三次 | 25.00 | 1.20 | 25.20 |
 被还原为Mn2+的离子方程式为
被还原为Mn2+的离子方程式为⑤下列操作可能造成测得的Ca2+浓度偏高的是
A.滴定前平视,滴定后俯视 B.滴定管未润洗即装入标准液
B.滴定过程中锥形瓶中不慎有液体溅出 D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
您最近半年使用:0次
名校
4 . 某学生用0.1500 mol/L NaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:

A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写)______→_______→F→______→______→______→D。______
(2)操作F中应该选择图中滴定管___________ (填标号)。
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察___________ 。
(4)滴定结果如表所示:
计算该盐酸的物质的量浓度为___________ (精确至0.0001)。
(5)下列操作会导致测定结果偏高的是___________。
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20 mL1.0×10−4 mol/L的KMnO4溶液。
写出用KMnO4滴定H2C2O4的离子方程式___________ ,判断滴定终点是___________ 。
(7)已知常温下:
①Ka1(H2CO3)=4.4×10−7,Ka2(H2CO3)=4.7×10−11;
②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。

①比较H2R、HR-、H2CO3三者的酸性强弱___________ 。
②NaHR溶液中存在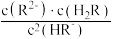 =
=___________ 。
(8)学习小组用50mL 0.50 mol/L NaOH溶液和30mL0.50 mol/L硫酸溶液进行中和热的测定。
①大小烧杯之间填满碎纸条的作用是___________ ,从实验装置上看,图中缺少的一种玻璃仪器___________ 。
②写出该反应用中和热表示的热化学方程式___________ [中和热测得为57.3kJ/mol。
③实验中若用60mL 0.25mol/L 溶液跟50mL 0.5 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量
溶液跟50mL 0.5 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”、“不相等”),所求中和热___________ (填“相等”、“不相等”);若用50mL 0.50 mol/L醋酸代替 溶液进行上述实验,则反应热
溶液进行上述实验,则反应热 的绝对值
的绝对值___________ (填“偏大”、“偏小”、“不受影响)”。

A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写)______→_______→F→______→______→______→D。
(2)操作F中应该选择图中滴定管
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(4)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.60 | 20.60 |
| 3 | 25.00 | 0.20 | 20.19 |
(5)下列操作会导致测定结果偏高的是___________。
| A.碱式滴定管在装液前未用标准NaOH溶液润洗 |
| B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出 |
| C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡 |
| D.达到滴定终点时,仰视读数 |
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20 mL1.0×10−4 mol/L的KMnO4溶液。
写出用KMnO4滴定H2C2O4的离子方程式
(7)已知常温下:
①Ka1(H2CO3)=4.4×10−7,Ka2(H2CO3)=4.7×10−11;
②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。

①比较H2R、HR-、H2CO3三者的酸性强弱
②NaHR溶液中存在
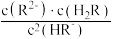 =
=(8)学习小组用50mL 0.50 mol/L NaOH溶液和30mL0.50 mol/L硫酸溶液进行中和热的测定。
①大小烧杯之间填满碎纸条的作用是

②写出该反应用中和热表示的热化学方程式
③实验中若用60mL 0.25mol/L
 溶液跟50mL 0.5 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量
溶液跟50mL 0.5 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 溶液进行上述实验,则反应热
溶液进行上述实验,则反应热 的绝对值
的绝对值
您最近半年使用:0次
解题方法
5 . 实验室欲测定某NaOH溶液的物质的量浓度,用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。请回答下列问题:
(1)滴定管是酸碱中和滴定中重要的仪器,向 碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为
碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为 ,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为
,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为_______ (填“大于”“小于”或“等于”) 。
。
(2)向碱式滴定管中注入氢氧化钠溶液之前的一步操作_______ 。
(3)该实验滴定至终点的现象为_______ 。
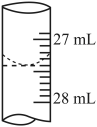
(4)甲同学记录滴定前滴定管内液面读数0.50mL,滴定后液面如图所示,则此时消耗标准溶液的体积为_______ 。
(5)由表格可知,3次滴定中,有一次滴定所用盐酸体积明显偏差,其可能的原因是_______。
(6)读取上述合理数据,计算出待测NaOH溶液的物质的量浓度为_______ 。
(1)滴定管是酸碱中和滴定中重要的仪器,向
 碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为
碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为 ,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为
,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为 。
。(2)向碱式滴定管中注入氢氧化钠溶液之前的一步操作
(3)该实验滴定至终点的现象为
(4)甲同学记录滴定前滴定管内液面读数0.50mL,滴定后液面如图所示,则此时消耗标准溶液的体积为

(5)由表格可知,3次滴定中,有一次滴定所用盐酸体积明显偏差,其可能的原因是_______。
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 1.00 | 27.31 |
| A.锥形瓶用待测液润洗 | B.滴定过程中锥形瓶中溶液溅出瓶外 |
| C.滴定前滴定管尖嘴有气泡,滴定结束气泡消失 | D.滴定结束时,俯视读数 |
(6)读取上述合理数据,计算出待测NaOH溶液的物质的量浓度为
您最近半年使用:0次
6 . 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①碱式滴定管用蒸馏水洗净后,再用待测溶液润洗2~3次,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中。
②酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)滴定时边滴边摇动锥形瓶,眼睛应观察_______ ;滴定终点时的现象为锥形瓶中的溶液由_______ ;
(2)该小组在步骤①中的错误是_______ ,由此造成的测定结果_______ (填“偏高”或“偏低”或“无影响”);
(3)步骤②缺少的操作是_______ ,由此造成的测定结果_______ (填“偏高”或“偏低”或“无影响”);
(4)若滴定前平视,滴定终了俯视,使滴定结果_______ ,若酸式滴定管滴定前尖嘴部分有气泡,滴定终了没有气泡使滴定结果_______ (填“偏高”或“偏低”或“无影响”);
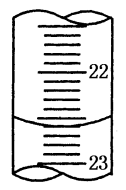
(5)如图是某次滴定时的滴定管中的液面,其读数为_______ mL;
(6)根据下列数据:
请计算待测烧碱溶液的物质的量浓度_______ 。(请写出解答过程)
①碱式滴定管用蒸馏水洗净后,再用待测溶液润洗2~3次,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中。
②酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)滴定时边滴边摇动锥形瓶,眼睛应观察
(2)该小组在步骤①中的错误是
(3)步骤②缺少的操作是
(4)若滴定前平视,滴定终了俯视,使滴定结果
(5)如图是某次滴定时的滴定管中的液面,其读数为

(6)根据下列数据:
| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
您最近半年使用:0次
名校
7 . I.用中和滴定法测定某烧碱的纯度。将2.5g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成250mL溶液。根据实验回答下列问题:
(1)滴定
①用_____ (仪器名称)量取20.00mL待测液置于锥形瓶中,再滴加2滴酚酞试液。
②用_____ (仪器名称)盛装0.2000 mol·L-1盐酸标准液,盛装前务必_____ ,防止标准液浓度降低。
③滴定过程中眼睛应注视_________ ,滴定终点的现象为:_______ 。
(2)有关数据记录如下:
计算V=_______ mL
(3)纯度计算:NaOH溶液的浓度为_______ mol·L-1,烧碱样品的纯度为_______ 。
(4)试判断以下几种情况对烧碱纯度测定的影响(填“偏大”、“偏小”或“无影响”):
①若用蒸馏水冲洗锥形瓶,则会使测定结果_______ ;
②若滴定前滴定管尖嘴有气泡,滴定后气泡消失,则会使测定结果_______ ;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果_______ ;
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果_______ 。
II.氧化还原滴定与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。硫代硫酸钠(Na2S2O3)又称大苏打,可用作定影剂、还原剂。现有某种硫代硫酸钠样品,为了测定该样品纯度。
(5)称取10.0g该硫代硫酸钠样品,配成100ml 溶液,取0.10 mol·L-1的K2Cr2O7 (硫酸酸化)标准溶液20. 00 mL,加入过量KI,发生。反应: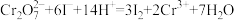 ,然后加入
,然后加入_______ 溶液作为指示剂,用硫代硫酸钠样品溶液滴定至终点,发生反应: ,到达滴定终点时的现象为
,到达滴定终点时的现象为_______ 。重复实验2~3次,平均消耗Na2S2O3样品溶液的体积为20. 0 mL。
(6)样品纯度的计算:根据上述有关数据,该样品中Na2S2O3的质量分数为_______ 。
(1)滴定
①用
②用
③滴定过程中眼睛应注视
(2)有关数据记录如下:
| 滴定序号 | 待测液体体积(mL) | 滴定前(mL) | 滴定后(mL) | 所消耗盐酸标准液的平均体积(mL) |
| 1 | 20.00 | 0.50 | 20.70 | V |
| 2 | 20.00 | 6.00 | 26.00 |
(3)纯度计算:NaOH溶液的浓度为
(4)试判断以下几种情况对烧碱纯度测定的影响(填“偏大”、“偏小”或“无影响”):
①若用蒸馏水冲洗锥形瓶,则会使测定结果
②若滴定前滴定管尖嘴有气泡,滴定后气泡消失,则会使测定结果
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果
II.氧化还原滴定与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。硫代硫酸钠(Na2S2O3)又称大苏打,可用作定影剂、还原剂。现有某种硫代硫酸钠样品,为了测定该样品纯度。
(5)称取10.0g该硫代硫酸钠样品,配成100ml 溶液,取0.10 mol·L-1的K2Cr2O7 (硫酸酸化)标准溶液20. 00 mL,加入过量KI,发生。反应:
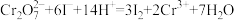 ,然后加入
,然后加入 ,到达滴定终点时的现象为
,到达滴定终点时的现象为(6)样品纯度的计算:根据上述有关数据,该样品中Na2S2O3的质量分数为
您最近半年使用:0次
名校
8 . 按要求回答下列问题
(1)一定温度下,现有a.盐酸,b.硫酸,c.醋酸三种酸
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是_______ (用a、b、c表示)
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是_______ (用a、b、c表示)
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为_______ (用a、b、c表示)
(2)用已知物质的量浓度的NaOH溶液滴定未知浓度的盐酸时,可能有以下操作:
①用蒸馏水洗涤碱式滴定管后,直接装入已知浓度的NaOH溶液;
②经检查碱式滴定管不漏液,胶管中玻璃珠控制灵活后,用少量已知的NaOH溶液洗涤2~3次后再装入碱液,将液面调至刻度“0”处,用滴定管夹将其固定在铁架台上;
③用待测盐酸润洗移液管移取一定体积的待测盐酸,放至用蒸馏水洗净的锥形瓶中;
④往锥形瓶中滴加几滴甲基橙,在瓶下垫一张白纸;
⑤手捏碱式滴定管中的玻璃珠,快速放液以使指示剂尽快变色;
⑥指示剂变色后再滴加几滴碱液,以稳定变色。
以上操作中错误的是_______
(3)现用中和滴定法测定某烧碱溶液的浓度。有关数据记录如表:
用_______ 式滴定管盛装0.2500mol·L-1盐酸标准液。如图表示第二次滴定前后50mL滴定管中液面的位置
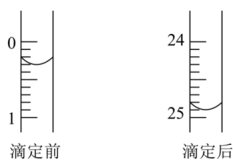
该次滴定所用标准盐酸体积为_______ mL。
②现实验室中有石蕊和酚酞两种指示剂,该实验应选用_______ 作指示剂。
③根据所给数据,该烧碱样品的物质的量浓度为_______ mol·L-1(保留四位有效数字)。
④若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果_______ (填“偏低”“偏高”或“无影响”)。
(1)一定温度下,现有a.盐酸,b.硫酸,c.醋酸三种酸
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为
(2)用已知物质的量浓度的NaOH溶液滴定未知浓度的盐酸时,可能有以下操作:
①用蒸馏水洗涤碱式滴定管后,直接装入已知浓度的NaOH溶液;
②经检查碱式滴定管不漏液,胶管中玻璃珠控制灵活后,用少量已知的NaOH溶液洗涤2~3次后再装入碱液,将液面调至刻度“0”处,用滴定管夹将其固定在铁架台上;
③用待测盐酸润洗移液管移取一定体积的待测盐酸,放至用蒸馏水洗净的锥形瓶中;
④往锥形瓶中滴加几滴甲基橙,在瓶下垫一张白纸;
⑤手捏碱式滴定管中的玻璃珠,快速放液以使指示剂尽快变色;
⑥指示剂变色后再滴加几滴碱液,以稳定变色。
以上操作中错误的是
(3)现用中和滴定法测定某烧碱溶液的浓度。有关数据记录如表:
| 滴定序号 | 待测液体积/mL | 所消耗盐酸标准液的体积/mL | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 26.80 | 26.30 |
| 2 | 25.00 |  |  |  |
| 3 | 25.00 | 5.00 | 31.34 | 26.34 |

该次滴定所用标准盐酸体积为
②现实验室中有石蕊和酚酞两种指示剂,该实验应选用
③根据所给数据,该烧碱样品的物质的量浓度为
④若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果
您最近半年使用:0次
9 . 物质 的水溶液中的主要离子均来自下表,常温下将各物质的溶液从
的水溶液中的主要离子均来自下表,常温下将各物质的溶液从 稀释到
稀释到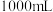 ,
, 的变化关系如图所示,其中B与C反应得到E,且只有E属于盐。回答下列问题:
的变化关系如图所示,其中B与C反应得到E,且只有E属于盐。回答下列问题:
(1)根据 的变化关系,写出物质的化学式:B
的变化关系,写出物质的化学式:B_______ ,C_______ 。
(2)写出A的电离方程式:_______ 。
(3)写出水溶液中B与D反应的离子方程式:_______ 。
(4)某研究性学习小组用 标准溶液滴定
标准溶液滴定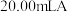 溶液的浓度,实验数据记录如下:
溶液的浓度,实验数据记录如下:
①计算A溶液的浓度为_______ mol/L(保留四位有效数字)。
②某同学设计的下列滴定方式中,最合理的是_______ (夹持部分略去,填字母),达到滴定终点的现象是_______ 。
 的水溶液中的主要离子均来自下表,常温下将各物质的溶液从
的水溶液中的主要离子均来自下表,常温下将各物质的溶液从 稀释到
稀释到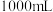 ,
, 的变化关系如图所示,其中B与C反应得到E,且只有E属于盐。回答下列问题:
的变化关系如图所示,其中B与C反应得到E,且只有E属于盐。回答下列问题: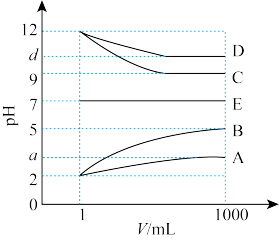
| 阳离子 | 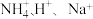 |
| 阴离子 | 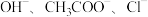 |
 的变化关系,写出物质的化学式:B
的变化关系,写出物质的化学式:B(2)写出A的电离方程式:
(3)写出水溶液中B与D反应的离子方程式:
(4)某研究性学习小组用
 标准溶液滴定
标准溶液滴定 溶液的浓度,实验数据记录如下:
溶液的浓度,实验数据记录如下:| 实验序号 | 1 | 2 | 3 | 4 |
消耗C溶液的体积/ | 20.07 | 20.02 | 18.80 | 19.97 |
②某同学设计的下列滴定方式中,最合理的是
您最近半年使用:0次
2022-10-14更新
|
131次组卷
|
2卷引用:新疆维吾尔自治区喀什市第十四中学2023-2024学年高二上学期1月期末质量检测化学试题
名校
解题方法
10 . 在室温下,下列五种溶液:① 溶液;②
溶液;②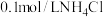 溶液;③
溶液;③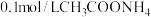 溶液;④
溶液;④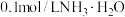 和
和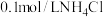 混合液;⑤0.1mol/LNaOH溶液,请根据要求填写下列空白:
混合液;⑤0.1mol/LNaOH溶液,请根据要求填写下列空白:
(1)溶液①呈___________ 性(填“酸”、“碱”或“中”),其原因是___________ (用离子方程式表示)。
(2)溶液②③中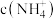 的大小关系是②
的大小关系是②___________ ③。(填“>”、“<”或“=”)
(3)写出溶液④中的电荷守恒___________ 。
(4)现用0.1000mol/L的标准盐酸滴定⑤溶液,选择酚酞做指示剂,达到滴定终点时的液面如图所示,则读数为___________ mL,达到滴定终点的现象为___________ 。
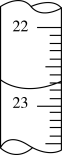
 溶液;②
溶液;②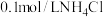 溶液;③
溶液;③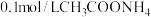 溶液;④
溶液;④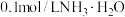 和
和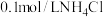 混合液;⑤0.1mol/LNaOH溶液,请根据要求填写下列空白:
混合液;⑤0.1mol/LNaOH溶液,请根据要求填写下列空白:(1)溶液①呈
(2)溶液②③中
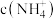 的大小关系是②
的大小关系是②(3)写出溶液④中的电荷守恒
(4)现用0.1000mol/L的标准盐酸滴定⑤溶液,选择酚酞做指示剂,达到滴定终点时的液面如图所示,则读数为

您最近半年使用:0次



