名校
1 . 纯过氧化氢( )是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体,用途广泛。回答下列问题:
)是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体,用途广泛。回答下列问题:
(1)生产双氧水带采用蒽醌法,其反应原理和生产流程如图所示:

写出反应的化学方程式:___________ 。
(2)该兴趣小组的同学查阅资料后发现 为二元弱酸,
为二元弱酸, ,
, 。
。
①写出 在水溶液中的电离方程式:
在水溶液中的电离方程式:___________ 。
②如果常温下 溶液
溶液 ,
, 的酸式酸根离子与
的酸式酸根离子与 的浓度比为
的浓度比为___________ 。
(3)①同学们用装有 的酸性
的酸性 标准溶液的
标准溶液的___________ (填滴定管名称)滴定某试样中过氧化氢的含量。反应的离子方程式为___________ 。
②取 试样置于锥形瓶中,用酸性
试样置于锥形瓶中,用酸性 标准溶液测定,当
标准溶液测定,当___________ (填写滴定达到终点的现象),重复滴定两次,每次消耗的酸性 标准溶液体积如下表所示:
标准溶液体积如下表所示:
则试样中过氧化氢的浓度为___________  。
。
(4)向滴加了酚酞的NaOH溶液中加入 后,溶液中红色消失。关于褪色原因,甲同学认为
后,溶液中红色消失。关于褪色原因,甲同学认为 是二元弱酸,消耗了
是二元弱酸,消耗了 使红色消失;乙同学认为
使红色消失;乙同学认为 具有漂白性使溶液褪色(生成了其他物质)。请设计个简单的实验方案判断甲、乙同学的说法是否正确:
具有漂白性使溶液褪色(生成了其他物质)。请设计个简单的实验方案判断甲、乙同学的说法是否正确:___________ 。
 )是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体,用途广泛。回答下列问题:
)是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体,用途广泛。回答下列问题:(1)生产双氧水带采用蒽醌法,其反应原理和生产流程如图所示:

写出反应的化学方程式:
(2)该兴趣小组的同学查阅资料后发现
 为二元弱酸,
为二元弱酸, ,
, 。
。①写出
 在水溶液中的电离方程式:
在水溶液中的电离方程式:②如果常温下
 溶液
溶液 ,
, 的酸式酸根离子与
的酸式酸根离子与 的浓度比为
的浓度比为(3)①同学们用装有
 的酸性
的酸性 标准溶液的
标准溶液的②取
 试样置于锥形瓶中,用酸性
试样置于锥形瓶中,用酸性 标准溶液测定,当
标准溶液测定,当 标准溶液体积如下表所示:
标准溶液体积如下表所示:| 第一次 | 第二次 | 第三次 | |
| 体积 |  |  |  |
 。
。(4)向滴加了酚酞的NaOH溶液中加入
 后,溶液中红色消失。关于褪色原因,甲同学认为
后,溶液中红色消失。关于褪色原因,甲同学认为 是二元弱酸,消耗了
是二元弱酸,消耗了 使红色消失;乙同学认为
使红色消失;乙同学认为 具有漂白性使溶液褪色(生成了其他物质)。请设计个简单的实验方案判断甲、乙同学的说法是否正确:
具有漂白性使溶液褪色(生成了其他物质)。请设计个简单的实验方案判断甲、乙同学的说法是否正确:
您最近一年使用:0次
解题方法
2 . 热能在生产生活中有重大用途,某化学兴趣小组计划测定化学反应中热量的变化。回答下列问题:
(1)NaOH溶液浓度的测定
①移取20.00mL待测液,加入酚酞做指示剂,用50mL酸式滴定管盛装0.5000 稀盐酸至0刻度处后滴定,当
稀盐酸至0刻度处后滴定,当_______ ,则到达滴定终点。此时酸式滴定管液面位置如图所示 ,则该NaOH溶液浓度为
,则该NaOH溶液浓度为_______ (保留四位有效数字)。
②下列滴定有关操作正确的是_______ (填选项字母)。
(2)热量的测定
取上述稀盐酸52mL和NaOH溶液48mL在保温装置中进行反应,测得反应前后的温度分别为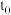 ℃、
℃、 ℃,则该过程放出的热量为
℃,则该过程放出的热量为_______ J(已知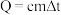 ,所有涉及溶液的密度均视为1
,所有涉及溶液的密度均视为1 ,比热容
,比热容 ,忽略水以外各物质吸收的热量,下同)。
,忽略水以外各物质吸收的热量,下同)。
(3)借鉴(2)的方法,甲同学尝试利用足量0.2000
 溶液和0.65g Zn测定反应
溶液和0.65g Zn测定反应 的焓变,已知反应后溶液质量约为100g,实验结果如表所示:
的焓变,已知反应后溶液质量约为100g,实验结果如表所示:
△H=_______  。
。
(4)乙同学借鉴实验(2)的方法,测定反应 的焓变,实验过程中发现,有气泡产生,请结合化学用语解释产生气泡的原因:
的焓变,实验过程中发现,有气泡产生,请结合化学用语解释产生气泡的原因:_______ ;由于以上现象的产生,会使得乙同学所测数据有误差,请优化该实验方案:_______ 。
(5)请说出一种热能在生活中的应用:_______ 。
(1)NaOH溶液浓度的测定
①移取20.00mL待测液,加入酚酞做指示剂,用50mL酸式滴定管盛装0.5000
 稀盐酸至0刻度处后滴定,当
稀盐酸至0刻度处后滴定,当 ,则该NaOH溶液浓度为
,则该NaOH溶液浓度为②下列滴定有关操作正确的是
 |  |  |
| A.移液时排碱式滴定管内的气泡 | B.应将凡士林涂在旋塞的a端和旋塞套内的c端 | C.滴定过程中观察滴定终点 |
取上述稀盐酸52mL和NaOH溶液48mL在保温装置中进行反应,测得反应前后的温度分别为
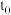 ℃、
℃、 ℃,则该过程放出的热量为
℃,则该过程放出的热量为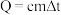 ,所有涉及溶液的密度均视为1
,所有涉及溶液的密度均视为1 ,比热容
,比热容 ,忽略水以外各物质吸收的热量,下同)。
,忽略水以外各物质吸收的热量,下同)。(3)借鉴(2)的方法,甲同学尝试利用足量0.2000

 溶液和0.65g Zn测定反应
溶液和0.65g Zn测定反应 的焓变,已知反应后溶液质量约为100g,实验结果如表所示:
的焓变,已知反应后溶液质量约为100g,实验结果如表所示:| 实验序号 | 反应前温度/℃ | 反应后温度/℃ |
| 1 | 25.0 | 30.2 |
| 2 | 24.9 | 33.1 |
| 3 | 25.5 | 30.7 |
 。
。(4)乙同学借鉴实验(2)的方法,测定反应
 的焓变,实验过程中发现,有气泡产生,请结合化学用语解释产生气泡的原因:
的焓变,实验过程中发现,有气泡产生,请结合化学用语解释产生气泡的原因:(5)请说出一种热能在生活中的应用:
您最近一年使用:0次
2023-08-04更新
|
185次组卷
|
2卷引用:广东省河源市2022-2023学年高三下学期开学考试化学试题
名校
解题方法
3 . Ⅰ.某学生用 溶液测定某未知浓度的盐酸溶液,步骤如下:
溶液测定某未知浓度的盐酸溶液,步骤如下:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
(1)滴定时正确操作的顺序是(用序号字母填写):______
_______→_______→F→_______→_______→_______→D。
(2)滴定时注意观察锥形瓶内溶液颜色的变化,滴定达到终点的现象是_______ 。
(3)滴定结果如表所示:
计算该盐酸的物质的量浓度为_______ (精确至0.0001)。
(4)下列操作会导致测定结果偏高的是_______。
Ⅱ. 是食品加工中最为快捷的食品添加剂,用于焙烤食品;
是食品加工中最为快捷的食品添加剂,用于焙烤食品; 在分析试剂、医药、电子工业中用途广泛。请回答下列问题。
在分析试剂、医药、电子工业中用途广泛。请回答下列问题。
(5)如图1所示是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合 的pH随温度变化的曲线是
的pH随温度变化的曲线是_______ (填字母)。

(6)室温时,向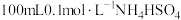 溶液中滴加
溶液中滴加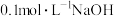 溶液,所得溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是
溶液,所得溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是_______ 。

 溶液测定某未知浓度的盐酸溶液,步骤如下:
溶液测定某未知浓度的盐酸溶液,步骤如下:A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
(1)滴定时正确操作的顺序是(用序号字母填写):
_______→_______→F→_______→_______→_______→D。
(2)滴定时注意观察锥形瓶内溶液颜色的变化,滴定达到终点的现象是
(3)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.60 | 20.60 |
| 3 | 25.00 | 0.20 | 20.19 |
(4)下列操作会导致测定结果偏高的是_______。
| A.碱式滴定管在装液前未用标准NaOH溶液润洗 |
| B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出 |
| C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡 |
| D.达到滴定终点时,仰视读数 |
Ⅱ.
 是食品加工中最为快捷的食品添加剂,用于焙烤食品;
是食品加工中最为快捷的食品添加剂,用于焙烤食品; 在分析试剂、医药、电子工业中用途广泛。请回答下列问题。
在分析试剂、医药、电子工业中用途广泛。请回答下列问题。(5)如图1所示是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合
 的pH随温度变化的曲线是
的pH随温度变化的曲线是
(6)室温时,向
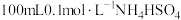 溶液中滴加
溶液中滴加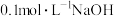 溶液,所得溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是
溶液,所得溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是
您最近一年使用:0次
4 . 氮的单质及其化合物在工业生产中用途广泛,请回答下列问题:
(1)捕碳技术(主要指捕获 CO2)在降低温室气体排放中具有重要的作用。目前 NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与 CO2可发生如下可逆反应:
反应Ⅰ: 2 NH3(l)+ H2O(l) +CO2(g) =(NH4)2CO3(aq) △H1
反应Ⅱ:NH3(l)+ H2O(l) +CO2(g) =NH4HCO3(aq) △H2
反应Ⅲ:(NH4)2CO3(aq) + H2O(l) +CO2(g) =2NH4HCO3(aq) △H3
△H3与△H1、△H2之间的关系是△H3=___________ 。
(2)肼(N2H4)可用于卫星发射的燃料,8gN2H4(l)在 O2(g)中完全燃烧,生成 N2(g)和 H2O(g), 放出 134kJ 热量,则肼的燃烧热△H=___________ 。 (已知 H2O(g) =H2O(l) △H= −44 kJ∙mol−1 )
(3)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是 ___________ 。
②1mol (aq)全部氧化成
(aq)全部氧化成  (aq)的热化学方程式是
(aq)的热化学方程式是___________ 。
(4)叠氮化钠(NaN3)是汽车安全气囊中的主要成分,实验室用滴定法测定叠氮化钠样品中NaN3的质量分数,测定过程的反应方程式为:
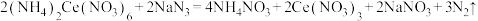 ;
;
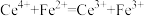 。
。
滴定操作过程如下:
Ⅰ.将 2.500 g 试样配成 500 mL 溶液。
Ⅱ.取 50.00 mL 溶液置于锥形瓶中,加入 50.00 mL 0.1010 mol∙L−1 (NH4)2Ce(NO3)6溶液。
Ⅲ.充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定过量的 Ce4+,消耗溶液体积为 29.00 mL。
①配制叠氮化钠溶液时,除需用到烧杯、量筒、胶头滴管外,还用到的玻璃仪器有___________ 。
②计算试样中 NaN3的质量分数为___________ 。
(1)捕碳技术(主要指捕获 CO2)在降低温室气体排放中具有重要的作用。目前 NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与 CO2可发生如下可逆反应:
反应Ⅰ: 2 NH3(l)+ H2O(l) +CO2(g) =(NH4)2CO3(aq) △H1
反应Ⅱ:NH3(l)+ H2O(l) +CO2(g) =NH4HCO3(aq) △H2
反应Ⅲ:(NH4)2CO3(aq) + H2O(l) +CO2(g) =2NH4HCO3(aq) △H3
△H3与△H1、△H2之间的关系是△H3=
(2)肼(N2H4)可用于卫星发射的燃料,8gN2H4(l)在 O2(g)中完全燃烧,生成 N2(g)和 H2O(g), 放出 134kJ 热量,则肼的燃烧热△H=
(3)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②1mol
 (aq)全部氧化成
(aq)全部氧化成  (aq)的热化学方程式是
(aq)的热化学方程式是(4)叠氮化钠(NaN3)是汽车安全气囊中的主要成分,实验室用滴定法测定叠氮化钠样品中NaN3的质量分数,测定过程的反应方程式为:
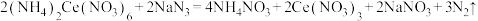 ;
; 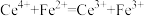 。
。 滴定操作过程如下:
Ⅰ.将 2.500 g 试样配成 500 mL 溶液。
Ⅱ.取 50.00 mL 溶液置于锥形瓶中,加入 50.00 mL 0.1010 mol∙L−1 (NH4)2Ce(NO3)6溶液。
Ⅲ.充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定过量的 Ce4+,消耗溶液体积为 29.00 mL。
①配制叠氮化钠溶液时,除需用到烧杯、量筒、胶头滴管外,还用到的玻璃仪器有
②计算试样中 NaN3的质量分数为
您最近一年使用:0次
解题方法
5 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为________ 。
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________ ;此锡粉样品中锡的质量分数:____________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
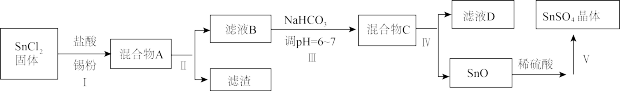
①步骤Ⅰ加入Sn粉的作用:____________________ 及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________ 。
③步骤Ⅲ生成SnO的离子方程式:__________________________ 。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是___________________ ,证明已洗净。
⑤步骤Ⅴ操作依次为___________________ 、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________ 。实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是_______________
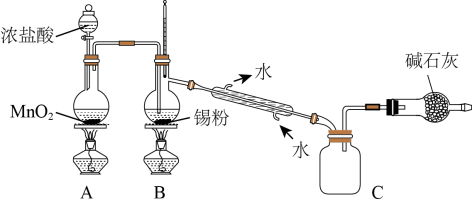
(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是______________________ 。
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
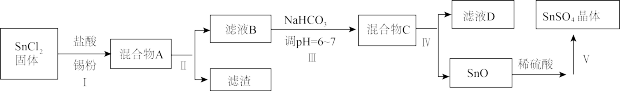
①步骤Ⅰ加入Sn粉的作用:
②步骤Ⅱ用到的玻璃仪器有烧杯、
③步骤Ⅲ生成SnO的离子方程式:
④步骤Ⅳ中检验SnO是否洗涤干净的操作是
⑤步骤Ⅴ操作依次为
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:

(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是
您最近一年使用:0次
2016-12-09更新
|
256次组卷
|
4卷引用:2017届广东省华侨中学高三上学期摸底考试理综化学试卷



