名校
解题方法
1 . 下列方案设计或现象和结论均完全正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 比较CH3COONa与NaClO酸性 | 室温下,用pH试纸分别测定室温下,用pH试纸分别测定 | NaClO溶液pH较大,则酸性:CH3COOH>HClO |
| B | 探究侯氏制碱法 | 向饱和食盐水中先通入二氧化碳至饱和后,再通入过量氨气 | 溶液变浑浊,析出NaHCO3 |
| C | 比较AgCl、AgI的Ksp大小 | 向5mL0.1mol/LAgNO3溶液中先加入4滴0.1mol/LNaCl溶液,再加入4滴0.1mol/LKI溶液 | 若先产生白色沉淀,后变为黄色沉淀,则AgI的Ksp较小 |
| D | 探究Na2SO3是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入BaCl2溶液 | 若有白色沉淀产生,则样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 下列实验操作能达到实验目的的是
| 操作 | 目的 | |
| A | 常温下,用 试纸测 试纸测 溶液 溶液  溶液 溶液 | 判断 和 和 酸性强弱 酸性强弱 |
 | 向含有酚酞的 溶液中滴入 溶液中滴入 溶液,观察溶液颜色的变化 溶液,观察溶液颜色的变化 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
 | 相同温度下,测得饱和 溶液的 溶液的 小于饱和 小于饱和 溶液的 溶液的 | 证明 酸性强于 酸性强于 |
 | 将 样品溶于稀 样品溶于稀 后,滴加 后,滴加 溶液,观察溶液是否变红 溶液,观察溶液是否变红 | 检验 样品是否变质 样品是否变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 下列方案设计、现象和结论有不正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 相同温度下,等质量的大理石与等体积等浓度的盐酸反应 | 粉状大理石产生气泡更快 | 反应速率:粉状大理石>块状大理石 |
| B | Na2SO3固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 | 若有白色沉淀产生,则样品已经变质 |
| C | 比较CH3COOH和HClO的Ka大小 | 用pH试纸分别0.1mol•L-1CH3COONa溶液和NaClO溶液的pH | 若pH(NaClO)>pH(CH3COONa)则说明Ka(CH3COOH)>Ka(HClO) |
| D | 检验蛋白质性质 | 向鸡蛋清溶液中滴加醋酸铅溶液 | 溶液变浑浊,再加水浑浊不消失说明鸡蛋清溶液发生了变性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 氮化锶(Sr3N2)是工业上生产荧光粉的原材料。已知:氮化锶遇水剧烈反应产生氨气。某同学设计如下装置制备氮化锶(Sr3N2相对分子质量:290.8)。
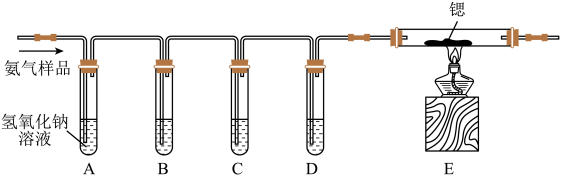
已知:①所使用的氮气样品可能含有少量 CO、CO2、O2等气体杂质;
②醋酸二氨合亚铜 CH3COO[Cu(NH3)2]溶液能定量吸收 CO,但易被O2化,失去吸收CO 能力,连苯三酚碱性溶液能定量吸收O2。
(1)装置 B盛装的试剂是___________ 。
(2)氮化锶遇水剧烈反应的化学方程式为___________ 。
(3)装置设计存在缺陷,可能会导致产品变质,提出改进措施为:___________ 。
(4)产品纯度的测定:称取 0.4000 g 所得产品,加入干燥的三颈瓶中,加入蒸馏水,并通入足量水蒸气,将产生的氨全部蒸出,用 50.00 mL 0.100 mol·L-1的盐酸标准溶液完全吸收,再用0.100 mol·L-1 NaOH 标准溶液滴定过剩的 HCl,到终点时消耗 30.00 mL NaOH 溶液。
①若用酚酞作指示剂,滴定终点的现象是___________ ;
②则产品纯度为___________ (计算结果保留 3 位有效数字);
③若氨没有完全蒸出,则会导致产品纯度___________ (填“偏大”“偏小”或“不影响”)

已知:①所使用的氮气样品可能含有少量 CO、CO2、O2等气体杂质;
②醋酸二氨合亚铜 CH3COO[Cu(NH3)2]溶液能定量吸收 CO,但易被O2化,失去吸收CO 能力,连苯三酚碱性溶液能定量吸收O2。
(1)装置 B盛装的试剂是
(2)氮化锶遇水剧烈反应的化学方程式为
(3)装置设计存在缺陷,可能会导致产品变质,提出改进措施为:
(4)产品纯度的测定:称取 0.4000 g 所得产品,加入干燥的三颈瓶中,加入蒸馏水,并通入足量水蒸气,将产生的氨全部蒸出,用 50.00 mL 0.100 mol·L-1的盐酸标准溶液完全吸收,再用0.100 mol·L-1 NaOH 标准溶液滴定过剩的 HCl,到终点时消耗 30.00 mL NaOH 溶液。
①若用酚酞作指示剂,滴定终点的现象是
②则产品纯度为
③若氨没有完全蒸出,则会导致产品纯度
您最近一年使用:0次
名校
解题方法
5 . 下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
| A | 证明 沉淀可以转化为 沉淀可以转化为 | 向 溶液中先加入2滴 溶液中先加入2滴 溶液,再加入2滴 溶液,再加入2滴 溶液 溶液 |
| B | 证明 溶液中存在水解平衡 溶液中存在水解平衡 | 向滴有酚酞的 溶液中加入少量 溶液中加入少量 固体,溶液红色稍微变浅 固体,溶液红色稍微变浅 |
| C | 检验 晶体是否已氧化变质 晶体是否已氧化变质 | 将 样品溶于稀盐酸后,滴加 样品溶于稀盐酸后,滴加 溶液,观察溶液是否变红 溶液,观察溶液是否变红 |
| D | 比较 和 和 的酸性强弱 的酸性强弱 | 常温下,用pH试纸分别测定浓度均为 的 的 溶液和 溶液和 溶液的pH 溶液的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
6 . 室温下进行下列实验,根据实验操作和现象不能得到相应结论的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向KI的淀粉溶液中滴加 溶液,振荡后,溶液变蓝色 溶液,振荡后,溶液变蓝色 | KI与 发生了氧化还原反应 发生了氧化还原反应 |
| B | 取少量 固体样品溶于蒸馏水,加入足量稀盐酸,再加入足量 固体样品溶于蒸馏水,加入足量稀盐酸,再加入足量 溶液,有白色沉淀产生 溶液,有白色沉淀产生 |  固体样品已经变质 固体样品已经变质 |
| C | 将石蜡油高温分解后得到的气体通入酸性高锰酸钾溶液中,紫红色褪去 | 分解产物中含有不饱和烃 |
| D | 用pH试纸测得: 溶液的pH约为9,NaF溶液的pH约为10 溶液的pH约为9,NaF溶液的pH约为10 | 酸性: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
7 . FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室常保存摩尔盐(NH4)2Fe(SO4)2·6H2O,它比绿矾或绿矾溶液更稳定。回答下列问题。
(1)摩尔盐的制备。
①配制溶液以及后续使用的蒸馏水都必须煮沸、冷却后使用;通常向配制的FeSO4溶液中加入少量铁屑并滴加硫酸,目的是______ ;向FeSO4溶液中加入饱和的(NH4)2SO4溶液,经过蒸发、冷却结晶、过滤、洗涤和干燥得到摩尔盐晶体。
②NH 离子物质的量浓度相同的(NH4)2Fe(SO4)2和(NH4)2SO4溶液相比较,物质的量浓度大小关系为:前者
离子物质的量浓度相同的(NH4)2Fe(SO4)2和(NH4)2SO4溶液相比较,物质的量浓度大小关系为:前者______ 后者(填“大于”“等于”或“小于”)。
(2)测定摩尔盐的纯度。酸性KMnO4作氧化还原滴定的氧化剂时被还原为Mn2+。
①滴定时将KMnO4溶液加入______ (填“酸式”或“碱式”)滴定管,在规格为25mL的滴定管中,若KMnO4溶液的起始读数为5.00mL,此时滴定管中KMnO4溶液的实际体积为______ (填标号)。
A.5mL B.20.00mL C.大于20.00mL D.小于5.00mL
②准确称量20.00g摩尔盐晶体[摩尔质量为392g•mol-1]样品,配成溶液100mL,分别取3份20.00mL所配溶液于锥形瓶中,加稀硫酸酸化,分别用0.1000mol•L-1KMnO4溶液滴定,到达终点所用体积分别为20.01mL、19.99mL、19.85mL,则滴定20.00mL所配溶液消耗0.1000mol•L-1KMnO4溶液的体积为______ mL,产品摩尔盐(NH4)2Fe(SO4)2·6H2O的质量分数为______ 。
(1)摩尔盐的制备。
①配制溶液以及后续使用的蒸馏水都必须煮沸、冷却后使用;通常向配制的FeSO4溶液中加入少量铁屑并滴加硫酸,目的是
②NH
 离子物质的量浓度相同的(NH4)2Fe(SO4)2和(NH4)2SO4溶液相比较,物质的量浓度大小关系为:前者
离子物质的量浓度相同的(NH4)2Fe(SO4)2和(NH4)2SO4溶液相比较,物质的量浓度大小关系为:前者(2)测定摩尔盐的纯度。酸性KMnO4作氧化还原滴定的氧化剂时被还原为Mn2+。
①滴定时将KMnO4溶液加入
A.5mL B.20.00mL C.大于20.00mL D.小于5.00mL
②准确称量20.00g摩尔盐晶体[摩尔质量为392g•mol-1]样品,配成溶液100mL,分别取3份20.00mL所配溶液于锥形瓶中,加稀硫酸酸化,分别用0.1000mol•L-1KMnO4溶液滴定,到达终点所用体积分别为20.01mL、19.99mL、19.85mL,则滴定20.00mL所配溶液消耗0.1000mol•L-1KMnO4溶液的体积为
您最近一年使用:0次
名校
8 . 现有某KOH样品因部分变质含K2CO3。某化学课外小组的同学用滴定法测定该样品中KOH的质量分数。
【实验步骤】
Ⅰ.迅速地称取样品1.000g,溶解后准确配制成250mL溶液,备用;
Ⅱ.将0.1000mol/L标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取25.00mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为KCl和KHCO3),记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数V2。重复上述操作两次,记录数据如表:
(1)步骤Ⅰ中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和____ 。
(2)下列有关步骤Ⅰ中样品溶液的说法正确的是____ (填字母序号)。
a.样品溶液中水的电离程度比相同pH的KOH溶液中的小
b.向该溶液中滴加盐酸至第一终点时,n(Cl-)+n(CO )+n(HCO
)+n(HCO )+n(H2CO3)=n(K+)
)+n(H2CO3)=n(K+)
c.c(H+)+c(K+)=2c(CO )+c(HCO
)+c(HCO )+c(OH-)
)+c(OH-)
d.c(K+)>c(CO )>c(HCO
)>c(HCO )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
(3)滴定至第一终点的过程中,发生的离子方程式是____ 。判断滴定至第一终点的现象是:当最后半滴HCl标准溶液滴下后,____ 。
(4)样品中KOH的质量分数ω(KOH)=____ %。
(5)下列操作会导致测得的KOH质量分数偏高的是_____ (填字母序号)。
a.溶液由浅红色变为无色后继续滴加HCl至产生气泡,然后记录第一终点的读数
b.记录酸式滴定管读数V1时,仰视标准液液面
c.第一终点后继续滴定时,锥形瓶中有少许液体溅出
d.记录酸式滴定管读数V2时,仰视标准液液面
【实验步骤】
Ⅰ.迅速地称取样品1.000g,溶解后准确配制成250mL溶液,备用;
Ⅱ.将0.1000mol/L标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取25.00mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为KCl和KHCO3),记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数V2。重复上述操作两次,记录数据如表:
| 实验序号 | 1 | 2 | 3 |
| V0/mL | 0.00 | 0.00 | 0.00 |
| V1/mL | 16.73 | 16.77 | 16.75 |
| V2/mL | 17.48 | 17.52 | 17.50 |
(2)下列有关步骤Ⅰ中样品溶液的说法正确的是
a.样品溶液中水的电离程度比相同pH的KOH溶液中的小
b.向该溶液中滴加盐酸至第一终点时,n(Cl-)+n(CO
 )+n(HCO
)+n(HCO )+n(H2CO3)=n(K+)
)+n(H2CO3)=n(K+)c.c(H+)+c(K+)=2c(CO
 )+c(HCO
)+c(HCO )+c(OH-)
)+c(OH-)d.c(K+)>c(CO
 )>c(HCO
)>c(HCO )>c(OH-)>c(H+)
)>c(OH-)>c(H+)(3)滴定至第一终点的过程中,发生的离子方程式是
(4)样品中KOH的质量分数ω(KOH)=
(5)下列操作会导致测得的KOH质量分数偏高的是
a.溶液由浅红色变为无色后继续滴加HCl至产生气泡,然后记录第一终点的读数
b.记录酸式滴定管读数V1时,仰视标准液液面
c.第一终点后继续滴定时,锥形瓶中有少许液体溅出
d.记录酸式滴定管读数V2时,仰视标准液液面
您最近一年使用:0次
名校
9 . 根据下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 相同条件下,分别测量0.1mol·L-1和0.01mol·L-1醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
| B | 把充有NO2和N2O4的平衡球装置分别放入热水和冷水中( △H<0),热水中颜色更深 △H<0),热水中颜色更深 | 其他条件不变时,温度升高,平衡向吸热反应方向移动 |
| C | 取少量Na2SO3样品溶于蒸馏水,加入稀硝酸酸化的BaCl2溶液,产生白色沉淀 | Na2SO3样品已变质 |
| D | 向一干燥集气瓶通入纯净的氨气和氯化氢气体,有白烟产生 | 氨气具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 新冠肺炎疫情期间,含氯消毒剂在环境杀菌消毒方面发挥了重要的作用。其中二氯异氰尿酸钠(简称DCCNa)是一种高效、安全的消毒剂,常温下性质稳定,受热易分解,难溶于冰水。实验室通过以下原理和装置(夹持仪器已略去)可以制取DCCNa。

 +2NaClO(浓)→
+2NaClO(浓)→ +NaOH+H2O
+NaOH+H2O
实验步骤如下:
I.制备高浓度NaClO溶液。
从进料口加入10mL30%NaOH溶液,在10℃左右水浴,搅拌条件下通入Cl2至溶液pH约为8;再加入10mL40%NaOH溶液,继续通入Cl2至溶液pH约为8。
(1)用烧碱固体配制40%的NaOH溶液,下列仪器中不需要的是____ (写名称)。

(2)已知:[Ka(HClO)=5.0×10-8,lg2≈0.3],常温下0.2mol·L-1NaClO溶液的pH范围是____ (填标号)。
A.7.0~8.0 B.10.0~11.0 C.13.0~14.0
(3)水浴降温可以减少NaClO3副产物的生成,该副反应的离子方程式为____ 。
(4)通过改进实验装置,可以提高B中NaOH的利用率,可行的方法是____ (写一种)。
II.制备二氯异氰尿酸钠。
步骤I结束后,从进料口加入异氰尿酸,在搅拌状态下继续通入Cl2,在10℃左右下反应30min,此时三颈瓶内有DCCNa白色晶体析出,停止反应。
(5)继续通入Cl2的目的是____ 。
III.二氯异氰尿酸钠有效氯含量测定。
称取0.1000g样品,用100mL蒸馏水于碘量瓶中溶解后,依次加入20mL0.3mol·L-1醋酸溶液和过量的KI溶液。用0.1000mol·L-1Na2S2O3溶液滴定至溶液呈浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液16.00mL。
(已知: +CH3COOH+2H2O→
+CH3COOH+2H2O→ +2HClO+CH3COONa,I2+2Na2S2O3=Na2S4O6+2NaI)
+2HClO+CH3COONa,I2+2Na2S2O3=Na2S4O6+2NaI)
(6)滴定终点的现象为____ 。若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果____ (填“偏高”“偏低”或“无影响”)。
(7)样品有效氯=____ (样品有效氯=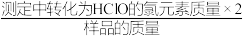 ×100%)。
×100%)。

 +2NaClO(浓)→
+2NaClO(浓)→ +NaOH+H2O
+NaOH+H2O实验步骤如下:
I.制备高浓度NaClO溶液。
从进料口加入10mL30%NaOH溶液,在10℃左右水浴,搅拌条件下通入Cl2至溶液pH约为8;再加入10mL40%NaOH溶液,继续通入Cl2至溶液pH约为8。
(1)用烧碱固体配制40%的NaOH溶液,下列仪器中不需要的是

(2)已知:[Ka(HClO)=5.0×10-8,lg2≈0.3],常温下0.2mol·L-1NaClO溶液的pH范围是
A.7.0~8.0 B.10.0~11.0 C.13.0~14.0
(3)水浴降温可以减少NaClO3副产物的生成,该副反应的离子方程式为
(4)通过改进实验装置,可以提高B中NaOH的利用率,可行的方法是
II.制备二氯异氰尿酸钠。
步骤I结束后,从进料口加入异氰尿酸,在搅拌状态下继续通入Cl2,在10℃左右下反应30min,此时三颈瓶内有DCCNa白色晶体析出,停止反应。
(5)继续通入Cl2的目的是
III.二氯异氰尿酸钠有效氯含量测定。
称取0.1000g样品,用100mL蒸馏水于碘量瓶中溶解后,依次加入20mL0.3mol·L-1醋酸溶液和过量的KI溶液。用0.1000mol·L-1Na2S2O3溶液滴定至溶液呈浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液16.00mL。
(已知:
 +CH3COOH+2H2O→
+CH3COOH+2H2O→ +2HClO+CH3COONa,I2+2Na2S2O3=Na2S4O6+2NaI)
+2HClO+CH3COONa,I2+2Na2S2O3=Na2S4O6+2NaI)(6)滴定终点的现象为
(7)样品有效氯=
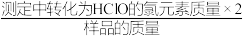 ×100%)。
×100%)。
您最近一年使用:0次
2022-05-11更新
|
319次组卷
|
2卷引用:湖南省株洲南方中学2022-2023学年高二上学期期中考试化学试题



