名校
1 . 氯碱工业的产物可用于制取“84”消毒液的主要成份次氯酸钠。
I.常温下,将 缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入
缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入 的氢氧化钠溶液,整个过程中
的氢氧化钠溶液,整个过程中 变化如图所示,回答下列问题:
变化如图所示,回答下列问题:
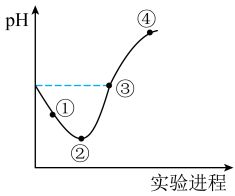
(1)在新制氯水中,下列关系正确的是___________(选填编号)。
(2)③点所示溶液中:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”,下同);
”,下同);
(3)比较水的电离程度:曲线③点处___________ 曲线②点处。
II.探究发现 溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
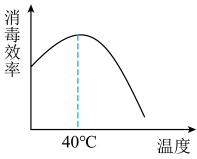
(4)试从水解平衡角度和物质变化的相关知识解释40℃前后变化趋势不同的可能原因_______ 。
III.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中 的含量。
的含量。
其实验步骤为:称取工业烧碱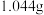 ,配成
,配成 溶液,取出
溶液,取出 ,先加入
,先加入 溶液(过量),然后滴入酚酞指示剂,再用
溶液(过量),然后滴入酚酞指示剂,再用 的盐酸滴定至终点,平均消耗盐酸
的盐酸滴定至终点,平均消耗盐酸 。(已知:
。(已知: 溶解时的
溶解时的 )
)
(5)上述实验步骤中需要用到的全部定量仪器有:___________ 。
(6)计算该样品中 的质量分数为
的质量分数为___________ 。(用小数表示,保留至小数点后第3位)
(7)某次检测发现,实验值明显高于理论值,原因可能是___________。(选填编号)
I.常温下,将
 缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入
缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入 的氢氧化钠溶液,整个过程中
的氢氧化钠溶液,整个过程中 变化如图所示,回答下列问题:
变化如图所示,回答下列问题:
(1)在新制氯水中,下列关系正确的是___________(选填编号)。
A.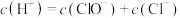 | B. |
C.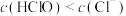 | D.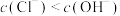 |
(2)③点所示溶液中:

 (填“
(填“ ”“
”“ ”或“
”或“ ”,下同);
”,下同);(3)比较水的电离程度:曲线③点处
II.探究发现
 溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
(4)试从水解平衡角度和物质变化的相关知识解释40℃前后变化趋势不同的可能原因
III.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中
 的含量。
的含量。其实验步骤为:称取工业烧碱
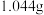 ,配成
,配成 溶液,取出
溶液,取出 ,先加入
,先加入 溶液(过量),然后滴入酚酞指示剂,再用
溶液(过量),然后滴入酚酞指示剂,再用 的盐酸滴定至终点,平均消耗盐酸
的盐酸滴定至终点,平均消耗盐酸 。(已知:
。(已知: 溶解时的
溶解时的 )
)(5)上述实验步骤中需要用到的全部定量仪器有:
(6)计算该样品中
 的质量分数为
的质量分数为(7)某次检测发现,实验值明显高于理论值,原因可能是___________。(选填编号)
| A.工业烧碱已发生潮解 | B.滴定时往锥形瓶中加水 |
| C.配制的待测液敞口放置时间过长 | D.滴定管水洗后未用标准盐酸润洗 |
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.汉弗里·戴维是英国著名化学家,他提出:“电流与化合物的相互作用,是最有可能将所有物质分解为元素的方法”。通过这种方法,他制备得到了金属钾和钠。
(1)戴维在1807年用电解熔融烧碱的方法制得金属钠,电极之间设置镍网做隔膜以分离电解产物,电解的总反应方程式为:___________ 。
(2)关于金属钠,下列叙述正确的是___________
(3)钠在空气中燃烧产物的颜色是___________ , 电子式为___________ 。
(4)ag钠完全燃烧后,将固体充分溶解在bg水中,所得溶液溶质的质量分数是___________ 。
(5)某实验小组把 CO2通入饱和Na2CO3溶液制取NaHCO3,装置如下图所示(气密性已检验,部分夹持装置略):
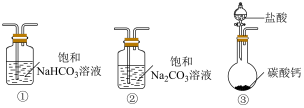
选取必要的实验装置,正确的连接顺序为___________ (填序号)。
Ⅱ.为确定制得的固体样品是纯净的 NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与BaCl2溶液反应,观察现象
乙方案:测定 pH法
(6)为判定甲方案的可行性, 某同学用NaHCO3分析纯配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
此实验说明甲方案___________ (填“可行”或“不可行”)。
(7)产生浑浊(伴有气体产生)的离子方程式:___________ 。
(8)乙方案是:取等质量的固体样品和分析纯 Na2CO3加等质量的水配制的溶液,分别与 pH 计测定 pH,pH更大的是___________ (填化学式)。
(1)戴维在1807年用电解熔融烧碱的方法制得金属钠,电极之间设置镍网做隔膜以分离电解产物,电解的总反应方程式为:
(2)关于金属钠,下列叙述正确的是___________
| A.钠可保存在煤油或CCl4等液态有机物中 |
| B.氯化钠在电流作用下电离出的钠离子和氯离子 |
| C.钠与硫在常温下化合就能剧烈反应,甚至发生爆炸 |
| D.若金属钠着火,可采用干粉灭火器灭火 |
(3)钠在空气中燃烧产物的颜色是
(4)ag钠完全燃烧后,将固体充分溶解在bg水中,所得溶液溶质的质量分数是
(5)某实验小组把 CO2通入饱和Na2CO3溶液制取NaHCO3,装置如下图所示(气密性已检验,部分夹持装置略):

选取必要的实验装置,正确的连接顺序为
Ⅱ.为确定制得的固体样品是纯净的 NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与BaCl2溶液反应,观察现象
乙方案:测定 pH法
(6)为判定甲方案的可行性, 某同学用NaHCO3分析纯配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 BaCl2溶液 | 0.2mol/L | 0.1mol/L | 0.02mol/L |
| 0.2mol/L | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol/L | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol/L | 少许浑浊 | 无现象 | 无现象 |
(7)产生浑浊(伴有气体产生)的离子方程式:
(8)乙方案是:取等质量的固体样品和分析纯 Na2CO3加等质量的水配制的溶液,分别与 pH 计测定 pH,pH更大的是
您最近一年使用:0次
解题方法
3 . I.氯化铁可用于金属蚀刻,污水处理。
(1)把FeCl3溶液蒸干灼烧得到的主要产物是_______ 。
(2)为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
下列说法正确的是_______ (填序号)。
A.上述实验能判断出温度对氯化铁水解的影响
B.表格中x>y>z
C.上述实验能得出:增大盐的浓度,水解平衡正向移动,水解程度越大。
II.滴定实验是化学学科中最重要的定量实验之一、葡萄酒中抗氧化剂残留量的测定,常采用氧化还原滴定法。葡萄酒常用Na2S2O5作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

往实验中加入盐酸的目的是将Na2S2O5转化成SO2;滴定过程中发生的反应是:I2+SO2+2H2O=2HI+H2SO4
(3)滴定时,I2溶液应装在_______ (“酸”或“碱”)式滴定管中,以淀粉作指示剂,则滴定终点的现象为_______ 。
(4)实验消耗标准I2溶液50.00mL,所测样品中抗氧化剂的残留量(以游离SO2计算)为_______ g·L-1。
(5)下列情形会造成测定结果偏高的是_______(填序号)。
(1)把FeCl3溶液蒸干灼烧得到的主要产物是
(2)为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
| 实验 | c(FeCl3)/mol·L−1 | V(FeCl3)/mL | 温度/℃ | pH |
| 1 | 0.1 | 5 | 25 | x |
| 2 | 0.1 | 5 | 35 | y |
| 3 | 0.2 | 5 | 25 | z |
A.上述实验能判断出温度对氯化铁水解的影响
B.表格中x>y>z
C.上述实验能得出:增大盐的浓度,水解平衡正向移动,水解程度越大。
II.滴定实验是化学学科中最重要的定量实验之一、葡萄酒中抗氧化剂残留量的测定,常采用氧化还原滴定法。葡萄酒常用Na2S2O5作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

往实验中加入盐酸的目的是将Na2S2O5转化成SO2;滴定过程中发生的反应是:I2+SO2+2H2O=2HI+H2SO4
(3)滴定时,I2溶液应装在
(4)实验消耗标准I2溶液50.00mL,所测样品中抗氧化剂的残留量(以游离SO2计算)为
(5)下列情形会造成测定结果偏高的是_______(填序号)。
| A.滴定持续时间稍长,溶液中部分HI被空气氧化 |
| B.盛装标准I2溶液的滴定管用蒸馏水洗净后,未润洗 |
| C.滴定前平视,滴定后俯视 |
| D.滴定前滴定管尖嘴有气泡滴定后气泡消失 |
您最近一年使用:0次
名校
4 . Ⅰ.回答下列问题:
(1) 溶液可以用来除铁锈的原因:
溶液可以用来除铁锈的原因:___________ (用离子方程式说明)。
(2)部分弱酸的电离平衡常数如表:
室温下① ,②
,② ,③
,③ ,④
,④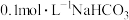 溶液的pH由大到小的关系为
溶液的pH由大到小的关系为___________ 。
(3)重金属离子对河流、海洋造成严重污染。某化工厂废水 中含有
中含有 、
、 等重金属离子其浓度各约为0.01mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下(常温):
等重金属离子其浓度各约为0.01mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下(常温):
①向废水中投入___________ (填字母序号),沉淀效果最好。
A. B.
B. C.
C. D.
D.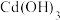
②如果用生石灰处理上述废水,使处理后的废水中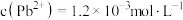 ,则溶液的
,则溶液的
___________ 。
(4)反应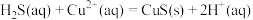 的平衡常数为
的平衡常数为____ 。[已知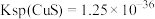 ,
, 的
的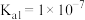 ,
,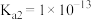 ]
]
II.常温下, 的电离平衡常数
的电离平衡常数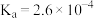 。亚硝酸钠
。亚硝酸钠 是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
(5)亚硝酸钠有毒,不能随意丢弃,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则反应的化学方程式为____ 。
(6)某活动小组同学设计实验方案鉴别 溶液和
溶液和 溶液,请填写下列表格。
溶液,请填写下列表格。
III.活动小组同学采用如下装置制备 (装置可重复使用,部分夹持仪器已省略)。
(装置可重复使用,部分夹持仪器已省略)。

已知:① ;
;
②酸性条件下, 、
、 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。
(7)实验装置的连接顺序为_____ A→___________→___________→___________→___________→B;
(8)C瓶内发生反应的离子方程式为___________ 。
(9)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用 的酸性
的酸性 溶液进行滴定,实验所得数据如下表。
溶液进行滴定,实验所得数据如下表。
①第一组实验数据出现较明显异常,造成异常的原因可能是___________ (填字母序号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.滴定前滴定管尖嘴中有气泡,滴定后滴定管尖嘴无气泡
c.判断终点时,滴入一滴酸性 溶液,锥形瓶内溶液呈浅红色,振荡后立即褪色
溶液,锥形瓶内溶液呈浅红色,振荡后立即褪色
d.观察滴定终点时俯视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为___________ 。
(1)
 溶液可以用来除铁锈的原因:
溶液可以用来除铁锈的原因:(2)部分弱酸的电离平衡常数如表:
| 弱酸 |  |  |  |  |
| 电离平衡常数(25℃) | 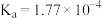 | 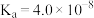 | 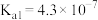 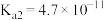 | 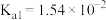 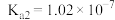 |
 ,②
,② ,③
,③ ,④
,④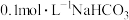 溶液的pH由大到小的关系为
溶液的pH由大到小的关系为(3)重金属离子对河流、海洋造成严重污染。某化工厂废水
 中含有
中含有 、
、 等重金属离子其浓度各约为0.01mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下(常温):
等重金属离子其浓度各约为0.01mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下(常温):| 难溶电解质 |  |  |  |  | 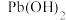 |  |
 | 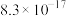 |  | 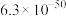 | 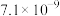 | 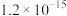 | 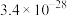 |
A.
 B.
B. C.
C. D.
D.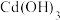
②如果用生石灰处理上述废水,使处理后的废水中
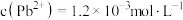 ,则溶液的
,则溶液的
(4)反应
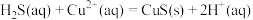 的平衡常数为
的平衡常数为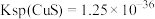 ,
, 的
的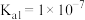 ,
,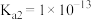 ]
]II.常温下,
 的电离平衡常数
的电离平衡常数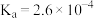 。亚硝酸钠
。亚硝酸钠 是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。(5)亚硝酸钠有毒,不能随意丢弃,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则反应的化学方程式为
(6)某活动小组同学设计实验方案鉴别
 溶液和
溶液和 溶液,请填写下列表格。
溶液,请填写下列表格。| 选用药品 | 实验现象( 溶液) 溶液) | 利用 的性质 的性质 |
| ①酚酞试液 | ||
②淀粉 试纸 试纸 |
III.活动小组同学采用如下装置制备
 (装置可重复使用,部分夹持仪器已省略)。
(装置可重复使用,部分夹持仪器已省略)。
已知:①
 ;
;②酸性条件下,
 、
、 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。(7)实验装置的连接顺序为
(8)C瓶内发生反应的离子方程式为
(9)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用
 的酸性
的酸性 溶液进行滴定,实验所得数据如下表。
溶液进行滴定,实验所得数据如下表。| 滴定次数 | 1 | 2 | 3 | 4 |
 溶液体积/mL 溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.滴定前滴定管尖嘴中有气泡,滴定后滴定管尖嘴无气泡
c.判断终点时,滴入一滴酸性
 溶液,锥形瓶内溶液呈浅红色,振荡后立即褪色
溶液,锥形瓶内溶液呈浅红色,振荡后立即褪色d.观察滴定终点时俯视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为
您最近一年使用:0次



