1 . 自然界中含 、
、 较多的水称为硬水,容易形成水垢。柠檬酸(用
较多的水称为硬水,容易形成水垢。柠檬酸(用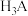 表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中
表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中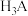 、
、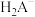 、
、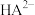 、
、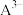 的百分含量随pH的变化曲线如图所示。回答下列问题:
的百分含量随pH的变化曲线如图所示。回答下列问题:__________ (写出其中一个离子方程式即可);加热能降低这种硬水中的 、
、 含量,其中
含量,其中 发生反应的化学方程式为
发生反应的化学方程式为_________ 。
(2)表示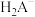 变化曲线的是
变化曲线的是_______ (填字母标号); 为
为_______ 。
(3)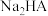 溶液显
溶液显____ (填“酸性”、“中性”或“碱性”),溶液中的电荷守恒关系式为________ 。
(4)向硬水中加入NaF固体可除去溶液中的 、
、 。若
。若 ,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为
,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为________  。[已知
。[已知 ,
,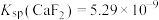 ]
]
 、
、 较多的水称为硬水,容易形成水垢。柠檬酸(用
较多的水称为硬水,容易形成水垢。柠檬酸(用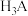 表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中
表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中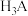 、
、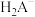 、
、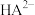 、
、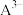 的百分含量随pH的变化曲线如图所示。回答下列问题:
的百分含量随pH的变化曲线如图所示。回答下列问题:
 、
、 含量,其中
含量,其中 发生反应的化学方程式为
发生反应的化学方程式为(2)表示
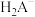 变化曲线的是
变化曲线的是 为
为(3)
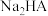 溶液显
溶液显(4)向硬水中加入NaF固体可除去溶液中的
 、
、 。若
。若 ,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为
,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为 。[已知
。[已知 ,
,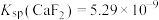 ]
]
您最近一年使用:0次
2 . 完成下列问题。
(1) 水溶液呈酸性的原因是(用离子方程式表示):
水溶液呈酸性的原因是(用离子方程式表示):________ 。
(2)室温时, 的
的 溶液中由水电离出的
溶液中由水电离出的
______  。
。
(3)室温时, 的Ba(OH)2溶液,
的Ba(OH)2溶液,
________ 。
(4)室温下pH=3的 水溶液水电离的c(H+)
水溶液水电离的c(H+)______  。
。
(5)常温下pH=13的 溶液与pH=11
溶液与pH=11 溶液等体积混合,混合溶液pH=
溶液等体积混合,混合溶液pH=______ 。
(6)常温下0.1 的NH3·H2O,pH=11,则Kb=
的NH3·H2O,pH=11,则Kb=_______ ,常温下0.1 的CH3COOH溶液pH=3 ,则Ka=
的CH3COOH溶液pH=3 ,则Ka=_______ 。
(1)
 水溶液呈酸性的原因是(用离子方程式表示):
水溶液呈酸性的原因是(用离子方程式表示):(2)室温时,
 的
的 溶液中由水电离出的
溶液中由水电离出的
 。
。(3)室温时,
 的Ba(OH)2溶液,
的Ba(OH)2溶液,
(4)室温下pH=3的
 水溶液水电离的c(H+)
水溶液水电离的c(H+) 。
。(5)常温下pH=13的
 溶液与pH=11
溶液与pH=11 溶液等体积混合,混合溶液pH=
溶液等体积混合,混合溶液pH=(6)常温下0.1
 的NH3·H2O,pH=11,则Kb=
的NH3·H2O,pH=11,则Kb= 的CH3COOH溶液pH=3 ,则Ka=
的CH3COOH溶液pH=3 ,则Ka=
您最近一年使用:0次
3 . 部分弱电解质的电离常数如表所示。
下列说法错误的是
| 弱电解质 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.8×10-4 | Ka=6.2×10-10 |  =4.5×10-7 =4.5×10-7 =4.7×10-11 =4.7×10-11 |
A.结合H+的能力: >CN-> >CN-> >HCOO- >HCOO- |
B.反应2CN-+H2O+CO2=2HCN+C 能发生 能发生 |
| C.中和等体积、等c(H+)的HCOOH和HCN,消耗NaOH的量前者小于后者 |
D.25℃时,反应HCOOH+CN- HCN+HCOO-的化学平衡常数约为2.9×105 HCN+HCOO-的化学平衡常数约为2.9×105 |
您最近一年使用:0次
解题方法
4 . 25℃时,向 溶液中逐滴加入稀盐酸,溶液中含碳微粒(
溶液中逐滴加入稀盐酸,溶液中含碳微粒( 、
、 、
、 )的物质的量分数(
)的物质的量分数( )随溶液pOH[
)随溶液pOH[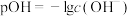 ]变化的部分情况如图所示。下列说法中正确的是
]变化的部分情况如图所示。下列说法中正确的是
 溶液中逐滴加入稀盐酸,溶液中含碳微粒(
溶液中逐滴加入稀盐酸,溶液中含碳微粒( 、
、 、
、 )的物质的量分数(
)的物质的量分数( )随溶液pOH[
)随溶液pOH[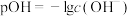 ]变化的部分情况如图所示。下列说法中正确的是
]变化的部分情况如图所示。下列说法中正确的是
A.曲线b代表 , , |
B.pOH=4时,溶液中 |
C.pOH=7时,溶液中 |
D.该温度下, 的水解平衡常数 的水解平衡常数 |
您最近一年使用:0次
解题方法
5 . 室温下, 、
、 、
、 。对于以下3种溶液:①0.10
。对于以下3种溶液:①0.10
 溶液;②向0.10
溶液;②向0.10
 溶液中通入少量
溶液中通入少量 所得的溶液;③向20mL 0.10
所得的溶液;③向20mL 0.10
 溶液中逐滴加入10mL等浓度NaOH溶液所得的溶液。下列说法正确的是
溶液中逐滴加入10mL等浓度NaOH溶液所得的溶液。下列说法正确的是
 、
、 、
、 。对于以下3种溶液:①0.10
。对于以下3种溶液:①0.10
 溶液;②向0.10
溶液;②向0.10
 溶液中通入少量
溶液中通入少量 所得的溶液;③向20mL 0.10
所得的溶液;③向20mL 0.10
 溶液中逐滴加入10mL等浓度NaOH溶液所得的溶液。下列说法正确的是
溶液中逐滴加入10mL等浓度NaOH溶液所得的溶液。下列说法正确的是| A.溶液①、③均显酸性 |
B.溶液①中存在: |
C.得到溶液②发生反应的离子方程式: |
D.溶液③中存在: |
您最近一年使用:0次
解题方法
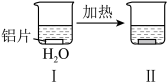
6 . 铝片与 溶液反应的探究实验如下图所示。下列说法错误的是
溶液反应的探究实验如下图所示。下列说法错误的是
 溶液反应的探究实验如下图所示。下列说法错误的是
溶液反应的探究实验如下图所示。下列说法错误的是
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为 和 和 ) ) |
A. 溶液中存在水解平衡 溶液中存在水解平衡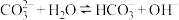 |
B.Ⅲ中产生的细小气泡为 ,原因为 ,原因为 溶液显碱性 溶液显碱性 |
C.Ⅲ→Ⅳ的现象可说明加热可促进 的水解 的水解 |
D.Ⅳ中现象的原因为 与 与 相互促进水解产生了 相互促进水解产生了 和 和 |
您最近一年使用:0次
7 . 常温下,向一定质量的冰醋酸中加水稀释,溶液的导电能力变化如图。已知 ,
,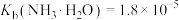 。下列说法正确的是
。下列说法正确的是
 ,
,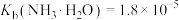 。下列说法正确的是
。下列说法正确的是
| A.a、b、c三点溶液的pH:b>a>c |
| B.a、b、c三点溶液中水的电离程度:a>b>c |
C.b→c过程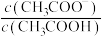 减小 减小 |
| D.向c点溶液中加入等浓度等体积的氮水,所得溶液呈中性 |
您最近一年使用:0次
解题方法
8 . 川西地区盐卤浓度较低,为了降低成本,侯德榜对原有的制碱方法——氨碱法(以食盐、氨气、二氧化碳为原料制取碳酸钠)进行改进。下列说法正确的是

| A.二氧化碳为含极性共价键的非极性分子 |
B.实验室可采用如图所示装置来制取 |
| C.工业上常采用电解饱和食盐水的方法来获得金属钠 |
D. 的 的 溶液中, 溶液中, |
您最近一年使用:0次
名校
解题方法
9 . Ⅰ、按要求回答下列问题:
(1)常温下,有关下列四种溶液的说法正确的是___________。
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=___________ mol·L−1。
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
Ⅱ、氢气可以用于合成甲醇的反应为CO(g)+2H2(g) CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:
CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:___________ (填“>”“<”或“=”)0。
②写出一条可同时提高反应速率和H2平衡转化率的措施:___________ 。
③保证该压强不变,向T1温度下, =0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
=0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡___________ (填“正向”“逆向”或“不”)移动。
(1)常温下,有关下列四种溶液的说法正确的是___________。
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
| A.由水电离出的c(H+):③>① |
| B.①稀释到原来的100倍,pH与②相同 |
C.①与③混合,若溶液pH=7,则溶液中c(NH )>c(Cl-) )>c(Cl-) |
| D.②与④等体积混合,混合溶液的pH>7 |
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=Ⅱ、氢气可以用于合成甲醇的反应为CO(g)+2H2(g)
 CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:
CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示: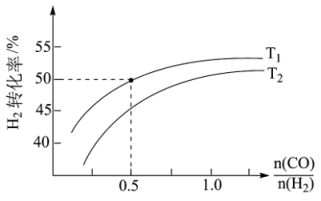
②写出一条可同时提高反应速率和H2平衡转化率的措施:
③保证该压强不变,向T1温度下,
 =0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
=0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
您最近一年使用:0次
10 . 已知常温下部分弱电解质的电离平衡常数如表:
(1)常温下,pH相同的三种溶液①NaF溶液;②NaClO溶液;③Na2CO3溶液,其物质的量浓度由大到小的顺序是_______ 。(填序号)
(2)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式_______ 。
(3)室温下,经测定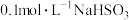 溶液
溶液 ,则
,则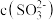
_______  (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。
(4)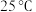 时,将
时,将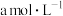 的氨水与
的氨水与 的盐酸等体积混合所得溶液中
的盐酸等体积混合所得溶液中 ,则溶液显
,则溶液显_______ (填“酸”“碱”或“中”)性;用含a的代数式表示 的电离平衡常数
的电离平衡常数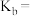
_______ 。
(5)将含 的烟气通入该氨水中,当溶液显中性时,溶液中
的烟气通入该氨水中,当溶液显中性时,溶液中
_______ 。
| 化学式 |  |  |  |  |  |
| 电离常数 |  |  |  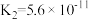 | 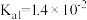 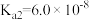 | 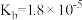 |
(2)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式
(3)室温下,经测定
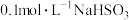 溶液
溶液 ,则
,则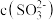
 (填“>”、“=”、“<”)。
(填“>”、“=”、“<”)。(4)
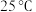 时,将
时,将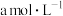 的氨水与
的氨水与 的盐酸等体积混合所得溶液中
的盐酸等体积混合所得溶液中 ,则溶液显
,则溶液显 的电离平衡常数
的电离平衡常数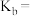
(5)将含
 的烟气通入该氨水中,当溶液显中性时,溶液中
的烟气通入该氨水中,当溶液显中性时,溶液中
您最近一年使用:0次