1 . 常温下,几种弱酸的电离平衡常数如表所示,下列说法正确的是
| 化学式 | HCOOH | H2CO3 | HCN |
| 电离平衡常数 | K=1.8×10﹣4 | K1=4.3×10﹣7 K2=5.6×10﹣11 | K=4.9×10﹣10 |
A.结合H+的能力由大到小:CO >CN﹣>HCO >CN﹣>HCO >HCOO﹣ >HCOO﹣ |
| B.等物质的量浓度的 HCOONa溶液和NaCN溶液,pH大小顺序:HCOONa>NaCN |
| C.加水稀释 HCOOH溶液,其电离平衡常数将减小 |
D.H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+2CN﹣=2HCN+CO |
您最近一年使用:0次
2 . 将高温水蒸气通到KSCN的表面,会发生下列反应:
4KSCN+9H2O(g)=K2CO3+K2S+3CO2+3H2S+4NH3,请填空:
(1)上述反应所涉及的各元素中,原子半径最大的是___________ (填元素符号,下同);属于第二周期元素的非金属性由强到弱的顺序为:___________ 。
(2)上述反应所涉及的各物质中,属于非电解质的是:___________ 。
(3)写出CO2的电子式:___________ 。
(4)已知物质的量浓度均为0.10mol/L的K2CO3和K2S溶液pH如下:
K2CO3水溶液呈碱性的原因是___________ (用化学用语解释),从表中数据可知,K2CO3溶液c(CO )
)___________ K2S溶液c(S2-)(填“>”“<”或“=”)。
4KSCN+9H2O(g)=K2CO3+K2S+3CO2+3H2S+4NH3,请填空:
(1)上述反应所涉及的各元素中,原子半径最大的是
(2)上述反应所涉及的各物质中,属于非电解质的是:
(3)写出CO2的电子式:
(4)已知物质的量浓度均为0.10mol/L的K2CO3和K2S溶液pH如下:
| 溶液 | K2CO3 | K2S |
| pH | 11.6 | 12.5 |
 )
)
您最近一年使用:0次
3 . 下表是几种常见弱酸的电离平衡常数(25℃)。
回答下列各题:
(1)当温度升高时, 值
值_____ (填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的 值不同,那么
值不同,那么 值的大小与酸性的相对强弱有何关系?
值的大小与酸性的相对强弱有何关系?_____ 。
(3)若把 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是_____ ,最弱的是_____ 。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的 、
、 、
、 之间存在着数量上的规律,此规律是
之间存在着数量上的规律,此规律是_____ ,产生此规律的原因是_____ 。
(5)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实_____ (填“能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与碳酸的酸性强弱。方案:_____ 。
| 酸 | 电离方程式 | 电离平衡常数K |
 |  |  |
 |   | 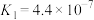  |
 | 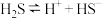  | 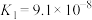 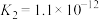 |
 | 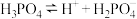   | 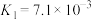 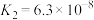 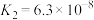 |
(1)当温度升高时,
 值
值(2)在温度相同时,各弱酸的
 值不同,那么
值不同,那么 值的大小与酸性的相对强弱有何关系?
值的大小与酸性的相对强弱有何关系?(3)若把
 都看作是酸,其中酸性最强的是
都看作是酸,其中酸性最强的是(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的
 、
、 、
、 之间存在着数量上的规律,此规律是
之间存在着数量上的规律,此规律是(5)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实
您最近一年使用:0次
名校
解题方法
4 . 科学研究人员在金星大气中探测到了只属于 的光谱特征,据此推断金星大气层或存在生命。已知
的光谱特征,据此推断金星大气层或存在生命。已知 与足量
与足量 溶液发生反应
溶液发生反应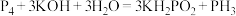 。
。 为弱电解质,下列说法正确的是
为弱电解质,下列说法正确的是
 的光谱特征,据此推断金星大气层或存在生命。已知
的光谱特征,据此推断金星大气层或存在生命。已知 与足量
与足量 溶液发生反应
溶液发生反应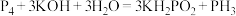 。
。 为弱电解质,下列说法正确的是
为弱电解质,下列说法正确的是A.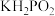 溶液中存在 溶液中存在 的电离平衡和水解平衡,以及水的电离平衡 的电离平衡和水解平衡,以及水的电离平衡 |
B.用 表示基态 表示基态 原子最外层电子排布违反能量最低原理 原子最外层电子排布违反能量最低原理 |
C.基态 原子核外电子有10种空间运动状态 原子核外电子有10种空间运动状态 |
D.加水稀释 溶液,溶液中所有离子浓度均减少 溶液,溶液中所有离子浓度均减少 |
您最近一年使用:0次
2024-03-25更新
|
146次组卷
|
2卷引用:黑龙江省大兴安岭实验中学2023-2024学年高二下学期开学考试化学试卷
名校
解题方法
5 . 下列电离方程式或离子方程式书写正确的是
| A.HF在水溶液中的电离方程式:HF=H++F- |
B.醋酸与氢氧化钠反应的离子方程式:H++OH- H2O H2O |
C.CuSO4在水溶液中水解的离子方程式:Cu2++2H2O Cu (OH)2+2H+ Cu (OH)2+2H+ |
D.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++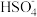 |
您最近一年使用:0次
6 . 物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。请根据所学知识回答下列问题:
(1)在25℃,将一元酸HA的溶液和KOH溶液等体积混合(忽略反应后溶液的体积变化),其实验数据如下表:
①实验1中反应后的溶液中各离子浓度由大到小关系为:___________ 。
②实验2反应后的溶液中:c(A-)+c(HA)_______ 0.2mol/L (填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(2)实验室中配制 溶液时通常需向其中加入盐酸,其目的是
溶液时通常需向其中加入盐酸,其目的是___________ ,实验测得 溶液的
溶液的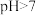 ,某同学将
,某同学将 溶液和
溶液和 溶液混合在一起,发现产生了红褐色沉淀和无色气体,该反应的离子方程式为:
溶液混合在一起,发现产生了红褐色沉淀和无色气体,该反应的离子方程式为:___________ 。
(3)某温度时, ,
, ,
,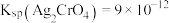 。某溶液含有
。某溶液含有 、
、 和
和 ,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的
,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的 溶液,三种阴离子产生沉淀的先后顺序为
溶液,三种阴离子产生沉淀的先后顺序为___________ (用阴离子符号表示)。
(4)利用如图装置可以模拟铁的电化学防护。
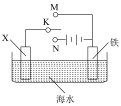
①若X为碳棒,为减缓铁的腐蚀,开关K应置于_____ 处。假设海水中只有NaCl溶质,写出此时总离子反应方程式:_____ 。
②若X为锌,开关K置于M处,该电化学防护法称为_____ ,写出铁电极处的电极反应式:_____ 。
(1)在25℃,将一元酸HA的溶液和KOH溶液等体积混合(忽略反应后溶液的体积变化),其实验数据如下表:
实验编号 | 起始浓度/(mol/L) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
1 | 0.2 | 0.2 |
|
2 |
| 0.4 |
|
②实验2反应后的溶液中:c(A-)+c(HA)
 ”、“
”、“ ”或“
”或“ ”)。
”)。(2)实验室中配制
 溶液时通常需向其中加入盐酸,其目的是
溶液时通常需向其中加入盐酸,其目的是 溶液的
溶液的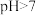 ,某同学将
,某同学将 溶液和
溶液和 溶液混合在一起,发现产生了红褐色沉淀和无色气体,该反应的离子方程式为:
溶液混合在一起,发现产生了红褐色沉淀和无色气体,该反应的离子方程式为:(3)某温度时,
 ,
, ,
,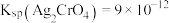 。某溶液含有
。某溶液含有 、
、 和
和 ,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的
,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的 溶液,三种阴离子产生沉淀的先后顺序为
溶液,三种阴离子产生沉淀的先后顺序为(4)利用如图装置可以模拟铁的电化学防护。

①若X为碳棒,为减缓铁的腐蚀,开关K应置于
②若X为锌,开关K置于M处,该电化学防护法称为
您最近一年使用:0次
7 . 25℃时,下列说法不正确的是
A.1LpH=7的 溶液中水电离出的 溶液中水电离出的 的物质的量为 的物质的量为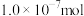 |
B.pH相等的盐酸、 溶液, 溶液,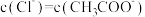 |
C. 的醋酸溶液的电离度分别为 的醋酸溶液的电离度分别为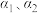 ,则 ,则 |
| D.中和pH和体积均相等的醋酸、盐酸,所需NaOH的物质的量前者多 |
您最近一年使用:0次
名校
8 . 将铜锌合金溶解后与足量 溶液反应(
溶液反应( 不与
不与 反应),生成的
反应),生成的 用
用 标准溶液滴定,根据消耗的
标准溶液滴定,根据消耗的 溶液体积可测算合金中铜的含量。实验过程如下图所示:
溶液体积可测算合金中铜的含量。实验过程如下图所示:

回答下列问题:
(1) 的结构式
的结构式___________ ;“溶解”后锌元素的主要存在形式是___________ (填符号)。
(2)“煮沸”的目的是除去过量的 ,298K时,液态过氧化氢分解,每生成0.01mol
,298K时,液态过氧化氢分解,每生成0.01mol 放出热量1.96kJ,该反应的热化学方程式为
放出热量1.96kJ,该反应的热化学方程式为___________ 。
(3)用缓冲溶液“调 ”是为了避免溶液的酸性太强,否则“滴定”时发生反应:
”是为了避免溶液的酸性太强,否则“滴定”时发生反应:___________ (写离子方程式)。该缓冲溶液是浓度均为0.10mol/L的 和
和 的混合溶液。25℃时,溶液中各种离子浓度由小到大的顺序为
的混合溶液。25℃时,溶液中各种离子浓度由小到大的顺序为___________ 。
(4)“沉淀”步骤中有 沉淀产生,反应的离子方程式
沉淀产生,反应的离子方程式___________ 。
(5)“转化”步骤中, 转化为
转化为 ,
, 吸附
吸附 的倾向比
的倾向比 更小,使“滴定”误差减小。沉淀完全转化后,溶液中
更小,使“滴定”误差减小。沉淀完全转化后,溶液中 ≥
≥___________ 。[已知: ,
, ]
]
 溶液反应(
溶液反应( 不与
不与 反应),生成的
反应),生成的 用
用 标准溶液滴定,根据消耗的
标准溶液滴定,根据消耗的 溶液体积可测算合金中铜的含量。实验过程如下图所示:
溶液体积可测算合金中铜的含量。实验过程如下图所示:
回答下列问题:
(1)
 的结构式
的结构式(2)“煮沸”的目的是除去过量的
 ,298K时,液态过氧化氢分解,每生成0.01mol
,298K时,液态过氧化氢分解,每生成0.01mol 放出热量1.96kJ,该反应的热化学方程式为
放出热量1.96kJ,该反应的热化学方程式为(3)用缓冲溶液“调
 ”是为了避免溶液的酸性太强,否则“滴定”时发生反应:
”是为了避免溶液的酸性太强,否则“滴定”时发生反应: 和
和 的混合溶液。25℃时,溶液中各种离子浓度由小到大的顺序为
的混合溶液。25℃时,溶液中各种离子浓度由小到大的顺序为(4)“沉淀”步骤中有
 沉淀产生,反应的离子方程式
沉淀产生,反应的离子方程式(5)“转化”步骤中,
 转化为
转化为 ,
, 吸附
吸附 的倾向比
的倾向比 更小,使“滴定”误差减小。沉淀完全转化后,溶液中
更小,使“滴定”误差减小。沉淀完全转化后,溶液中 ≥
≥ ,
, ]
]
您最近一年使用:0次
2024-03-21更新
|
23次组卷
|
2卷引用:黑龙江省哈尔滨市双城区兆麟中学2023-2024学年高二下学期开学验收考试化学
名校
9 . 下列有关粒子间关系的说法不正确的是
A. 溶液与 溶液与 溶液等体积混合 溶液等体积混合 |
B.室温下,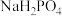 溶液中 溶液中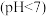 : :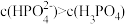 |
C.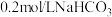 溶液与 溶液与 溶液等体积混合: 溶液等体积混合: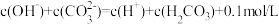 |
D. 水解能力弱于 水解能力弱于 ,则 ,则 的 的 溶液中, 溶液中, 和 和 的总数小于 的总数小于 |
您最近一年使用:0次
名校
解题方法
10 . 下列离子方程式书写正确的是
[已知:
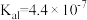
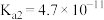

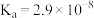 ]
]
[已知:

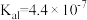
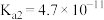

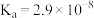 ]
]A.泡沫灭火器的原理: |
B.少量氯气通入碳酸钠溶液中: |
C.用铅电极电解 溶液: 溶液: |
D.向 悬浊液中通入 悬浊液中通入 气体: 气体: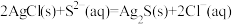 |
您最近一年使用:0次





