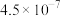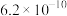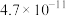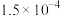解题方法
1 . 下列物质加入水中可以增大水的电离程度的是
| A.NaOH固体 | B. 溶液 溶液 | C. 固体 固体 | D.盐酸 |
您最近半年使用:0次
解题方法
2 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)25℃时对氨水进行如下操作,请填写下列空白。
①若向氨水中加入少量硫酸铵固体,则溶液中 将
将__________ (填“增大”“减小”或“不变”)。
②若向氨水中加入稀盐酸,使氨水恰好被中 和,则此时溶液显___________ (填“酸性”“碱性”或“中性”),用离子方程式表示其原因_________________ ,此溶液中离子的浓度大小顺序为___________
③在浓度为 的氨水中加入等体积
的氨水中加入等体积 的
的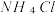 溶液,已知
溶液,已知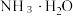 的电离常数为
的电离常数为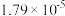 ,此时混合溶液显
,此时混合溶液显___________ (填“酸性”“碱性”或“中性”),此溶液中离子的浓度大小顺序为 ______
(2)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
①上述四种酸酸性由强到弱的顺序为___________ ;
②将少量的CO2通入NaClO溶液中,反应的离子方程式:___________ 。
(1)25℃时对氨水进行如下操作,请填写下列空白。
①若向氨水中加入少量硫酸铵固体,则溶液中
 将
将②若向氨水中加入稀盐酸,使氨水恰好被
③在浓度为
 的氨水中加入等体积
的氨水中加入等体积 的
的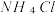 溶液,已知
溶液,已知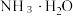 的电离常数为
的电离常数为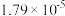 ,此时混合溶液显
,此时混合溶液显(2)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
| 化学式 | HCOOH | H2CO₃ | HCN | HClO |
| 电离平衡常数 | K=1.8×10⁻⁴ | K₁=4.3×10⁻⁷;K2=5.6×10⁻¹¹ | K=4.9×10⁻¹⁰ | K=4.7×10⁻⁸ |
②将少量的CO2通入NaClO溶液中,反应的离子方程式:
您最近半年使用:0次
解题方法
3 . 表示溶液显酸性、碱性或中性的方法有很多,如氢离子浓度与氢氧根浓度的关系、溶液的pH值等。下列表述中能表明溶液一定呈中性的是
| A.c(H+)=c(OH-)的溶液 |
| B.使石蕊试液呈紫色的溶液 |
| C.pH=7的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |
您最近半年使用:0次
解题方法
4 . 回答下列问题:
(1)常温下0.01mol/L HCl溶液:
①由水电离出的c(H+)=______ ;
②pH=______ ;
(2)现有常温下0.01mol/L NH4Cl溶液。
①你认为该溶液呈______ 性,原因是(用离子方程式表示):______ 。
②该溶液中离子浓度由大到小顺序为:______ 。
(3)已知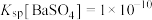 ,当溶液中
,当溶液中 时,
时, 约为
约为______  。
。
(1)常温下0.01mol/L HCl溶液:
①由水电离出的c(H+)=
②pH=
(2)现有常温下0.01mol/L NH4Cl溶液。
①你认为该溶液呈
②该溶液中离子浓度由大到小顺序为:
(3)已知
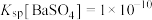 ,当溶液中
,当溶液中 时,
时, 约为
约为 。
。
您最近半年使用:0次
名校
5 . 与氨气相关的化学变化是氮循环和转化的重要一环,对生产、生活有重要的价值。
1.下图转化途径中属于“固氮”的是___________。
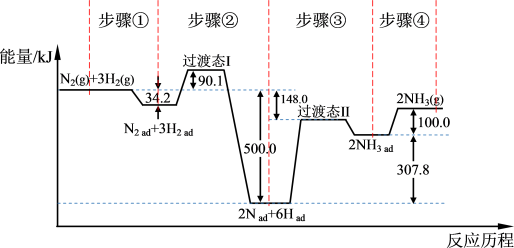
合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如下:(图中ad表示物质吸附在催化剂表面时的状态) 的
的
___________  ,对总反应速率影响较大的是步骤
,对总反应速率影响较大的是步骤___________ 。(填写编号)3.若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是___________。
4.氨是极具前景的氢能载体和性能卓越的“零碳”燃料,利用 的燃烧反应
的燃烧反应 能设计成燃料电池,其工作原理如图所示。电极
能设计成燃料电池,其工作原理如图所示。电极 为
为___________ (选填“正”或“负”)极;电极 的电极反应式为
的电极反应式为___________ ;当正负极共消耗3.136L(标准状况)气体时,通过负载的电子数为___________ 个。 等离子的废液,为了对废液进行处理,某同学采用硫化物沉淀法处理
等离子的废液,为了对废液进行处理,某同学采用硫化物沉淀法处理 。
。
已知:常温下
5.常温下,调节 溶液的
溶液的 ,比较溶液中含硫微粒浓度的大小
,比较溶液中含硫微粒浓度的大小___________ 。
6.常温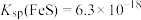 ,下列说法正确的是___________。
,下列说法正确的是___________。
1.下图转化途径中属于“固氮”的是___________。
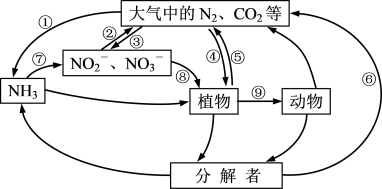
| A.④⑤⑥ | B.①③④ | C.①⑤⑦ | D.②⑧⑨ |
 的
的
 ,对总反应速率影响较大的是步骤
,对总反应速率影响较大的是步骤| A.升高温度,使单位体积内活化分子百分数增加 |
| B.增加反应物的浓度,使单位体积内活化分子百分数增加 |
| C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加 |
| D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加 |
 的燃烧反应
的燃烧反应 能设计成燃料电池,其工作原理如图所示。电极
能设计成燃料电池,其工作原理如图所示。电极 为
为 的电极反应式为
的电极反应式为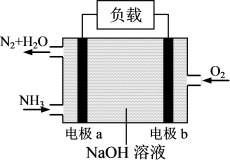
 等离子的废液,为了对废液进行处理,某同学采用硫化物沉淀法处理
等离子的废液,为了对废液进行处理,某同学采用硫化物沉淀法处理 。
。已知:常温下

5.常温下,调节
 溶液的
溶液的 ,比较溶液中含硫微粒浓度的大小
,比较溶液中含硫微粒浓度的大小6.常温
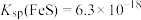 ,下列说法正确的是___________。
,下列说法正确的是___________。A.常温下, 的溶解度大于FeS 的溶解度大于FeS |
B.反应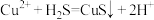 不能发生 不能发生 |
C.除去废液中的 ,可选用 ,可选用 作沉淀剂 作沉淀剂 |
D.常温下,向饱和 溶液中加入少量 溶液中加入少量 固体后, 固体后,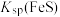 减小 减小 |
您最近半年使用:0次
名校
6 . 锑(Sb)可用作阻燃剂、电极材料、催化剂等物质的原材料。一种以辉锑矿(主要成分为 ,还含有
,还含有 、
、 、MgO、
、MgO、 等)为原料提取锑的工艺如下:
等)为原料提取锑的工艺如下:
回答下列问题:
(1)“溶浸”时氧化产物是S, 被氧化的化学方程式为
被氧化的化学方程式为________ 。
(2)“还原”时加入Sb的目的是将________ 还原,提高产物的纯度。
(3)“水解”时需控制溶液pH=2.5。
① 发生水解的离子方程式为
发生水解的离子方程式为________ 。
②下列能促进该水解反应的措施有________ (填字母)。
A.升高温度 B.增大 C.增大
C.增大 D.加入
D.加入 粉末
粉末
③为避免水解产物中混入 ,
, 浓度应小于
浓度应小于________  (已知
(已知 )。
)。
(4)向“滤液”中通入足量 ,再将滤液pH调至3.5,可析出
,再将滤液pH调至3.5,可析出 沉淀。将沉淀溶于浓盐酸后,产物可返回
沉淀。将沉淀溶于浓盐酸后,产物可返回________ 工序循环使用。
(5)Sb可由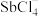 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为________ 。
 ,还含有
,还含有 、
、 、MgO、
、MgO、 等)为原料提取锑的工艺如下:
等)为原料提取锑的工艺如下: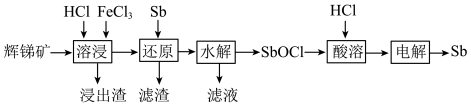
| 金属离子 |
|
|
|
|
开始沉淀时( )的pH )的pH | 2.2 | 3.7 | 7.5 | 9.6 |
完全沉淀时( )的pH )的pH | 3.2 | 4.7 | 9.0 | 11.1 |
(1)“溶浸”时氧化产物是S,
 被氧化的化学方程式为
被氧化的化学方程式为(2)“还原”时加入Sb的目的是将
(3)“水解”时需控制溶液pH=2.5。
①
 发生水解的离子方程式为
发生水解的离子方程式为②下列能促进该水解反应的措施有
A.升高温度 B.增大
 C.增大
C.增大 D.加入
D.加入 粉末
粉末③为避免水解产物中混入
 ,
, 浓度应小于
浓度应小于 (已知
(已知 )。
)。(4)向“滤液”中通入足量
 ,再将滤液pH调至3.5,可析出
,再将滤液pH调至3.5,可析出 沉淀。将沉淀溶于浓盐酸后,产物可返回
沉淀。将沉淀溶于浓盐酸后,产物可返回(5)Sb可由
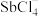 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为
您最近半年使用:0次
名校
7 . 2023年杭州亚运会主火炬使用了零碳甲醇燃料,其制备共消耗了16万吨 。该甲醇的制备反应及副反应如下:
。该甲醇的制备反应及副反应如下:
i.

ii.
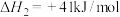
(1)研究表明,CO与 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:________ 。
(2)其他条件相同,当仅改变容器体积时,实验测得CO的平衡产率随着压强的增加而________ 。(填“增大”、“减小”或“不变”)
(3)在催化剂作用下,将 、
、 投入容积为1L的反应器,反应温度对
投入容积为1L的反应器,反应温度对 平衡转化率
平衡转化率 、
、 选择性Y(
选择性Y( )的影响如下。
)的影响如下。
240℃体系达到平衡时用时为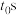 ,则
,则
________  。
。
240℃时反应i的化学平衡常数为________ (列出计算式即可,数据用小数表示)
(4)已知25℃时, 、
、 、HCN的电离平衡常数如下表。
、HCN的电离平衡常数如下表。
①25℃时,某 溶液的pH=8,关于此溶液中的微粒浓度,下列说法正确的是
溶液的pH=8,关于此溶液中的微粒浓度,下列说法正确的是________ 。
A.
B.
C.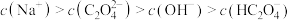
②将少量 溶液加入KCN溶液中,发生反应的离子方程式为
溶液加入KCN溶液中,发生反应的离子方程式为________ 。
(5) 电池可以实现对
电池可以实现对 的利用,该类电池放电的反应方程式为:
的利用,该类电池放电的反应方程式为: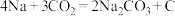 。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式________ 。
 。该甲醇的制备反应及副反应如下:
。该甲醇的制备反应及副反应如下:i.


ii.

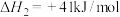
(1)研究表明,CO与
 也能生成
也能生成 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:(2)其他条件相同,当仅改变容器体积时,实验测得CO的平衡产率随着压强的增加而
(3)在催化剂作用下,将
 、
、 投入容积为1L的反应器,反应温度对
投入容积为1L的反应器,反应温度对 平衡转化率
平衡转化率 、
、 选择性Y(
选择性Y( )的影响如下。
)的影响如下。

240℃体系达到平衡时用时为
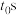 ,则
,则
 。
。240℃时反应i的化学平衡常数为
(4)已知25℃时,
 、
、 、HCN的电离平衡常数如下表。
、HCN的电离平衡常数如下表。
|
| HCN | |
|
|
|
|
|
|
| — |
 溶液的pH=8,关于此溶液中的微粒浓度,下列说法正确的是
溶液的pH=8,关于此溶液中的微粒浓度,下列说法正确的是A.

B.

C.
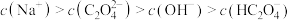
②将少量
 溶液加入KCN溶液中,发生反应的离子方程式为
溶液加入KCN溶液中,发生反应的离子方程式为(5)
 电池可以实现对
电池可以实现对 的利用,该类电池放电的反应方程式为:
的利用,该类电池放电的反应方程式为: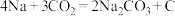 。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
。其工作原理如图所示(固体沉积物中含两种固体)。请写出正极的反应方程式
您最近半年使用:0次
8 . 根据题意,完成下列填空:
(1)某温度时,测得0.1 mol·L-1的NaOH溶液的pH为13,则该温度下水的离子积常数KW=_______ 。
(2)浓度为0.1moL/L的二元弱酸H2S的水溶液中, H2S电离产生的离子有_______ 种(填数字),这几种离子中,浓度大小处于第二位的是_______ (填离子符号)。
(3)250C时,两种酸的电离平衡常数如下表所示。
①表中所列的二种酸中,酸性较弱的是_______ (写化学式)。
②向10mL0.1mol/L的H2R溶液中滴加10mL0.1mol/L的NaOH溶液充分反应后,混合溶液呈_______ 性(填酸性、碱性或中性),理由是(简略写出可做为判断理由的计算过程)______________ 。
(4)纯碱溶液呈碱性是因为它能与水发生水解反应,促进水的电离,但该溶液中由水电离产生的氢离子和氢氧根一定相等,请依此规律完善纯碱溶液中氢氧根浓度和其它相关粒子的相等关系式,即c(OH-)=_____________ 。
(1)某温度时,测得0.1 mol·L-1的NaOH溶液的pH为13,则该温度下水的离子积常数KW=
(2)浓度为0.1moL/L的二元弱酸H2S的水溶液中, H2S电离产生的离子有
(3)250C时,两种酸的电离平衡常数如下表所示。
| 化学式 | H2R | HClO |
| 电离平衡常数 | K1(H2R)=5×10-7,K2(H2R)=2×10-10 | 3.0×10-8 |
②向10mL0.1mol/L的H2R溶液中滴加10mL0.1mol/L的NaOH溶液充分反应后,混合溶液呈
(4)纯碱溶液呈碱性是因为它能与水发生水解反应,促进水的电离,但该溶液中由水电离产生的氢离子和氢氧根一定相等,请依此规律完善纯碱溶液中氢氧根浓度和其它相关粒子的相等关系式,即c(OH-)=
您最近半年使用:0次
解题方法
9 . 现有常温下甲、乙、丙、丁、戊五种溶液,其中,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的H2SO4溶液,丙为0.1mol·L-1的CH3COOH溶液,丁NH4Cl溶液,戊NaF溶液,试回答下列问题:
(1)甲溶液的pH=_______ 。
(2)丙溶液中存在的电离平衡为_______ 、_______ (用电离方程式表示)。
(3)常温下,用水稀释0.1mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是____ (填序号)。①n(H+) ②c(OH-) ③ ④c(H+)·c(OH-)
④c(H+)·c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的由大到小的顺序为_______ 。
(5)丁溶液显酸性原因(用离子方程式表示)_______ 。
(6)戊溶液显碱性的原因(用离子方程式表示)_______ 。
(1)甲溶液的pH=
(2)丙溶液中存在的电离平衡为
(3)常温下,用水稀释0.1mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是
 ④c(H+)·c(OH-)
④c(H+)·c(OH-)(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的由大到小的顺序为
(5)丁溶液显酸性原因(用离子方程式表示)
(6)戊溶液显碱性的原因(用离子方程式表示)
您最近半年使用:0次
解题方法
10 . 25℃时,一定量的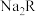 (
( 为二元弱酸)与盐酸混合所得溶液中,部分含R微粒的物质的量分数(
为二元弱酸)与盐酸混合所得溶液中,部分含R微粒的物质的量分数( )与pH的关系如图所示。下列说法错误的是
)与pH的关系如图所示。下列说法错误的是
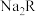 (
( 为二元弱酸)与盐酸混合所得溶液中,部分含R微粒的物质的量分数(
为二元弱酸)与盐酸混合所得溶液中,部分含R微粒的物质的量分数( )与pH的关系如图所示。下列说法错误的是
)与pH的关系如图所示。下列说法错误的是
A.曲线Z表示微粒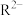 |
B.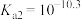 |
C. 时, 时, |
D. 时, 时,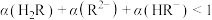 |
您最近半年使用:0次