名校
解题方法
1 . 用氨水吸收 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
___________ 。(已知: 时,电离常数
时,电离常数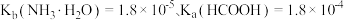 )
)
 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
 时,电离常数
时,电离常数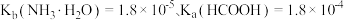 )
)
您最近一年使用:0次
名校
解题方法
2 . 已知水溶液中 和
和 的关系如图所示:
的关系如图所示:
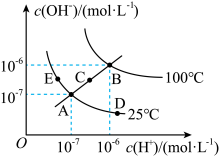
(1)①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是________ 。
②若A点到E点,可采用的措施是________ (填序号,下同);促进水的电离平衡正向移动的措施是________ 。
a.升温 b.加入少量的盐酸 c.加入少量的
(2)已知25℃, 的
的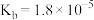 ,
, 的
的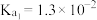 ,
,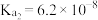 。若氨水的浓度为
。若氨水的浓度为 ,溶液中的
,溶液中的 约为
约为________  。将
。将 通入该氨水中,当
通入该氨水中,当 下降至
下降至 时,溶液中
时,溶液中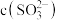 和
和 的比值是
的比值是________ 。
(3)常温下, 的
的 溶液与
溶液与 的硫酸混合,所得溶液的
的硫酸混合,所得溶液的 (近似认为酸碱总体积就是混合液体积),则
(近似认为酸碱总体积就是混合液体积),则 溶液与硫酸的体积比为
溶液与硫酸的体积比为________ 。
 和
和 的关系如图所示:
的关系如图所示:
(1)①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是
②若A点到E点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的

(2)已知25℃,
 的
的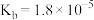 ,
, 的
的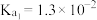 ,
,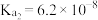 。若氨水的浓度为
。若氨水的浓度为 ,溶液中的
,溶液中的 约为
约为 。将
。将 通入该氨水中,当
通入该氨水中,当 下降至
下降至 时,溶液中
时,溶液中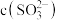 和
和 的比值是
的比值是(3)常温下,
 的
的 溶液与
溶液与 的硫酸混合,所得溶液的
的硫酸混合,所得溶液的 (近似认为酸碱总体积就是混合液体积),则
(近似认为酸碱总体积就是混合液体积),则 溶液与硫酸的体积比为
溶液与硫酸的体积比为
您最近一年使用:0次
3 . 已知:常温下,部分弱电解质的电离平衡常数如下表所示,回答下列问题:
(1)常温下,物质的量浓度相等的下列溶液pH由大到小的顺序是_______ (填序号)。
① 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液
(2)常温下,将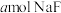 溶于水向该溶液中滴加
溶于水向该溶液中滴加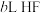 溶液后溶液呈中性,所滴加HF溶液的浓度为
溶液后溶液呈中性,所滴加HF溶液的浓度为_______  。
。
(3)下列离子方程式错误的是_______ (填序号)。
①向 溶液中加入过量
溶液中加入过量 溶液:
溶液:
②向 溶液中通入少量
溶液中通入少量 气体:
气体: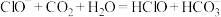
③向 溶液中通入过量
溶液中通入过量 气体:
气体: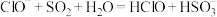
④向 溶液中加入少量
溶液中加入少量 溶液:
溶液:
(4)①下列能证明草酸为弱酸的实验是_______ (填标号)。
A.室温下,分别取等浓度 溶液和盐酸测 pH,
溶液和盐酸测 pH, 溶液 pH 大于盐酸
溶液 pH 大于盐酸
B.室温下,浓度为 c1的 溶液 pH=a,加入一定量的
溶液 pH=a,加入一定量的  溶液,测得pH>a
溶液,测得pH>a
C.室温下,取pH=a(a<3)的 溶液稀释 100 倍后,测其pH<a +2
溶液稀释 100 倍后,测其pH<a +2
D.标准状况下,取0.10mol/L的 溶液100mL 与足量锌粉反应,收集到H2体积为224mL
溶液100mL 与足量锌粉反应,收集到H2体积为224mL
②用0.02000 mol/L的NaOH溶液滴定某未知浓度的草酸,若选择甲基橙为指示剂,到达滴定终点时主要溶质的化学式为_______ 。当pH为3时,溶液中
_______ 。
 | HF |  |  |  | |
 | 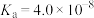 | 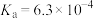 |   | 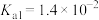  |  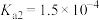 |
①
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液
溶液(2)常温下,将
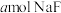 溶于水向该溶液中滴加
溶于水向该溶液中滴加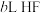 溶液后溶液呈中性,所滴加HF溶液的浓度为
溶液后溶液呈中性,所滴加HF溶液的浓度为 。
。(3)下列离子方程式错误的是
①向
 溶液中加入过量
溶液中加入过量 溶液:
溶液:
②向
 溶液中通入少量
溶液中通入少量 气体:
气体: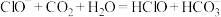
③向
 溶液中通入过量
溶液中通入过量 气体:
气体: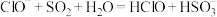
④向
 溶液中加入少量
溶液中加入少量 溶液:
溶液:
(4)①下列能证明草酸为弱酸的实验是
A.室温下,分别取等浓度
 溶液和盐酸测 pH,
溶液和盐酸测 pH, 溶液 pH 大于盐酸
溶液 pH 大于盐酸B.室温下,浓度为 c1的
 溶液 pH=a,加入一定量的
溶液 pH=a,加入一定量的  溶液,测得pH>a
溶液,测得pH>aC.室温下,取pH=a(a<3)的
 溶液稀释 100 倍后,测其pH<a +2
溶液稀释 100 倍后,测其pH<a +2D.标准状况下,取0.10mol/L的
 溶液100mL 与足量锌粉反应,收集到H2体积为224mL
溶液100mL 与足量锌粉反应,收集到H2体积为224mL②用0.02000 mol/L的NaOH溶液滴定某未知浓度的草酸,若选择甲基橙为指示剂,到达滴定终点时主要溶质的化学式为

您最近一年使用:0次
4 . 完成下列问题
(1)室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.10mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。(已知Kb(NH3·H2O)=1.8×10-5;lg3=0.5,lg5=0.7)

①图中a~e五个点,水的电离程度由大到小的顺序是___________ 。
②计算b点的pH值约为___________ 。
③d点,溶液中c(Na+)、c( )、c(
)、c( )、c(NH3·H2O)由大到小的排列顺序是
)、c(NH3·H2O)由大到小的排列顺序是___________ 。
④当滴加NaOH溶液至pH=8时,c(Na+)+c( )-2c(
)-2c( )=
)=___________ mol·L-1(列出数值,不必计算)。
(2)向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.02mol·L-1的盐酸,生成沉淀,已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,则溶液中c(Ag+)=___________ mol·L-1。如果向完全沉淀后的溶液中继续加入100mL0.01 mol·L-1的盐酸,是否有白色沉淀生成?(请写出计算过程)___________ 。
(1)室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.10mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。(已知Kb(NH3·H2O)=1.8×10-5;lg3=0.5,lg5=0.7)

①图中a~e五个点,水的电离程度由大到小的顺序是
②计算b点的pH值约为
③d点,溶液中c(Na+)、c(
 )、c(
)、c( )、c(NH3·H2O)由大到小的排列顺序是
)、c(NH3·H2O)由大到小的排列顺序是④当滴加NaOH溶液至pH=8时,c(Na+)+c(
 )-2c(
)-2c( )=
)=(2)向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.02mol·L-1的盐酸,生成沉淀,已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,则溶液中c(Ag+)=
您最近一年使用:0次
名校
解题方法
5 . 有关溶液中的计算
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=___________ 。
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的___________ 倍。
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为___________ ,Fe3+完全沉淀时溶液的pH为___________ 。
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
名校
解题方法
6 . 已知酸度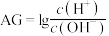
 常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
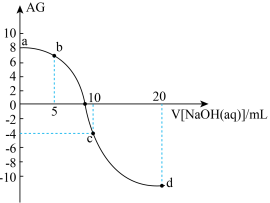
(1)a 点溶液的pH为___________ ,常温下 Kₐ(HA)=___________ 。
(2)若升高温度,0.1 mol∙L−1NaOH 溶液的酸度(AG)将___________ (填“变大”、“变小”或“不变”)。
(3)c 点加入 NaOH 溶液的体积___________ (填“>”、“<”或“=”)10mL。
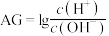
 常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
常温下, 向10mL0.1 mol∙L−1HA溶液中滴加 0.1 mol∙L−1NaOH 溶液,测得溶液的 AG与加入 NaOH 溶液体积的关系如图所示。
(1)a 点溶液的pH为
(2)若升高温度,0.1 mol∙L−1NaOH 溶液的酸度(AG)将
(3)c 点加入 NaOH 溶液的体积
您最近一年使用:0次
名校
解题方法
7 . 利用所学化学反应原理知识进行计算:
(1)某温度下,纯水中的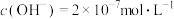 ,若温度不变,滴入稀硫酸使
,若温度不变,滴入稀硫酸使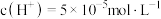 ,则由水电离出的
,则由水电离出的
___________ 。
(2)将99mLpH=2盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的
___________ 。
(3)0.2mol/L的 和0.1mol/L NaOH溶液等体积混合后的溶液中:
和0.1mol/L NaOH溶液等体积混合后的溶液中: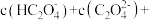
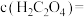
___________ mol/L。
(4)常温下,向100mL0.2mol/L的 溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计),已知25℃时,
溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计),已知25℃时, ,混合后溶液中
,混合后溶液中
___________ mol/L。
(1)某温度下,纯水中的
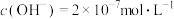 ,若温度不变,滴入稀硫酸使
,若温度不变,滴入稀硫酸使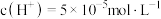 ,则由水电离出的
,则由水电离出的
(2)将99mLpH=2盐酸与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至25℃时溶液的

(3)0.2mol/L的
 和0.1mol/L NaOH溶液等体积混合后的溶液中:
和0.1mol/L NaOH溶液等体积混合后的溶液中: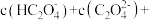
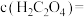
(4)常温下,向100mL0.2mol/L的
 溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计),已知25℃时,
溶液中加入200mL0.15mol/L的盐酸(混合后溶液的体积变化忽略不计),已知25℃时, ,混合后溶液中
,混合后溶液中
您最近一年使用:0次
解题方法
8 . 研究硫元素及其化合物的性质具有重要意义。25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c平(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

(1)pH=13时,溶液中的c平(H2S)+c平(HS-)=________ mol•L-1。
(2)某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=________ 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-15]。

(1)pH=13时,溶液中的c平(H2S)+c平(HS-)=
(2)某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=
您最近一年使用:0次
9 . 酸碱盐等电解质溶液中存在的电离平衡、水解平衡和沉淀溶解平衡都与生命活动、日常生活、工农业生产和环境保护等息息相关。请回答下列问题:
(1) 水溶液显
水溶液显_______ 性(填“酸”、“碱”或“中”),原因是_______ (用离子方程式表示)。
(2)用离子方程式表示泡沫灭火器的工作原理_______ 。
(3)物质的量浓度相同的下列溶液:① ②
② ③
③ ④
④ ,其中
,其中 由大到小的顺序是
由大到小的顺序是_______ (填序号)。
(4)25℃时, 的盐酸和
的盐酸和 的NaOH溶液混合后溶液
的NaOH溶液混合后溶液 (忽略溶液混合时体积的变化),则
(忽略溶液混合时体积的变化),则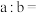
_______ 。
(5)25℃时,某溶液中 白的浓度为
白的浓度为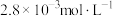 ,使
,使 开始沉淀的
开始沉淀的
_______ 。(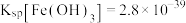 )
)
(6)25℃时,将: 溶液与
溶液与 溶液等体积混合,反应后的溶液中
溶液等体积混合,反应后的溶液中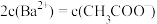 ,用含a和b的代数式表示醋酸的电离常数
,用含a和b的代数式表示醋酸的电离常数
_______ 。
(1)
 水溶液显
水溶液显(2)用离子方程式表示泡沫灭火器的工作原理
(3)物质的量浓度相同的下列溶液:①
 ②
② ③
③ ④
④ ,其中
,其中 由大到小的顺序是
由大到小的顺序是(4)25℃时,
 的盐酸和
的盐酸和 的NaOH溶液混合后溶液
的NaOH溶液混合后溶液 (忽略溶液混合时体积的变化),则
(忽略溶液混合时体积的变化),则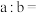
(5)25℃时,某溶液中
 白的浓度为
白的浓度为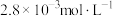 ,使
,使 开始沉淀的
开始沉淀的
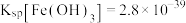 )
)(6)25℃时,将:
 溶液与
溶液与 溶液等体积混合,反应后的溶液中
溶液等体积混合,反应后的溶液中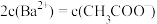 ,用含a和b的代数式表示醋酸的电离常数
,用含a和b的代数式表示醋酸的电离常数
您最近一年使用:0次
10 . 回答下列问题
(1)25℃时有甲、乙、丙三种溶液,甲为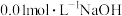 溶液,乙为
溶液,乙为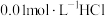 溶液,丙为
溶液,丙为 溶液,请回答下列问题:
溶液,请回答下列问题:
①甲溶液的
_____ 。乙溶液中由水电离出的
_____  。
。
②写出丙的电离方程式_____ 。
③用 的HCl和
的HCl和 两溶液分别与25mL甲完全中和,则消耗这两种酸的体积大小关系为
两溶液分别与25mL甲完全中和,则消耗这两种酸的体积大小关系为
_____  (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
(2)室温时,向 的醋酸溶液中加入等体积的
的醋酸溶液中加入等体积的 的
的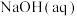 ,充分反应后所得溶液的
,充分反应后所得溶液的 ,所得溶液中
,所得溶液中
_____  。
。
(1)25℃时有甲、乙、丙三种溶液,甲为
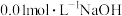 溶液,乙为
溶液,乙为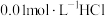 溶液,丙为
溶液,丙为 溶液,请回答下列问题:
溶液,请回答下列问题:①甲溶液的


 。
。②写出丙的电离方程式
③用
 的HCl和
的HCl和 两溶液分别与25mL甲完全中和,则消耗这两种酸的体积大小关系为
两溶液分别与25mL甲完全中和,则消耗这两种酸的体积大小关系为
 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。(2)室温时,向
 的醋酸溶液中加入等体积的
的醋酸溶液中加入等体积的 的
的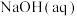 ,充分反应后所得溶液的
,充分反应后所得溶液的 ,所得溶液中
,所得溶液中
 。
。
您最近一年使用:0次



