解题方法
1 . 研究硫元素及其化合物的性质具有重要意义。25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c平(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

(1)pH=13时,溶液中的c平(H2S)+c平(HS-)=________ mol•L-1。
(2)某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=________ 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-15]。

(1)pH=13时,溶液中的c平(H2S)+c平(HS-)=
(2)某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=
您最近一年使用:0次
2 . 已知 时,
时, 溶液中
溶液中 的水解常数
的水解常数 ,则当溶液中
,则当溶液中 时,该溶液的
时,该溶液的
_______ 。
 时,
时, 溶液中
溶液中 的水解常数
的水解常数 ,则当溶液中
,则当溶液中 时,该溶液的
时,该溶液的
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
3 . 已知25℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5,该温度下1mol·L-1的NH4Cl溶液中c(H+)=______ mol·L-1(已知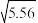 ≈2.36)
≈2.36)
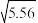 ≈2.36)
≈2.36)
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.氯化铁可用于金属蚀刻,污水处理。
(1)25℃时,FeCl3溶液的pH_______ 7(填“>”、“<”或“=”),原因是(用离子方程式表示)_______ 。把FeCl3溶液蒸干灼烧得到的主要产物是_______ 。
(2)为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
下列说法正确的是 _______ (填序号)
A.上述实验能判断出温度对氯化铁水解的影响
B.表格中x<y<z
C.上述实验能得出:增大盐的浓度,水解平衡正向移动,水解程度越大
Ⅱ.已知:某酸HA (298K时Ka=4.0×10–7),25℃时,向100mL 0.1mol·L−1HA的溶液中逐滴加入0.2mol·L−1NaOH溶液,所得溶液的pH随NaOH溶液的体积变化如图所示(溶液体积变化忽略不计)。
(3)25℃时,0.1mol·L−1HA溶液中由水电离出的c(H+)=_______ mol·L-1。
(4)在X点时,溶液中各离子浓度由大到小的排列顺序是_______ 。
(5)在K点时,溶液中c(OH-)+c(A-)-c(H+)=_______ mol·L−1。
(6)25℃时,NaA的水解平衡常数Kh为_______ (填数值)。
(1)25℃时,FeCl3溶液的pH
(2)为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
实验 | c(FeCl3)/mol • L−1 | 温度/℃ | pH |
1 | 0.1 | 25 | x |
2 | 0.1 | 35 | y |
3 | 0.2 | 25 | z |
A.上述实验能判断出温度对氯化铁水解的影响
B.表格中x<y<z
C.上述实验能得出:增大盐的浓度,水解平衡正向移动,水解程度越大
Ⅱ.已知:某酸HA (298K时Ka=4.0×10–7),25℃时,向100mL 0.1mol·L−1HA的溶液中逐滴加入0.2mol·L−1NaOH溶液,所得溶液的pH随NaOH溶液的体积变化如图所示(溶液体积变化忽略不计)。

(3)25℃时,0.1mol·L−1HA溶液中由水电离出的c(H+)=
(4)在X点时,溶液中各离子浓度由大到小的排列顺序是
(5)在K点时,溶液中c(OH-)+c(A-)-c(H+)=
(6)25℃时,NaA的水解平衡常数Kh为
您最近一年使用:0次
2021-02-04更新
|
704次组卷
|
5卷引用:3.3.2 影响盐类水解的主要因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)3.3.2 影响盐类水解的主要因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)福建省莆田第一中学2020-2021学年高二上学期期末考试化学试题河南省商城县观庙高级中学2021-2022学年高二上学期12月月考化学试题河南省延津第一高级中学2021-2022学年高二上学期第五次考试化学试题湖南省张家界市民族中学2023-2024学年高二上学期第四次月考化学试题
解题方法
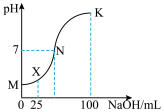
5 . 室温下,已知: 的电离平衡常数
的电离平衡常数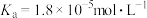 ;
; 的电离平衡常数
的电离平衡常数 、
、 ,回答下列问题:
,回答下列问题:
(1)室温时,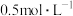 的醋酸溶液中由醋酸电离出的
的醋酸溶液中由醋酸电离出的 约是由水电离出的
约是由水电离出的 的
的________ 倍。
(2)室温时, 的水解平衡常数
的水解平衡常数
________ , 溶液中的各离子浓度由大到小的顺序为
溶液中的各离子浓度由大到小的顺序为________________ 。若向 溶液中加入少量
溶液中加入少量 ,则溶液中
,则溶液中 将
将________ (填“增大”“减小”或“不变”)。
(3)室温时, 溶液的
溶液的
________ 。
 的电离平衡常数
的电离平衡常数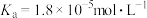 ;
; 的电离平衡常数
的电离平衡常数 、
、 ,回答下列问题:
,回答下列问题:(1)室温时,
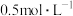 的醋酸溶液中由醋酸电离出的
的醋酸溶液中由醋酸电离出的 约是由水电离出的
约是由水电离出的 的
的(2)室温时,
 的水解平衡常数
的水解平衡常数
 溶液中的各离子浓度由大到小的顺序为
溶液中的各离子浓度由大到小的顺序为 溶液中加入少量
溶液中加入少量 ,则溶液中
,则溶液中 将
将(3)室温时,
 溶液的
溶液的
您最近一年使用:0次
名校
6 . 室温下,已知: CH3COOH的电离平衡常数Ka=1.8×10-5;H2SO3的电离平衡常数Kal=1.0×10-2、Ka2=1.0×10-7,回答下列问题:
(1)室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的________ 倍。
(2)室温时,NaHSO3的水解平衡常数Kh=________ ,NaHSO3溶液中的各离子浓度由大到小的顺序为________________ 。若向NaHSO3溶液中加入少量I2,则溶液中c(H2SO3)/c(HSO3-)将________ (填“增大”、“减小”或“不变”)
(3)室温时,0.1 mol/L Na2SO3溶液的pH=________
(1)室温时,0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的
(2)室温时,NaHSO3的水解平衡常数Kh=
(3)室温时,0.1 mol/L Na2SO3溶液的pH=
您最近一年使用:0次
2018-01-10更新
|
937次组卷
|
4卷引用:高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 第三节综合训练



