1 . 常温下,往20.00mL1.000mol·L-1氨水中滴入等浓度盐酸,溶液pH和温度随加入盐酸体积的变化曲线如图:___________ Kw(d)(填“>”、“<”或“=”)。
(2)若a点的pH=11,则常温下Kb(NH3·H2O)=___________ 。
(3)当盐酸滴入10mL时得到b点溶液,此时b点溶液中物料守恒___________ ,c(NH3·H2O)___________ c( )(填“>”、“<”或“=”)
)(填“>”、“<”或“=”)
(4)c点溶液的电荷守恒___________ ,此时c点溶液中c( )
)___________ c(Cl-)(填“>”、“<”或“=”)。
(5)a、b、c三点中,水电离出的H+浓度从大到小顺序是___________ ,且此时a点溶液pH=11中水电离出的H+浓度为___________ 。
(2)若a点的pH=11,则常温下Kb(NH3·H2O)=
(3)当盐酸滴入10mL时得到b点溶液,此时b点溶液中物料守恒
 )(填“>”、“<”或“=”)
)(填“>”、“<”或“=”)(4)c点溶液的电荷守恒
 )
)(5)a、b、c三点中,水电离出的H+浓度从大到小顺序是
您最近一年使用:0次
名校
解题方法
2 . 下列有关说法正确的是
A.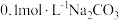 与 与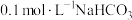 溶液等体积混合: 溶液等体积混合: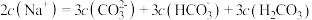 |
B.用相同浓度的 溶液分别滴定等体积 溶液分别滴定等体积 均为3的盐酸和甲酸至终点,消耗 均为3的盐酸和甲酸至终点,消耗 溶液的体积相等 溶液的体积相等 |
C.将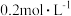 的 的 与 与 的 的 溶液等体积混合后 溶液等体积混合后 ,则: ,则: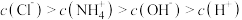 |
D.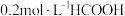 与 与 等体积混合后的溶液中: 等体积混合后的溶液中: |
您最近一年使用:0次
名校
解题方法
3 . 用0.100mol·L-1NaOH溶液滴定等浓度的20mL柠檬酸溶液,滴定曲线如下图所示:_____ 、______ 。
(2)图中50~60mL之间,反应的离子方程式为_______ 。
(3)滴定终点的指示剂选用_______试液。
(4)在上述滴定过程中,各微粒浓度大小关系正确的是_______。
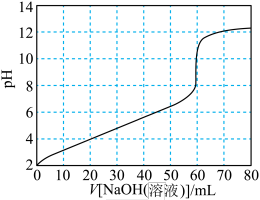
(2)图中50~60mL之间,反应的离子方程式为
(3)滴定终点的指示剂选用_______试液。
| A.无色酚酞 | B.甲基橙 | C.紫色石蕊 | D.品红 |
(4)在上述滴定过程中,各微粒浓度大小关系正确的是_______。
A. 时, 时,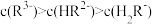 |
B. 时, 时,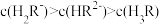 |
C. 时, 时,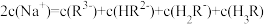 |
D. 时, 时,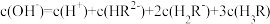 |
您最近一年使用:0次
解题方法
4 . 下列各组离子在指定溶液中一定能大量共存的是
A.在 的溶液中: 的溶液中: 、 、 、 、 、CO 、CO |
B.使甲基橙变红的溶液中: 、 、 、 、 、 、 |
C.透明溶液中: 、 、 、 、 、 、 |
D.常温下,水电离出的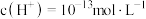 溶液中: 溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次
解题方法
5 . 请按要求回答以下问题:
(1)基态F原子的核外电子轨道表达式为___________ 。
(2)25Mn原子核外电子排布式为___________ 。
(3)菱锌矿ZnCO3中基态30Zn原子价电子排布式___________ ,基态C原子的核外电子占据的最高能级电子云轮廓为___________ ,基态O原子有___________ 种运动状态不同的电子。
(4)常温下,0.1mol·L-1NaHCO3溶液中,c( )<c(H2CO3),则溶液显
)<c(H2CO3),则溶液显___________ 性。
(1)基态F原子的核外电子轨道表达式为
(2)25Mn原子核外电子排布式为
(3)菱锌矿ZnCO3中基态30Zn原子价电子排布式
(4)常温下,0.1mol·L-1NaHCO3溶液中,c(
 )<c(H2CO3),则溶液显
)<c(H2CO3),则溶液显
您最近一年使用:0次
解题方法
6 . 下列实验操作不能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 实验室配制FeCl3水溶液 | 将FeCl3溶于少量浓盐酸中,再加水稀释 |
| B | 除去MgCl2酸性溶液中的Fe3+ | 加入过量MgO充分搅拌,过滤 |
| C | 证明Cu(OH)2的Ksp比Mg(OH)2的小 | 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液 |
| D | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 设NA为阿伏加德罗常数的值,下列说法错误的是
| A.1L0.1mol·L-1CH3COONa溶液中,CH3COO-的数目小于0.1NA |
| B.常温下,1LpH=1的H2SO4溶液中,H+的数目为0.1NA |
| C.32gSO2与过量O2反应生成的SO3分子数为0.5NA |
| D.电解饱和食盐水收集到标准状况下2.24L氯气,转移电子数为0.2NA |
您最近一年使用:0次
8 .  为锂离子电池的正极材料的前体,用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。利用以氟磷灰石[主要成分为
为锂离子电池的正极材料的前体,用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。利用以氟磷灰石[主要成分为 ]按下列流程进行制备:
]按下列流程进行制备: 时
时 电离平衡常数
电离平衡常数 ,碳酸电离平衡常数
,碳酸电离平衡常数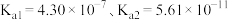 。下列说法正确的是
。下列说法正确的是
 为锂离子电池的正极材料的前体,用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。利用以氟磷灰石[主要成分为
为锂离子电池的正极材料的前体,用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。利用以氟磷灰石[主要成分为 ]按下列流程进行制备:
]按下列流程进行制备:
 时
时 电离平衡常数
电离平衡常数 ,碳酸电离平衡常数
,碳酸电离平衡常数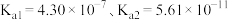 。下列说法正确的是
。下列说法正确的是A. 滴入足量 滴入足量 溶液中反应: 溶液中反应: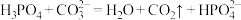 |
B.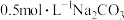 溶液中存在: 溶液中存在: |
C. 溶液中: 溶液中: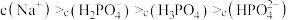 |
D.产生 沉淀的上层清液中, 沉淀的上层清液中, |
您最近一年使用:0次
解题方法
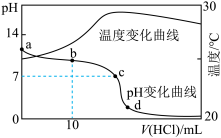
9 . 碳酸氢钠广泛应用于化工、医药、食品和纺织等领域。
(1)实验室用碳酸氢钠固体配制 溶液,需要的仪器有药匙、胶头滴管、量筒、
溶液,需要的仪器有药匙、胶头滴管、量筒、_____ (从下图中选择,写出仪器名称)。 碳酸氢钠溶液于锥形瓶中,滴入2滴甲基橙作指示剂,用浓度为
碳酸氢钠溶液于锥形瓶中,滴入2滴甲基橙作指示剂,用浓度为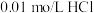 溶液滴定未知浓度的碳酸氢钠溶液。
溶液滴定未知浓度的碳酸氢钠溶液。
①滴定终点的现象是_____ 。
②重复4次的实验数据如下表(待测液的体积均为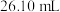 )。
)。
标准 溶液体积的平均值为
溶液体积的平均值为_____  ,用该数据可计算出碳酸氢钠溶液的浓度。
,用该数据可计算出碳酸氢钠溶液的浓度。
(3) 时,向
时,向 溶液中滴加
溶液中滴加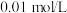 的盐酸,溶液的
的盐酸,溶液的 随加入的盐酸的体积变化如图所示。下列说法正确的是_____(填标号)。
随加入的盐酸的体积变化如图所示。下列说法正确的是_____(填标号)。
(4)某化学小组探究外界因素对 水解程度的影响。甲同学设计实验方案如下
水解程度的影响。甲同学设计实验方案如下
(表中溶液浓度均为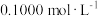 ):
):
i.实验1和2探究加水稀释对 水解程度的影响;
水解程度的影响;
ii.实验1和3探究加入 对
对 水解程度的影响;
水解程度的影响;
iii.实验1和4探究温度对 水解程度的影响。
水解程度的影响。
①根据甲同学的实验方案,补充数据:
_____  。加水稀释
。加水稀释 的水解程度
的水解程度_____ (填“增大”或“减小”)。
②已知 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测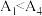 ,但实验结果为
,但实验结果为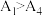 。实验结果与预测不一致的原因可能是
。实验结果与预测不一致的原因可能是_____ 。
(1)实验室用碳酸氢钠固体配制
 溶液,需要的仪器有药匙、胶头滴管、量筒、
溶液,需要的仪器有药匙、胶头滴管、量筒、
 碳酸氢钠溶液于锥形瓶中,滴入2滴甲基橙作指示剂,用浓度为
碳酸氢钠溶液于锥形瓶中,滴入2滴甲基橙作指示剂,用浓度为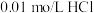 溶液滴定未知浓度的碳酸氢钠溶液。
溶液滴定未知浓度的碳酸氢钠溶液。①滴定终点的现象是
②重复4次的实验数据如下表(待测液的体积均为
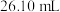 )。
)。| 实验次数 | 1 | 2 | 3 | 4 |
 溶液体积/ 溶液体积/ | 26.10 | 28.20 | 26.12 | 26.08 |
 溶液体积的平均值为
溶液体积的平均值为 ,用该数据可计算出碳酸氢钠溶液的浓度。
,用该数据可计算出碳酸氢钠溶液的浓度。(3)
 时,向
时,向 溶液中滴加
溶液中滴加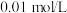 的盐酸,溶液的
的盐酸,溶液的 随加入的盐酸的体积变化如图所示。下列说法正确的是_____(填标号)。
随加入的盐酸的体积变化如图所示。下列说法正确的是_____(填标号)。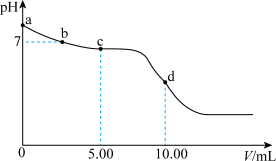
A.若a点坐标为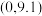 ,则 ,则 水解常数的数量级为 水解常数的数量级为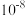 |
B.b点, |
C.c点,溶液中的 主要来自 主要来自 的电离 的电离 |
D.d点,溶液中微粒浓度存在关系: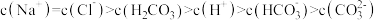 |
(4)某化学小组探究外界因素对
 水解程度的影响。甲同学设计实验方案如下
水解程度的影响。甲同学设计实验方案如下(表中溶液浓度均为
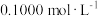 ):
):i.实验1和2探究加水稀释对
 水解程度的影响;
水解程度的影响;ii.实验1和3探究加入
 对
对 水解程度的影响;
水解程度的影响;iii.实验1和4探究温度对
 水解程度的影响。
水解程度的影响。| 序号 | 温度 | 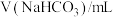 |  |  |  |
| 1 |  | 30.0 | 0 | 0 | 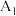 |
| 2 |  | 8.0 | 0 | 22.0 |  |
| 3 |  | 15.0 | a | b | 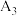 |
| 4 |  | 30.1 | 0 | 0 | 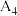 |

 。加水稀释
。加水稀释 的水解程度
的水解程度②已知
 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测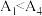 ,但实验结果为
,但实验结果为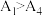 。实验结果与预测不一致的原因可能是
。实验结果与预测不一致的原因可能是
您最近一年使用:0次
2024-04-29更新
|
36次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
10 . 研究水溶液中的粒子行为在研究中具有重要价值。
根据下表所列三种溶液在25℃时的相关数据,按要求填空:
(1)用离子方程式表示CH3COOH溶液显酸性的原因 ___________ 。
(2)比较溶液(Ⅱ)、(Ⅲ)中 的大小关系是(Ⅱ)
的大小关系是(Ⅱ)___________ (Ⅲ)(填“>”、“<”或“=”)。
(3)溶液(Ⅱ)中各离子浓度由大到小的顺序是___________ 。
(4)溶液(Ⅰ)和(Ⅱ)中由水电离出的 之比是
之比是 ___________ 。
根据下表所列三种溶液在25℃时的相关数据,按要求填空:
| 溶液 | 物质的量浓度 | pH | 用离子方程式表示溶液显酸性的原因 |
| (Ⅰ)CH3COOH | 0.1mol/L | 3 | _______ |
| (Ⅱ)NH4Cl | 0.1mol/L | 6 | / |
| (Ⅲ)NH4HSO4 | 0.1mol/L | 1 | / |
(2)比较溶液(Ⅱ)、(Ⅲ)中
 的大小关系是(Ⅱ)
的大小关系是(Ⅱ)(3)溶液(Ⅱ)中各离子浓度由大到小的顺序是
(4)溶液(Ⅰ)和(Ⅱ)中由水电离出的
 之比是
之比是
您最近一年使用:0次



