解题方法
1 . 碳、氮的单质及其化合物在生产和生活中有广泛应用。
(1)已知在298K时,C(石墨)完全燃烧的热化学方程式:C(石墨)+O2(g)=CO2(g) ∆H=-393.5kJ·mol-1。该反应属于___________ (填“放热”或“吸热”)反应。
(2)—定条件下,在某密闭容器中进行反应:N2(g)+3H2(g)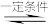 2NH3(g) ∆H<O。
2NH3(g) ∆H<O。
①若N2(g)的起始浓度为1mol-1•L-1,H2(g)的起始浓度为3mol•L-1,反应进行到2min时,测得H2(g)浓度为2mol•L-1,测2min内v(H2)=___________ mol•L-1•min•L-1。
②当反应达到平衡时,若只升高温度,则平衡向___________ (填“正反应”或“逆反应”)方向移动。
③当反应达到平衡时,若只增大压强,则化学平衡常数K___________ (填"增大”“减小”或“不变”)。
(3)常温下,往0.1mol•L-1NH4Cl溶液中滴入紫色石蕊试液后,溶液变红色,则该溶液pH___________ 7(填“〉”或“<”);c( )
)___________ c(Cl-)(填“〉”或“<”)。
(4)如图所示实验,用石墨电极电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
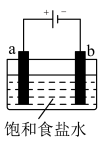
①a电极是电解池的___________ (填“阳极”或“阴极”)。
②溶液中H+向___________ (填“a”或“b”)电极移动。
③生成Cl2的电极反应式:___________ 。
(1)已知在298K时,C(石墨)完全燃烧的热化学方程式:C(石墨)+O2(g)=CO2(g) ∆H=-393.5kJ·mol-1。该反应属于
(2)—定条件下,在某密闭容器中进行反应:N2(g)+3H2(g)
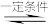 2NH3(g) ∆H<O。
2NH3(g) ∆H<O。①若N2(g)的起始浓度为1mol-1•L-1,H2(g)的起始浓度为3mol•L-1,反应进行到2min时,测得H2(g)浓度为2mol•L-1,测2min内v(H2)=
②当反应达到平衡时,若只升高温度,则平衡向
③当反应达到平衡时,若只增大压强,则化学平衡常数K
(3)常温下,往0.1mol•L-1NH4Cl溶液中滴入紫色石蕊试液后,溶液变红色,则该溶液pH
 )
)(4)如图所示实验,用石墨电极电解饱和食盐水:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
①a电极是电解池的
②溶液中H+向
③生成Cl2的电极反应式:
您最近一年使用:0次
解题方法
2 . 物质的性质决定其用途。下列物质的性质与其用途相关的是
| 选项 | 性质 | 用途 |
| A |  受热易分解 受热易分解 | 用于泡沫灭火器 |
| B | NaClO溶液有碱性 | 用作漂白液 |
| C |  可与 可与 反应 反应 | 用于呼吸面具 |
| D | 乙烯能在空气中燃烧 | 生产聚乙烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 铵态氮肥的过度使用会导致水体的富营养化,研究发现,可以用化学方法和生物方法去除氨氮。现探究去除溶液中氨氮的最适宜条件。
(1)化学方法一般用次氯酸钠氧化。次氯酸钠可以和水中溶解的氨气反应得到无毒无害物质,其离子方程式为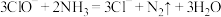 。次氯酸钠溶液中含氯的微粒有
。次氯酸钠溶液中含氯的微粒有_______ 。
(2)规定义:氨氮脱除率
氨氮脱除率受溶液pH 的影响。如表是不同pH下的氨氮脱除率:
的影响。如表是不同pH下的氨氮脱除率:
图示为最适宜pH条件,NaClO和 起始投料比例不同的情况下的氨氮脱除率。
起始投料比例不同的情况下的氨氮脱除率。

试分析为什么最佳pH时,按照3∶2投料氨氮脱除率较低,只有0.6,写出两个可能的原因:_____ 。
(3)由上述信息判断,反应的最佳pH范围是_______ ,最佳投料比是_______ 。
生物方法是利用硝化细菌,将土壤中的 转化为
转化为 后,土壤中的
后,土壤中的 进一步将
进一步将 氧化为
氧化为 。之后,在氧气较少的环境下,
。之后,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以
反应,使氮以 形式放出。
形式放出。
(4)氧气与 反应时,反应物
反应时,反应物 与
与 的物质的量之比为
的物质的量之比为_______ 。写出 与
与 作用生成
作用生成 的离子方程式:
的离子方程式:_______ 。
(5)在VLamol·L 的氨水中滴加等体积0.01mol·L
的氨水中滴加等体积0.01mol·L 的盐酸,使
的盐酸,使 ,则产物中一水合氨浓度为
,则产物中一水合氨浓度为_______ 。
(1)化学方法一般用次氯酸钠氧化。次氯酸钠可以和水中溶解的氨气反应得到无毒无害物质,其离子方程式为
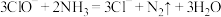 。次氯酸钠溶液中含氯的微粒有
。次氯酸钠溶液中含氯的微粒有(2)规定义:氨氮脱除率

氨氮脱除率受溶液pH
 的影响。如表是不同pH下的氨氮脱除率:
的影响。如表是不同pH下的氨氮脱除率:| pH | 反应前氮元素质量 | 反应后氮元素质量 | 氨氮脱除率 |
| 5.8 | 49.3 | 24.11 | 51.1% |
| 6.9 | 49.3 | 19.08 | 61.3% |
| 7.7 | 49.3 | 16.86 | 65.8% |
| 8.8 | 49.3 | 18.88 | 61.7% |
| 9.3 | 49.3 | 25.29 | x |
 起始投料比例不同的情况下的氨氮脱除率。
起始投料比例不同的情况下的氨氮脱除率。
试分析为什么最佳pH时,按照3∶2投料氨氮脱除率较低,只有0.6,写出两个可能的原因:
(3)由上述信息判断,反应的最佳pH范围是
生物方法是利用硝化细菌,将土壤中的
 转化为
转化为 后,土壤中的
后,土壤中的 进一步将
进一步将 氧化为
氧化为 。之后,在氧气较少的环境下,
。之后,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以
反应,使氮以 形式放出。
形式放出。(4)氧气与
 反应时,反应物
反应时,反应物 与
与 的物质的量之比为
的物质的量之比为 与
与 作用生成
作用生成 的离子方程式:
的离子方程式:(5)在VLamol·L
 的氨水中滴加等体积0.01mol·L
的氨水中滴加等体积0.01mol·L 的盐酸,使
的盐酸,使 ,则产物中一水合氨浓度为
,则产物中一水合氨浓度为
您最近一年使用:0次
11-12高二上·甘肃兰州·期中
真题
名校
4 . 下列离子在稳定人体血液的pH中起作用的是
| A.HCO3- | B.Na+ | C.Fe2+ | D.Cl- |
您最近一年使用:0次
2023-01-30更新
|
93次组卷
|
22卷引用:2018年上海市普通高中学业水平化学合格性考试
2018年上海市普通高中学业水平化学合格性考试(已下线)2011-2012学年甘肃省兰州一中高二上学期期中考试化学(文)试卷(已下线)2011-2012年山西省太原五中高二上学期期中考试化学(文)试卷2015-2016学年陕西西安第一中学高二上期中考试化学试卷山西省大同市2022-2023学年高二上学期11月期中考试化学试题浙江省绍兴市柯桥区2022-2023学年高二上学期期末教学质量调测化学试题上海市致远高级中学2022-2023学年高二上学期期末教学评估化学等级考试题(已下线)专题06 酸碱中和与盐类水解及难溶电解质的沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(上海专用)上海市延安中学2016-2017学年高一下学期期末考试化学试题上海市宝山区2018届高三下学期教学质量检测(二模)化学试题【区级联考】上海市长宁区2019届高三上学期期末教学质量检测化学试题【区级联考】上海市黄浦区2019届高三第一学期期末(一模)学科质量检测化学试题(已下线)专题2.2 离子反应 离子共存及检验(练)-《2020年高考一轮复习讲练测》上海市长宁区2019届高三一模化学试题上海市同济大学第一附属中学2019—2020学年高三上学期期中考试化学试题上海市宝山区2020届高三上学期第一次模拟考试(等级考)化学试题2011年上海市高考化学试题上海市普陀区2016届高三上学期12月教学质量调研化学试题上海市青浦区高级中学2017-2018学年高三上学期期中考试化学试题上海市延安中学2018-2019学年高一下学期期末考化学试题上海市上海中学东校2020届高三上学期期中考试化学试题浙江省诸暨市2017-2018学年高一下学期期末考试化学试题
5 . 水溶液中的离子平衡是以化学平衡理论为基础的进一步探究。
(1)常温下,等体积的0.10mol/L氨水与0.10mol/L烧碱溶液相比,c(OH-)的大小关系为前者_____ 后者(填“大于”“等于”或“小于”,下同);常温下,pH均为5的氯化铵溶液与盐酸相比,溶液中水的电离程度前者_____ 后者,两者均稀释10倍,pH的大小关系为前者_____ 后者。
(2)醋酸钠溶液呈碱性,其原因是_____ (用离子方程式表示)。
(3)常温下,Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36,则FeS的溶解度_____ CuS的溶解度(填“大于”“等于”或“小于”);在处理含有Cu2+的污水时,可向其中加入FeS固体作为沉淀剂,FeS逐渐溶解,Cu2+转化为CuS沉淀,用沉淀溶解平衡原理解释其原因为_____ 。
(1)常温下,等体积的0.10mol/L氨水与0.10mol/L烧碱溶液相比,c(OH-)的大小关系为前者
(2)醋酸钠溶液呈碱性,其原因是
(3)常温下,Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36,则FeS的溶解度
您最近一年使用:0次
2023-01-07更新
|
123次组卷
|
2卷引用:2021年河南省普通高中学生学业水平考试化学试题
解题方法
6 . 亚硝酸是一种弱酸,Ka(HNO2)=5.6×10-4,NaNO2可用于滴定分析。
(1)常温下,0.1 mol/L的NaNO2溶液呈__________ (填“酸性”、“中性”或“碱性”);原因是__________ (用离子方程式表示)。
(2)0.1 mol/LNaNO2溶液中部分微粒组分及浓度如图所示,X表示的是_______ (填写微粒化学式)。c(NO2-)+c(HNO2)=__________ mol/L。

(3)NaNO2用于测药物中对氨基苯磺酸(Ar-NH2)的含量。测定原理为:酸性环境中,NaNO2先转化为HNO2:HX + NaNO2 = HNO2 + NaX,HNO2再与Ar-NH2以物质的量比1:1发生反应。
①下列酸中,能作为HX来使用的是_______ 。
A.醋酸(Ka=1.8×10-5) B.盐酸 C.次氯酸(Ka=4.0×10-8)
②反应体系中,Ar-NH2和少量KI共存时,HNO2会先与Ar-NH2完全反应后,再氧化KI。滴定时用KI-淀粉糊剂作指示剂,滴定终点时淀粉糊剂显_______ 色。
③用该法测定含 Ar-NH2(Mr=173)药物样品的纯度,每次取0.400g样品,用0.100mol/L NaNO2标准溶液进行滴定,实验结果如下:
则该样品中对氨基苯磺酸的纯度是__________ 。
第二次实验数据出现异常,造成这种异常的原因可能是________ (填代号)。
a.锥形瓶洗净后未干燥
b.滴定终点时俯视读数
c.装标准溶液的滴定管未用标准溶液润洗
(4)已知298K时,H2CO3的Ka1=4.2×10-7、Ka2=5.61×10-11。将浓度均为0.1mol/L的Na2CO3及 HNO2溶液等体积混合,溶液中阴离子浓度由大到小的顺序为_______ 。
(1)常温下,0.1 mol/L的NaNO2溶液呈
(2)0.1 mol/LNaNO2溶液中部分微粒组分及浓度如图所示,X表示的是

(3)NaNO2用于测药物中对氨基苯磺酸(Ar-NH2)的含量。测定原理为:酸性环境中,NaNO2先转化为HNO2:HX + NaNO2 = HNO2 + NaX,HNO2再与Ar-NH2以物质的量比1:1发生反应。
①下列酸中,能作为HX来使用的是
A.醋酸(Ka=1.8×10-5) B.盐酸 C.次氯酸(Ka=4.0×10-8)
②反应体系中,Ar-NH2和少量KI共存时,HNO2会先与Ar-NH2完全反应后,再氧化KI。滴定时用KI-淀粉糊剂作指示剂,滴定终点时淀粉糊剂显
③用该法测定含 Ar-NH2(Mr=173)药物样品的纯度,每次取0.400g样品,用0.100mol/L NaNO2标准溶液进行滴定,实验结果如下:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗NaNO2溶液体积/mL | 20.12 | 20.90 | 20.00 | 19.88 |
第二次实验数据出现异常,造成这种异常的原因可能是
a.锥形瓶洗净后未干燥
b.滴定终点时俯视读数
c.装标准溶液的滴定管未用标准溶液润洗
(4)已知298K时,H2CO3的Ka1=4.2×10-7、Ka2=5.61×10-11。将浓度均为0.1mol/L的Na2CO3及 HNO2溶液等体积混合,溶液中阴离子浓度由大到小的顺序为
您最近一年使用:0次
名校
解题方法
7 . G是一种有机碱,溶于水成碱性的原理:G+H2O GH++OH-,室温下用0.1mol/L盐酸滴定10 mL0.1 mol/LG溶液,溶液pH的变化pH曲线如图所示。下列叙述正确的是
GH++OH-,室温下用0.1mol/L盐酸滴定10 mL0.1 mol/LG溶液,溶液pH的变化pH曲线如图所示。下列叙述正确的是
 GH++OH-,室温下用0.1mol/L盐酸滴定10 mL0.1 mol/LG溶液,溶液pH的变化pH曲线如图所示。下列叙述正确的是
GH++OH-,室温下用0.1mol/L盐酸滴定10 mL0.1 mol/LG溶液,溶液pH的变化pH曲线如图所示。下列叙述正确的是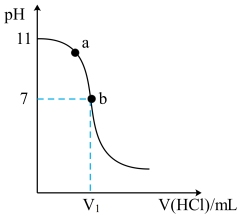
| A.G的近似电离常数是1×10-21 |
| B.V1>10 mL |
| C.水的电离程度:a<b |
| D.V(HCl)=20 mL 时,c(GH+)+c(G)=c(Cl-) |
您最近一年使用:0次
2022-11-27更新
|
204次组卷
|
2卷引用:广东省佛山市南海区2022-2023学年高二上学期学业水平测试化学试题
解题方法
8 . 2022年3月“天宫课堂”第二课中,航天员利用过饱和醋酸钠(CH3COONa)溶液的结晶现象制造了美丽的“冰雪”。下列有关说法不正确的是
| A.CH3COONa 是强电解质 |
| B.加热CH3COONa溶液,pH减小 |
| C.CH3COONa加入蒸馏水中,水的电离程度增大 |
| D.CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+) |
您最近一年使用:0次
解题方法
9 . 在NaHCO3溶液中,下列离子能大量共存的是
| A.H+ | B. | C.Al3+ | D.OH- |
您最近一年使用:0次
10 . 常温下,下列物质因水解而使其溶液显酸性的是
| A.HCl | B.Na2SO4 | C.K2CO3 | D.FeCl3 |
您最近一年使用:0次



