亚硝酸是一种弱酸,Ka(HNO2)=5.6×10-4,NaNO2可用于滴定分析。
(1)常温下,0.1 mol/L的NaNO2溶液呈__________ (填“酸性”、“中性”或“碱性”);原因是__________ (用离子方程式表示)。
(2)0.1 mol/LNaNO2溶液中部分微粒组分及浓度如图所示,X表示的是_______ (填写微粒化学式)。c(NO2-)+c(HNO2)=__________ mol/L。

(3)NaNO2用于测药物中对氨基苯磺酸(Ar-NH2)的含量。测定原理为:酸性环境中,NaNO2先转化为HNO2:HX + NaNO2 = HNO2 + NaX,HNO2再与Ar-NH2以物质的量比1:1发生反应。
①下列酸中,能作为HX来使用的是_______ 。
A.醋酸(Ka=1.8×10-5) B.盐酸 C.次氯酸(Ka=4.0×10-8)
②反应体系中,Ar-NH2和少量KI共存时,HNO2会先与Ar-NH2完全反应后,再氧化KI。滴定时用KI-淀粉糊剂作指示剂,滴定终点时淀粉糊剂显_______ 色。
③用该法测定含 Ar-NH2(Mr=173)药物样品的纯度,每次取0.400g样品,用0.100mol/L NaNO2标准溶液进行滴定,实验结果如下:
则该样品中对氨基苯磺酸的纯度是__________ 。
第二次实验数据出现异常,造成这种异常的原因可能是________ (填代号)。
a.锥形瓶洗净后未干燥
b.滴定终点时俯视读数
c.装标准溶液的滴定管未用标准溶液润洗
(4)已知298K时,H2CO3的Ka1=4.2×10-7、Ka2=5.61×10-11。将浓度均为0.1mol/L的Na2CO3及 HNO2溶液等体积混合,溶液中阴离子浓度由大到小的顺序为_______ 。
(1)常温下,0.1 mol/L的NaNO2溶液呈
(2)0.1 mol/LNaNO2溶液中部分微粒组分及浓度如图所示,X表示的是

(3)NaNO2用于测药物中对氨基苯磺酸(Ar-NH2)的含量。测定原理为:酸性环境中,NaNO2先转化为HNO2:HX + NaNO2 = HNO2 + NaX,HNO2再与Ar-NH2以物质的量比1:1发生反应。
①下列酸中,能作为HX来使用的是
A.醋酸(Ka=1.8×10-5) B.盐酸 C.次氯酸(Ka=4.0×10-8)
②反应体系中,Ar-NH2和少量KI共存时,HNO2会先与Ar-NH2完全反应后,再氧化KI。滴定时用KI-淀粉糊剂作指示剂,滴定终点时淀粉糊剂显
③用该法测定含 Ar-NH2(Mr=173)药物样品的纯度,每次取0.400g样品,用0.100mol/L NaNO2标准溶液进行滴定,实验结果如下:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗NaNO2溶液体积/mL | 20.12 | 20.90 | 20.00 | 19.88 |
第二次实验数据出现异常,造成这种异常的原因可能是
a.锥形瓶洗净后未干燥
b.滴定终点时俯视读数
c.装标准溶液的滴定管未用标准溶液润洗
(4)已知298K时,H2CO3的Ka1=4.2×10-7、Ka2=5.61×10-11。将浓度均为0.1mol/L的Na2CO3及 HNO2溶液等体积混合,溶液中阴离子浓度由大到小的顺序为
更新时间:2022-11-27 09:45:22
|
相似题推荐
【推荐1】医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。回答下列问题:
( ) H++( ) MnO4-+( ) H2C2O4→( ) CO2↑+ ( ) Mn2++( ) ____
(1)配平以上离子方程式,并在横线中填上所需的微粒。
(2)该反应中的还原剂是_____________ (填化学式)。
(3)反应转移了0.4 mol电子,则消耗KMnO4的物质的量为_________ mol。
(4)测定血钙含量的方法是:取2.0mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是__________________________ 。
②溶解沉淀时______ (填“能”或“不能”)用稀盐酸,原因是________________ 。
③若消耗了1.0×10-4 mol·L-1的KMnO4溶液20.00 mL,则100 mL该血液中含钙_____ g。
(5)草酸系统命名为乙二酸,请写出乙二酸的结构简式_____________________ 。
(6)已知:Ka1(H2C2O4)=5.9×10—2,Ka2(H2C2O4)=6.4×10—5;Ka(HF)=3.53×10—4,请写出足量草酸(H2C2O4)与NaF溶液反应的化学方程式:______ 。
(1)配平以上离子方程式,并在横线中填上所需的微粒。
(2)该反应中的还原剂是
(3)反应转移了0.4 mol电子,则消耗KMnO4的物质的量为
(4)测定血钙含量的方法是:取2.0mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是
②溶解沉淀时
③若消耗了1.0×10-4 mol·L-1的KMnO4溶液20.00 mL,则100 mL该血液中含钙
(5)草酸系统命名为乙二酸,请写出乙二酸的结构简式
(6)已知:Ka1(H2C2O4)=5.9×10—2,Ka2(H2C2O4)=6.4×10—5;Ka(HF)=3.53×10—4,请写出足量草酸(H2C2O4)与NaF溶液反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】常温时,根据下列要求填空:
(1)书写下列物质在水溶液中的电离方程式:
NaHSO4___________ 、NaHCO3___________ 。
(2)pH=12的NaOH溶液100mL,要使它的pH为11(体积变化忽略不计)。
①如果加入蒸馏水,应加___________ mL;
②如果加入pH=10的NaOH溶液,应加___________ mL;
(3)有pH=1的①盐酸、②硫酸、③醋酸。
①设三种溶液的物质的量浓度分别为a、b、c,则其大小关系为___________ 。
②同体积的三种溶液与足量的NaOH溶液反应生成盐的物质的量分别为a、b、c,则其大小关系为___________ 。
③完全中和物质的量浓度和体积都相同的NaOH溶液时,需三种酸溶液的体积分别为a、b、c,则其大小关系为___________ 。
(1)书写下列物质在水溶液中的电离方程式:
NaHSO4
(2)pH=12的NaOH溶液100mL,要使它的pH为11(体积变化忽略不计)。
①如果加入蒸馏水,应加
②如果加入pH=10的NaOH溶液,应加
(3)有pH=1的①盐酸、②硫酸、③醋酸。
①设三种溶液的物质的量浓度分别为a、b、c,则其大小关系为
②同体积的三种溶液与足量的NaOH溶液反应生成盐的物质的量分别为a、b、c,则其大小关系为
③完全中和物质的量浓度和体积都相同的NaOH溶液时,需三种酸溶液的体积分别为a、b、c,则其大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】回答下列问题
(1)部分弱酸的电离平衡常数如下表:
①在相同浓度的HCOOH和HClO的溶液中,溶液导电能力:HCOOH______ HClO(用“>”“<”或“=”填空)
② 的电离平衡常数表达式为
的电离平衡常数表达式为______ 。
③将少量CO2气体通入NaClO溶液中,写出该反应离子方程式______ 。
(2)已知室温时,某一元碱0.1 mol∙L-1BOH在水中有0.1%发生电离,回答下列问题:
此BOH溶液的pH=______ ;由水电离出来的c(H+)=______ mol∙L-1。
(3)某温度,纯水中c(H+)=3×10-7mol∙L-1,此时在水加入稀硫酸至c(H+)为1×10-3 mol∙L-1,则此时溶液中的c(OH-)=______ mol∙L-1。
(1)部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | H2CO3 | HClO |
电离平衡常数/25℃ | K=1.77×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3×10-8 |
②
 的电离平衡常数表达式为
的电离平衡常数表达式为③将少量CO2气体通入NaClO溶液中,写出该反应离子方程式
(2)已知室温时,某一元碱0.1 mol∙L-1BOH在水中有0.1%发生电离,回答下列问题:
此BOH溶液的pH=
(3)某温度,纯水中c(H+)=3×10-7mol∙L-1,此时在水加入稀硫酸至c(H+)为1×10-3 mol∙L-1,则此时溶液中的c(OH-)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可除烟气中的SO2
(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是:_______ 。
(2)吸收液吸收SO2的过程中,pH随n( ):n(
):n( )变化关系如表:
)变化关系如表:
①表中判断NaHSO3溶液显_______ 性,用化学平衡原理解释:_______ ;NaHSO3溶液中,c( )
)_______ c(H2SO3)(填“>”“<”或“=”)。
②当吸收液呈中性时,溶液中离子浓度关系正确的是_______ (选填字母)。
a.c(Na+)=2c( )+c(
)+c( )
)
b. c(Na+)>c( )>c(
)>c( )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.2c(Na+)=3c( )+3c(
)+3c( )+3c(H2SO3)
)+3c(H2SO3)
(3)蒸干灼烧吸收液,最终获得的固体是_______ (填化学式)。
(4)用蒸馏水稀释0.01mol/L Na2SO3溶液时,下列呈减小趋势的是_______ 。(填字母)
A. B.
B. C.
C. 的水解程度 D.溶液中c(H+)和c(OH-)的乘积 E.溶液中c(
的水解程度 D.溶液中c(H+)和c(OH-)的乘积 E.溶液中c( ) 和c(H2SO3)的乘积
) 和c(H2SO3)的乘积
(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是:
(2)吸收液吸收SO2的过程中,pH随n(
 ):n(
):n( )变化关系如表:
)变化关系如表:n( ):n( ):n( ) ) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
 )
)②当吸收液呈中性时,溶液中离子浓度关系正确的是
a.c(Na+)=2c(
 )+c(
)+c( )
) b. c(Na+)>c(
 )>c(
)>c( )>c(H+)=c(OH-)
)>c(H+)=c(OH-)c.2c(Na+)=3c(
 )+3c(
)+3c( )+3c(H2SO3)
)+3c(H2SO3)(3)蒸干灼烧吸收液,最终获得的固体是
(4)用蒸馏水稀释0.01mol/L Na2SO3溶液时,下列呈减小趋势的是
A.
 B.
B. C.
C. 的水解程度 D.溶液中c(H+)和c(OH-)的乘积 E.溶液中c(
的水解程度 D.溶液中c(H+)和c(OH-)的乘积 E.溶液中c( ) 和c(H2SO3)的乘积
) 和c(H2SO3)的乘积
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】亚硫酸盐与硫酸盐在工农业生产、生活中具有广泛应用。
(1) 溶液呈酸性,在
溶液呈酸性,在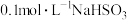 溶液中,下列关系不正确的
溶液中,下列关系不正确的_______ (填字母)。
a.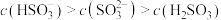
b.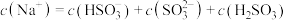
c.
d.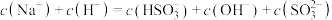
(2)已知: ,
,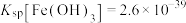 ,
, 时
时 开始沉淀,室温下,除去
开始沉淀,室温下,除去 溶液中的
溶液中的 ,
, (使其浓度均小于
(使其浓度均小于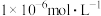 ),需调节溶液pH的范围为
),需调节溶液pH的范围为_______ 。
(3)如图是某温度下,将足量的 固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入
固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入 使
使 增大过程中,溶液中
增大过程中,溶液中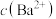 和
和 的变化曲线,根据图中的数据分析、计算。
的变化曲线,根据图中的数据分析、计算。
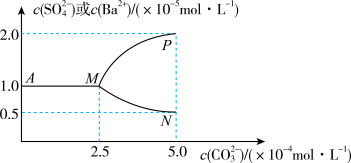
①该温度下, 的
的
_______ 。
②当 大于
大于_______  时开始有
时开始有 沉淀生成。
沉淀生成。
③图像中代表沉淀转化过程中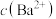 随
随 变化的曲线是
变化的曲线是_______ (填“MP”或“MN”);沉淀转化的离子方程式为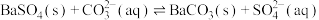 ,该反应的平衡常数
,该反应的平衡常数
_______ 。
(1)
 溶液呈酸性,在
溶液呈酸性,在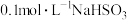 溶液中,下列关系不正确的
溶液中,下列关系不正确的a.
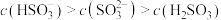
b.
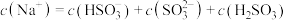
c.

d.
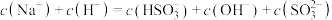
(2)已知:
 ,
,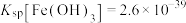 ,
, 时
时 开始沉淀,室温下,除去
开始沉淀,室温下,除去 溶液中的
溶液中的 ,
, (使其浓度均小于
(使其浓度均小于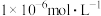 ),需调节溶液pH的范围为
),需调节溶液pH的范围为(3)如图是某温度下,将足量的
 固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入
固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入 使
使 增大过程中,溶液中
增大过程中,溶液中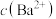 和
和 的变化曲线,根据图中的数据分析、计算。
的变化曲线,根据图中的数据分析、计算。
①该温度下,
 的
的
②当
 大于
大于 时开始有
时开始有 沉淀生成。
沉淀生成。③图像中代表沉淀转化过程中
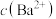 随
随 变化的曲线是
变化的曲线是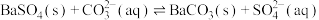 ,该反应的平衡常数
,该反应的平衡常数
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1 L溶液。
(1)该溶液中存在的平衡体系有(用离子反应方程式表示)。
__________ ,_________ ,_________ 。
(2)溶液中共有________ 种不同的粒子。
(3)这些粒子中浓度为0.01 mol·L-1的是________ ,浓度为0.002 mol·L-1的是________ (填离子符号)。
(4)________ 和________ 两种粒子的物质的量之和比OH-的物质的量多0.008 mol。
Ⅱ.(5)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________ 。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的________ 。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(1)该溶液中存在的平衡体系有(用离子反应方程式表示)。
(2)溶液中共有
(3)这些粒子中浓度为0.01 mol·L-1的是
(4)
Ⅱ.(5)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】NH4Al(SO4)2、NH4HSO4在医药、电子工业中用途广泛。请回答下列问题:
(1)常温时,0.1mol·L-1NH4Al(SO4)2溶液的pH=3。
①该溶液中KW=___________ ,由水电离出的c(H+)=___________ mol·L-1。
②该溶液中,c( )+c(NH3·H2O)
)+c(NH3·H2O)___________ (填“>”“=”或“<”)0.1mol·L-1;
(2)常温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示。

①向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为___________ 。
②图中a、b、c、d点中水的电离程度最小的是___________ 。
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是___________ 。
(1)常温时,0.1mol·L-1NH4Al(SO4)2溶液的pH=3。
①该溶液中KW=
②该溶液中,c(
 )+c(NH3·H2O)
)+c(NH3·H2O)(2)常温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示。

①向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
②图中a、b、c、d点中水的电离程度最小的是
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】电解质在水中可能存在电离平衡、水解平衡和溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在____ 种微粒,溶液中的电荷守恒关系式为___________ 。
(2)常温下,物质的量浓度均为0.1mol/L的六种溶液:①NH4NO3②NaCl③Na2CO3④H2SO4⑤NaOH⑥CH3COONa,pH从大到小排列顺序为_________ 。(填序号)
(3)在实验室中配制CH3COONa溶液时,常先将CH3COONa固体溶于较浓的_________ 溶液中,然后用蒸馏水稀释到所需的浓度以抑制其水解。
(4)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方式与氨相似,写出在水中联氨第一步电离反应的方程式_________ 。
(5)在验证牺牲阳极的阴极保护法的实验中,通常用黄色的铁氰化钾溶液来检验Fe2+的存在,请写出该检验反应的离子方程式_____________ ;
(6)碳酸钙是一种难溶物质(Ksp=2.8×10-9)。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的Na2CO3溶液与CaCl2 溶液混合,若Na2CO3 溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______ 。
(1)NaHCO3溶液中共存在
(2)常温下,物质的量浓度均为0.1mol/L的六种溶液:①NH4NO3②NaCl③Na2CO3④H2SO4⑤NaOH⑥CH3COONa,pH从大到小排列顺序为
(3)在实验室中配制CH3COONa溶液时,常先将CH3COONa固体溶于较浓的
(4)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方式与氨相似,写出在水中联氨第一步电离反应的方程式
(5)在验证牺牲阳极的阴极保护法的实验中,通常用黄色的铁氰化钾溶液来检验Fe2+的存在,请写出该检验反应的离子方程式
(6)碳酸钙是一种难溶物质(Ksp=2.8×10-9)。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的Na2CO3溶液与CaCl2 溶液混合,若Na2CO3 溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

(1)写出H2N2O2在水溶液中的电离方程式:___________ 。
(2)c点时溶液中各离子浓度由大到小的顺序为___________ 。
(3)b点时溶液中c(H2N2O2)___________ c(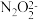 )。(填“>”“<”或“=”,下同)
)。(填“>”“<”或“=”,下同)
(4)a点时溶液中c(Na+)___________ c(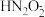 )+c(
)+c(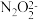 )。
)。
(5)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中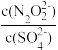 =
=___________ 。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]。
常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

(1)写出H2N2O2在水溶液中的电离方程式:
(2)c点时溶液中各离子浓度由大到小的顺序为
(3)b点时溶液中c(H2N2O2)
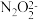 )。(填“>”“<”或“=”,下同)
)。(填“>”“<”或“=”,下同)(4)a点时溶液中c(Na+)
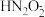 )+c(
)+c(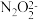 )。
)。(5)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中
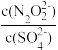 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
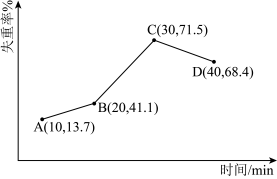
【推荐1】采用热重分析法测定NiSO4·nH2O样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如下图,A点时失掉2个结晶水,n的值为_______ ;C点产物的化学式为_______ 。

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】“恒重”操作的目的是_________________________________________________ ;
判断“恒重”的依据是_________________________________________________ 。
判断“恒重”的依据是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】CuSO4溶液与K2C2O4溶液反应,得到一种蓝色晶体。通过下述实验确定该晶体的组成:
(a)称取0.2073g样品,放入锥形瓶,加入40mL2mol·L-1的H2SO4,微热使样品溶解。加入30mL水,加热至近沸,用0.02054mol·L-1KMnO4溶液滴定至终点,消耗24.18mL。
(b)接着将溶液充分加热,使淡紫红色变为蓝色。冷却后加入2gKI固体和适量Na2CO3,溶液变为棕色主生成沉淀。用0.04826mol·L-1的Na2S2O3溶液滴定,近终点时加入淀粉指示剂,至终点,消耗12.69mL。
(1)写出步骤a中滴定反应的方程式_______ 。
(2)写出步骤b中溶液由淡紫红色变为蓝色的过程中所发生反应的方程式________ 。
(3)用反应方程式表达KI在步骤b中的作用______ ;写出Na2S2O3滴定反应的方程式______ 。
(4)通过计算写出蓝色晶体的化学式(原子数取整数)_______ 。
(a)称取0.2073g样品,放入锥形瓶,加入40mL2mol·L-1的H2SO4,微热使样品溶解。加入30mL水,加热至近沸,用0.02054mol·L-1KMnO4溶液滴定至终点,消耗24.18mL。
(b)接着将溶液充分加热,使淡紫红色变为蓝色。冷却后加入2gKI固体和适量Na2CO3,溶液变为棕色主生成沉淀。用0.04826mol·L-1的Na2S2O3溶液滴定,近终点时加入淀粉指示剂,至终点,消耗12.69mL。
(1)写出步骤a中滴定反应的方程式
(2)写出步骤b中溶液由淡紫红色变为蓝色的过程中所发生反应的方程式
(3)用反应方程式表达KI在步骤b中的作用
(4)通过计算写出蓝色晶体的化学式(原子数取整数)
您最近一年使用:0次



