名校
解题方法
1 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
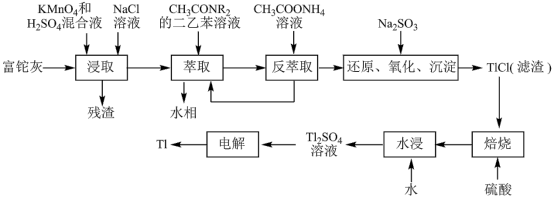
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)在实验室中,“萃取”过程使用的玻璃仪器有_______ ,用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)在实验室中,“萃取”过程使用的玻璃仪器有
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为

您最近一年使用:0次
2022-04-10更新
|
765次组卷
|
2卷引用:江西省八所重点中学2022届高三联考理科综合化学试题
名校
解题方法
2 . 碱式氯化铜 [Cum(OH)xCly]为绿色或墨绿色的结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持置已省略)。

(1)实验室利用装置B制备NH3,圆底烧瓶中盛放的固体药品可能是_______ (填名称);仪器b的作用是_______ 。
(2)反应过程中,在装置A中除观察到溶液蓝绿色褪去外,还可能观察到的现象是_______ 。
(3)若滴入稀盐酸过量会导致碱式氯化铜的产量_______ (填“偏高”、“偏低”或“无影响”)。
(4)反应结束后,将装置A 中反应容器内的混合物过滤,滤渣经提纯得产品无水碱式氯化铜;从滤液中还可以获得的一种副产品,该副产品的用途是_______ (写出一种即可)。
Ⅱ.无水碱式氯化铜组成的测定。称取产品12.87 g,加稀硝酸溶解,并加水定容至500 mL,得到待测液。
(5)铜的测定:取50mL待测液,加入足量的氢氧化钠,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为1.176g。则称取的样品中n(Cu2+)为_______ mol。
(6)采用沉淀滴定法测定氯,步骤如下:
a.准确量取25.00mL待测液于锥形瓶中,加入20ml 0.2 mol/L AgNO3溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂NH4Fe(SO4)2,用NH4SCN标准溶液滴定过量的AgNO3溶液;
d.重复实验操作三次,消耗0.1 mol/L NH4SCN溶液的体积平均为10.00 mL。
已知Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12
其中加入硝基苯的作用是_______ 。
(7)根据上述实验结果可推知该碱式氯化铜的化学式为_______ 。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持置已省略)。

(1)实验室利用装置B制备NH3,圆底烧瓶中盛放的固体药品可能是
(2)反应过程中,在装置A中除观察到溶液蓝绿色褪去外,还可能观察到的现象是
(3)若滴入稀盐酸过量会导致碱式氯化铜的产量
(4)反应结束后,将装置A 中反应容器内的混合物过滤,滤渣经提纯得产品无水碱式氯化铜;从滤液中还可以获得的一种副产品,该副产品的用途是
Ⅱ.无水碱式氯化铜组成的测定。称取产品12.87 g,加稀硝酸溶解,并加水定容至500 mL,得到待测液。
(5)铜的测定:取50mL待测液,加入足量的氢氧化钠,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为1.176g。则称取的样品中n(Cu2+)为
(6)采用沉淀滴定法测定氯,步骤如下:
a.准确量取25.00mL待测液于锥形瓶中,加入20ml 0.2 mol/L AgNO3溶液,充分反应;
b.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
c.加入指示剂NH4Fe(SO4)2,用NH4SCN标准溶液滴定过量的AgNO3溶液;
d.重复实验操作三次,消耗0.1 mol/L NH4SCN溶液的体积平均为10.00 mL。
已知Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12
其中加入硝基苯的作用是
(7)根据上述实验结果可推知该碱式氯化铜的化学式为
您最近一年使用:0次
3 . 银及其化合物在制造钱币、电子工业、医药等方面具有广泛用途。
Ⅰ.银的冶炼及性质
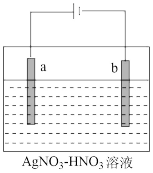
(1)热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为__ 。
(2)电解精炼银的工作原理如图所示,___ (填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为___ 。
Ⅱ.银的化合物的性质
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式__ 。
(4)在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物。称取34g AgNO3固体,充分光照使其完全分解,测得反应后生成O2的体积(折合成标准状况)为2.24L,反应过程中转移电子的物质的量为__ 。
(5)纳米硫化(Ag2S)应用广泛。Ag2S溶于浓HNO3后,产生淡黄色固体及无色气体,该气体遇空气迅速变为红棕色。写出反应的化学方程式__ 。
Ⅰ.银的冶炼及性质
(1)热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为
(2)电解精炼银的工作原理如图所示,

Ⅱ.银的化合物的性质
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式
(4)在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物。称取34g AgNO3固体,充分光照使其完全分解,测得反应后生成O2的体积(折合成标准状况)为2.24L,反应过程中转移电子的物质的量为
(5)纳米硫化(Ag2S)应用广泛。Ag2S溶于浓HNO3后,产生淡黄色固体及无色气体,该气体遇空气迅速变为红棕色。写出反应的化学方程式
您最近一年使用:0次
2021-05-03更新
|
598次组卷
|
4卷引用:北京市丰台区2021届高三第二次模拟考试化学试题
北京市丰台区2021届高三第二次模拟考试化学试题(已下线)第二章能力提升检测卷-2022年高考化学一轮复习讲练测(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)北京市第三中学2021-2022学年高三上学期期中考试化学试题
4 . 亚磷酸钠(Na2HPO3)用途广泛,也是一种性价比高的催化剂。“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图如下:

“合成”过程中主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为:NaH2PO2+I2+H2O=H3PO3+NaI+HI。
已知:亚磷酸(H3PO3)为二元酸,其电离常数K1=3.7×l0-2,K2=2.9×l0-7;180℃分解为PH3和磷酸。请回答:
(1)“除铅”过程中,用FeS固体除去微量Pb2+的离子方程式为_______ 。
(2)采取减压蒸馏的原因是_______ 。
(3)“减压蒸馏”过程,I-的回收率为95%,则剩余固体的主要成分为_______ (填化学式),发生反应的化学方程式为_______ 。
(4)“调pH=11”的作用有两个,一是将Fe3+转化为Fe(OH)3沉淀,二是_______ 。
(5)工业上常用电解法制备亚磷酸,其装置示意图如下。

①b为电源的_______ (填“正极”或“负极”)。
②A膜应选择_______ (填“阴离子”或“阳离子”)交换膜。
③阴极的电极反应式为_______ 。

“合成”过程中主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为:NaH2PO2+I2+H2O=H3PO3+NaI+HI。
已知:亚磷酸(H3PO3)为二元酸,其电离常数K1=3.7×l0-2,K2=2.9×l0-7;180℃分解为PH3和磷酸。请回答:
(1)“除铅”过程中,用FeS固体除去微量Pb2+的离子方程式为
(2)采取减压蒸馏的原因是
(3)“减压蒸馏”过程,I-的回收率为95%,则剩余固体的主要成分为
(4)“调pH=11”的作用有两个,一是将Fe3+转化为Fe(OH)3沉淀,二是
(5)工业上常用电解法制备亚磷酸,其装置示意图如下。

①b为电源的
②A膜应选择
③阴极的电极反应式为
您最近一年使用:0次
2021-03-13更新
|
459次组卷
|
2卷引用:广东省韶关市2021届高三综合测试化学试题
5 . 硫化物是一类重要的化工原料,具有广泛的用途。完成下列填空:
(1)Na2S溶液中,水的电离程度会______ (填“增大”“减小”或“不变”);微热该溶液,pH会_____ (填“增大”“减小”或“不变”)。
(2)Na2S溶液中各离子浓度由大到小的顺序为:_____________________________ 。
(3)向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,发生下反应:_____ Na2S+_____ Na2SO3+_____ H2SO4→_____ Na2SO4+_____ S +
+_____ H2O
(4)配平上述化学方程式,标出电子转移的方向和数目__________ 。反应中被氧化的元素是____________ 。
(5)CuS和FeS都是难溶于水的固体,工业上可用FeS将废水中的Cu2+转化为CuS除去,请结合相关原理进行解释:________________________________________________________________________ 。
(1)Na2S溶液中,水的电离程度会
(2)Na2S溶液中各离子浓度由大到小的顺序为:
(3)向Na2S和Na2SO3的混合溶液中加入足量的稀硫酸溶液,发生下反应:
 +
+(4)配平上述化学方程式,标出电子转移的方向和数目
(5)CuS和FeS都是难溶于水的固体,工业上可用FeS将废水中的Cu2+转化为CuS除去,请结合相关原理进行解释:
您最近一年使用:0次
2017-12-26更新
|
535次组卷
|
3卷引用:上海市虹口区2018届高三上学期教学质量监控测试化学试题
上海市虹口区2018届高三上学期教学质量监控测试化学试题(已下线)学科网2019年高考化学一轮复习讲练测2.4 氧化还原反应的规律及应用 练上海市罗店中学2018-2019学年高二第二学期期中考试化学试题



