1 . 往锅炉注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述中正确的是
| A.温度升高,Na2CO3溶液的Kw和c(H+)均会增大 |
| B.CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4) |
| C.CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸 |
D.沉淀转化的离子方程式为 (aq)+CaSO4(s)⇌CaCO3(s)+ (aq)+CaSO4(s)⇌CaCO3(s)+ (aq) (aq) |
您最近一年使用:0次
2022-07-10更新
|
582次组卷
|
20卷引用:福建省龙海市第二中学2019届高三上学期第二次月考化学试题
福建省龙海市第二中学2019届高三上学期第二次月考化学试题湖南省怀化市2018届高三上学期期末教育质量监测化学试题湖南省怀化市2018届高三上学期期末统一考试化学试题(已下线)专题8.4 难溶电解质的溶解平衡(讲)-《2020年高考一轮复习讲练测》(已下线)第28讲 难溶电解质的溶解平衡 (精讲)——2021年高考化学一轮复习讲练测(已下线)小题必刷34 沉淀溶解平衡、溶度积常数及其应用——2021年高考化学一轮复习小题必刷(通用版本)陕西省西安中学2019-2020学年高二上学期期末考试化学试题湖南省怀化市辰溪县辰溪县第一中学2019-2020学年高二12月月考化学试题新疆维吾尔自治区伊犁哈萨克自治州奎屯市第一高级中学2019-2020学年高二期末考试试题山西省晋中市祁县中学校2019-2020学年高二11月月考化学试题(已下线)练习7 水解平衡与溶解平衡-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)(已下线)专题11 水溶液中的离子平衡-备战2021届高考化学二轮复习题型专练(已下线)第26讲 难溶电解质的溶解平衡(精讲)-2022年一轮复习讲练测(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第26讲 难溶电解质的溶解平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第22讲 沉淀溶解平衡的应用(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)第2课时 沉淀溶解平衡的应用【定心卷】3.4.2 沉淀溶解平衡的应用随堂练习-人教版2023-2024学年选择性必修1
名校
2 . 下列指定反应的离子方程式正确的是
A.饱和Na2CO3溶液与CaSO4固体反应:CO +CaSO4 +CaSO4  CaCO3+SO CaCO3+SO |
B.酸化NaIO3和NaI的混合溶液:I− +IO +6H+ =I2+3H2O +6H+ =I2+3H2O |
| C.向FeBr2溶液中通入足量氯气:2Fe2++2Br−+2Cl2 =2Fe3++Br2+4Cl− |
| D.氯气通入氢硫酸中产生黄色沉淀:Cl2 + S2− =2Cl−+ S↓ |
您最近一年使用:0次
2021-10-13更新
|
446次组卷
|
2卷引用:福建省宁化第一中学2021-2022学年高三上学期第一次阶段考试化学试题
3 . 25℃时,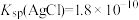 ,
,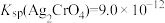 ,下列说法正确的是
,下列说法正确的是
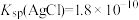 ,
,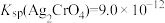 ,下列说法正确的是
,下列说法正确的是A.AgCl和 共存的悬浊液中, 共存的悬浊液中,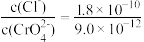 |
B.向 悬浊液中加入NaCl浓溶液, 悬浊液中加入NaCl浓溶液, 不可能转化为AgCl 不可能转化为AgCl |
C.向AgCl饱和溶液中加入NaCl固体,有AgCl析出且溶液中 |
D.向浓度均为0.1mol/L的 和NaCl混合溶液中滴加 和NaCl混合溶液中滴加 溶液,AgCl先析出 溶液,AgCl先析出 |
您最近一年使用:0次
2021-08-07更新
|
504次组卷
|
11卷引用:福建省莆田第六中学2020届高三上学期期中考试化学试题
福建省莆田第六中学2020届高三上学期期中考试化学试题福建省三明第一中学2020届高三上学期第二次月考化学试题山西省太原市2018届高三上学期期末考试化学试题2020届高三化学一轮复习 溶度积常数及溶解平衡常数的分析河北省石家庄市辛集市第一中学2019-2020学年高二第二次考试(二)化学试题课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)第3章 水溶液中的离子反应与平衡(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)湖南省株洲市攸县第二中学2022-2023学年高二上学期期中考试化学试题湖南省隆回县第二中学2022-2023学年高二上学期线上课程摸底(期中)考试化学试题3.4.2沉淀溶解平衡原理的应用 课后
名校
4 . 下列实验操作中,对应的现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向较浓的FeCl2溶液中滴入少量酸性KMnO4溶液 | KMnO4溶液紫色褪去 | Fe2+有还原性 |
| B | 分别向两支试管中加入同浓度、同体积的草酸溶液,再分别加入同体积、不同浓度的酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色时间不同 | 浓度不同反应速率不同 |
| C | 用pH试纸分别测定等浓度的NaClO和NaHCO3的pH值 | pH:NaClO>NaHCO3 | 酸性:H2CO3>HClO |
| D | 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-03-01更新
|
528次组卷
|
7卷引用:福建省福州第一中学2020届高三第二次测试理综化学试题
福建省福州第一中学2020届高三第二次测试理综化学试题(已下线)重点2 表格逻辑型实验方案的设计与评价-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点35 化学实验方案的设计与评价-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向35 实验的方案设计与评价-备战2022年高考化学一轮复习考点微专题广东省广州市中山大学附属中学2021届高三下学期3月月考化学试题新疆乌鲁木齐市高级中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
5 . 以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取Na2CrO4晶体的工艺流程如下:
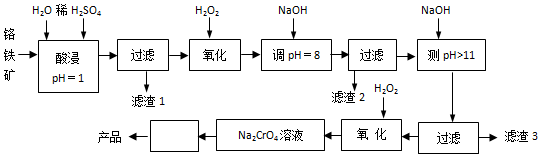
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO形式存在且易氧化;②常温下部分阳离子以氢氧化物形式沉淀时溶液pH如下:
(1)滤渣1主要成分是__________________ 。
(2)写出流程中第1次使用H2O2时,发生反应的离子方程式__________________ 。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?___________ 。
(4)写出第2次使用H2O2时,发生反应的离子方程式___________ 。
(5)流程图中从Na2CrO4溶液至产品中间“□”内的操作是__________ 、__________ 过滤、洗涤、干燥
(6)当溶液调pH=10时,则溶液中c(Mg2+) 为__________ 。【已知Ksp(Mg(OH)2)=5.6×10-12】
(7) 在酸性条件下转化为
在酸性条件下转化为 。工业上常用Fe2+处理酸性K2Cr2O7废水,先将
。工业上常用Fe2+处理酸性K2Cr2O7废水,先将 转化为Cr3+,该反应的离子方程式为
转化为Cr3+,该反应的离子方程式为_____________ ,再调节溶液的pH使金属离子生成沉淀而除去。

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO形式存在且易氧化;②常温下部分阳离子以氢氧化物形式沉淀时溶液pH如下:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | —— | —— |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
(1)滤渣1主要成分是
(2)写出流程中第1次使用H2O2时,发生反应的离子方程式
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?
(4)写出第2次使用H2O2时,发生反应的离子方程式
(5)流程图中从Na2CrO4溶液至产品中间“□”内的操作是
(6)当溶液调pH=10时,则溶液中c(Mg2+) 为
(7)
 在酸性条件下转化为
在酸性条件下转化为 。工业上常用Fe2+处理酸性K2Cr2O7废水,先将
。工业上常用Fe2+处理酸性K2Cr2O7废水,先将 转化为Cr3+,该反应的离子方程式为
转化为Cr3+,该反应的离子方程式为
您最近一年使用:0次
2020-12-27更新
|
142次组卷
|
2卷引用:福建省莆田第十五中学2019届高三上学期期中考试化学试题
13-14高三上·湖北黄冈·期末
名校
解题方法
6 . 化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
 CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达到平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K=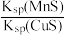 |
您最近一年使用:0次
2020-12-16更新
|
902次组卷
|
38卷引用:福建省福州市长乐高级中学2020届高三上学期第一次月考化学试题
福建省福州市长乐高级中学2020届高三上学期第一次月考化学试题(已下线)2013届湖北省黄冈市高三上学期期末考试理综化学试卷(已下线)2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(已下线)2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化(已下线)2013-2014四川省攀枝花市高三5月模拟考试理综化学试卷(已下线)专题8.4 难溶电解质的溶解平衡(练)-《2020年高考一轮复习讲练测》(已下线)2013-2014学年江西省鹰潭一中高二上学期期中考试化学试卷2015-2016学年河北邯郸魏县一中、曲周县一中高二上期中化学试卷辽宁省抚顺市第十九中学2016-2017学年高二上学期期中考试化学试题内蒙古集宁一中西校区2017-2018学年高二上学期期中考试化学试题陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(基础卷)试题(已下线)2019年11月19日《每日一题》高二化学人教版(选修4)—— 沉淀溶解平衡在物质分离中的应用山西省朔州市怀仁一中2019-2020学年高二上学期第四次月考化学试题河北省邯郸市大名县第一中学2019-2020学年高二上学期12月月考化学试题(普通班)四川省广元川师大万达中学2019-2020学年高二上学期期末教学质量检测化学试题云南省丽江市华坪县第一中学2019—2020学年高二上学期期末考试化学试题辽宁省抚顺市六校协作体2019-2020学年高二上学期期末考试化学试题黑龙江省哈尔滨市宾县第一中学2019-2020学年高二上学期期末考试化学试题湖南省长沙市雨花区2019-2020学年高二上学期期末考试化学(选考)试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高二上学期期中考试化学试题重庆市万州纯阳中学2020-2021学年高二上学期期中考试化学试题陕西省宝鸡市宝鸡中学2020-2021学年高二上学期阶段考试(一)化学试题四川省成都市郫都区川科外国语学校2020-2021学年高二11月月考化学试题黑龙江省哈尔滨市延寿县第二中学2020-2021学年高二11月月考化学试题安徽省怀宁中学2020-2021学年高二上学期第二次质量检测(普通班)化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)专题27 难溶电解质的溶解平衡(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第5讲 难溶电解质的溶解平衡陕西省榆林市第十二中学2020-2021学年高二下学期第一次月考化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题云南省永胜县第一中学2020-2021学年高二下学期6月份考试化学试题安徽省蚌埠第三中学2021-2022学年高二下学期开学测试化学试题第四节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用陕西省咸阳市秦都区2021-2022学年高二上学期期末考试化学试题上海市行知中学2022-2023学年高二下学期2月月考化学试题青海省西宁市海湖中学2023-2024学年高二下学期开学考试化学试卷
解题方法
7 . 下列反应的离子方程式表达正确的是
A.Na2CO3溶液处理水垢中的硫酸钙:CaSO4(s)+CO (aq) = CaCO3(s)+SO (aq) = CaCO3(s)+SO (aq) (aq) |
| B.Fe(OH)3固体溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O |
C.NH4HSO4溶液中滴加少量Ba(OH)2溶液: NH +H++SO +H++SO +Ba2++2OH-=BaSO4↓+NH3·H2O+H2O +Ba2++2OH-=BaSO4↓+NH3·H2O+H2O |
D.0.8 mol·L−1 NaHSO4 与 0.4 mol·L−1 Ba(OH)2 溶液等体积混合: 2H+ + SO + Ba2+ + 2OH-= BaSO4 ↓ + 2H2O + Ba2+ + 2OH-= BaSO4 ↓ + 2H2O |
您最近一年使用:0次
名校
8 . 下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 溶液中加入HCl无现象,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中有SO |
| B | Agl沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比Agl更难溶 |
| C | 向CH3CH2X中加入少量AgNO3溶液,加热 | 有浅黄色沉淀生成 | CH3CH2X中含有Br- |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热, | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 卤块的主要成分是MgCl2,此外还含铁的氯化物、CuCl2、SiO2、MnO2等杂质。工业上以卤块为原料可制得轻质氧化镁(轻质:疏松粉末状、体积蓬松,重质:颗粒状、体积紧密),工艺流程如图所示:

已知:生成氢氧化物沉淀的pH如表所示
请回答下列问题:
(1)滤渣1的成分有___________ (填化学式)。
(2)步骤“加NaOH”需要调节pH值的范围为_______ 。
(3)沉淀1的成分为____ (填化学式),步骤“加水煮沸”发生反应的化学方程式为__________ 。
(4)步骤“加水煮沸”不能时间太长,原因是____________ 。
(5)最近研究表明,常温下在含有Mg2+浓度为1.5mol/L的溶液中加入2倍于Mg2+的物质的量的NH4HCO3,控制pH值在9.5左右,镁的沉淀率能达到99%,产物为一种含结晶水的复盐,可用于煅烧制取轻质氧化镁,经XDR(X射线衍射)分析该复盐含水与含镁的物质的量相等。写出制取该复盐的离子方程式:___________ 。

已知:生成氢氧化物沉淀的pH如表所示
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.9 | 7.6 | 6.0 | 7.3 | 9.1 |
| 沉淀完全 | 3.2 | 9.6 | 8.0 | 9.3 | 11.1 |
请回答下列问题:
(1)滤渣1的成分有
(2)步骤“加NaOH”需要调节pH值的范围为
(3)沉淀1的成分为
(4)步骤“加水煮沸”不能时间太长,原因是
(5)最近研究表明,常温下在含有Mg2+浓度为1.5mol/L的溶液中加入2倍于Mg2+的物质的量的NH4HCO3,控制pH值在9.5左右,镁的沉淀率能达到99%,产物为一种含结晶水的复盐,可用于煅烧制取轻质氧化镁,经XDR(X射线衍射)分析该复盐含水与含镁的物质的量相等。写出制取该复盐的离子方程式:
您最近一年使用:0次
名校
10 . 下列实验操作能达到实验目的是
| A.区分碳酸钠溶液和碳酸氢钠溶液,可以各取少量待测液于试管中,滴加澄清石灰水鉴别 |
B.向溶液中加入稀盐酸,若产生无色无味且能使澄清石灰水变浑浊的气体,则说明原溶液中有CO 离子 离子 |
| C.向 2mL1mol•L-1NaOH 溶液中加入2~3 滴 lmol•L-1MgCl2溶液,生成白色沉淀,再加入2~3滴lmol•L-1FeCl3溶液,生成红褐色沉淀,说明Mg(OH)2沉淀可以转化为 Fe(OH)3沉淀 |
| D.配制SnCl2溶液时,先将SnCl2固体溶解于适量的浓盐酸中,再加水稀释到所需要的浓度 |
您最近一年使用:0次
2020-10-15更新
|
103次组卷
|
2卷引用:福建省长泰县第一中学2021届高三上学期11月考试化学试题



