1 . 化学与生活等密切相关,下列说法错误的是
| A.铁质菜刀生锈与氧化还原反应有关 |
| B.明矾溶于水后能形成胶体,可用于净水 |
| C.铵态氮肥与熟石灰混合研磨时有刺激性气味的气体产生 |
| D.利用同位素的放射性可以进行医疗诊断和治疗,所以放射性同位素都是有益的 |
您最近半年使用:0次
2 . 北京冬奥会火种灯的外形设计灵感来自于西汉的“长信宫灯”。下列说法正确的是


| A.青铜的熔点大于纯铜 |
B.铜锈的主要成分是 |
| C.镏金层破损后,金作负极可以继续保护破损处的铜,此法称为牺牲阳极的阴极保护法 |
| D.铝合金表面氧化物薄膜可保护内部金属不被腐蚀 |
您最近半年使用:0次
3 . 下列装置(容器中的液体均足量)中,铁的腐蚀速率最快的是
A.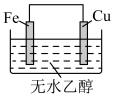 | B.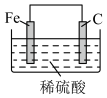 |
C.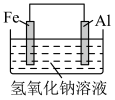 | D.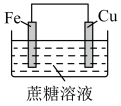 |
您最近半年使用:0次
4 . 在生产、生活中,金属腐蚀会带来严重的经济损失。下列说法正确的是
A.铜腐蚀后生成的铜绿为 |
| B.工业上用石墨作电极电解熔融氧化铝冶炼铝时,阳极需定期更换 |
C.钢铁发生吸氧腐蚀时,负极反应是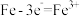 |
| D.防止铁管被腐蚀,可以利用电解池原理的牺牲阳极保护法,铁做阴极被保护 |
您最近半年使用:0次
5 . 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
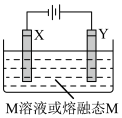

| A.电流由电源正极经导线流向Y极,再经电解质溶液或熔融态电解质流到X极,最后X极经导线流回电源负极 |
| B.铜电解精炼中,X是粗铜,Y是纯铜,M是CuSO4溶液 |
| C.X、Y均为石墨电极,电解熔融氯化铝制备金属铝 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
您最近半年使用:0次
2023-12-11更新
|
94次组卷
|
2卷引用:福建省南平市高级中学2023-2024学年高二上学期期中考试化学试题
名校
6 . 化学是以实验为基础的科学。用下列装置进行实验(夹持装置略)不能达到目的的是
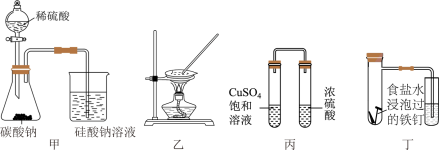

| A.用甲装置证明非金属性:S>C>Si | B.图②装置可由FeCl3•6H2O制取无水FeCl3固体 |
| C.用丙装置验证浓硫酸的吸水性 | D.用丁可模拟钢铁的吸氧腐蚀 |
您最近半年使用:0次
名校
7 . 电化学是化学研究重要分支,在生产生活中发挥着非常重要的作用。请回答下列问题:
(1)某空间站局部能量转化系统如图所示,其中氢氧燃料电池采用KOH溶液为电解液,该燃料电池放电时的负极反应式为___________ 。
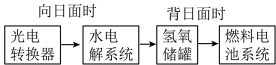
(2)在载人航天器的生态系统中,不仅要求分离出 ,还要求提供充足的
,还要求提供充足的 某种电化学装置可实现转化
某种电化学装置可实现转化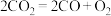 ,CO可用作燃料。已知该反应的阳极反应式为
,CO可用作燃料。已知该反应的阳极反应式为 ,则阴极反应式为:
,则阴极反应式为:___________ 。
(3)铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉;应用广泛。电池总反应为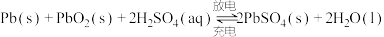 。放电时,正极的电极反应式:
。放电时,正极的电极反应式:___________ ,电解质溶液中硫酸的浓度___________ (填“增大”“减小”或“不变”),当外电路通过 时,理论上负极板的质量增加
时,理论上负极板的质量增加___________ g。
(4)以 燃料电池为电源电解法制取
燃料电池为电源电解法制取 ,二氧化氯(
,二氧化氯( )为一稀黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
)为一稀黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
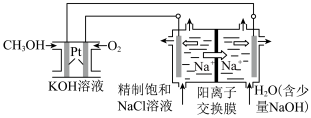
①图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ,阳极产生
,阳极产生 的反应式为
的反应式为___________ 。
②电解一段时间,从阴极处收集到的气体比阳极处收集到气体多1.12L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为___________ mol(精确到小数点后两位)。
(5)下图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是___________。

(1)某空间站局部能量转化系统如图所示,其中氢氧燃料电池采用KOH溶液为电解液,该燃料电池放电时的负极反应式为

(2)在载人航天器的生态系统中,不仅要求分离出
 ,还要求提供充足的
,还要求提供充足的 某种电化学装置可实现转化
某种电化学装置可实现转化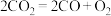 ,CO可用作燃料。已知该反应的阳极反应式为
,CO可用作燃料。已知该反应的阳极反应式为 ,则阴极反应式为:
,则阴极反应式为:(3)铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉;应用广泛。电池总反应为
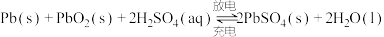 。放电时,正极的电极反应式:
。放电时,正极的电极反应式: 时,理论上负极板的质量增加
时,理论上负极板的质量增加(4)以
 燃料电池为电源电解法制取
燃料电池为电源电解法制取 ,二氧化氯(
,二氧化氯( )为一稀黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
)为一稀黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
①图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取
 ,阳极产生
,阳极产生 的反应式为
的反应式为②电解一段时间,从阴极处收集到的气体比阳极处收集到气体多1.12L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为
(5)下图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是___________。

| A.④>②>③>① | B.②>①>③>④ | C.④>②>①>③ | D.③>②>④>① |
您最近半年使用:0次
名校
解题方法
8 . 请回答下列问题:
(1)高铁酸钾( )不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图所示是高铁电池的模拟实验装置。
)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图所示是高铁电池的模拟实验装置。
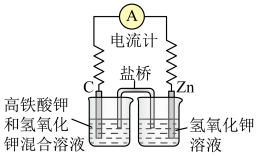
①该电池放电时正极反应式为___________ 。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动;
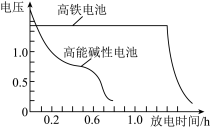
③下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___________ 。
(2)铜是人类最早使用的金属,它与人类生产、生活关系密切,请运用所学知识解释下列与铜有关的化学现象。
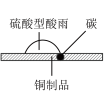
①如图,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生___________ (填“氧化”或“还原”)反应,写出正极的电极反应式:___________ 。
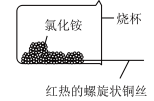
②如下图,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入 固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有
固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有 生成,写出由黑色变为光亮红色过程中反应的化学方程式:
生成,写出由黑色变为光亮红色过程中反应的化学方程式:___________ 。
(3)一定温度下,反应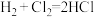 中的某一基元反应为
中的某一基元反应为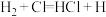 ,其能量变化如图所示。
,其能量变化如图所示。 表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
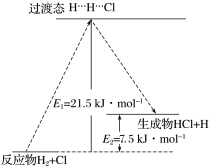
该基元反应的活化能为___________ kJ/mol, 为
为___________ kJ/mol。
(4)键能也可以用于估算化学反应的反应热( )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:
已知白磷的标准燃烧热为-2378kJ/mol,白磷的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中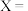
___________ 。
(1)高铁酸钾(
 )不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图所示是高铁电池的模拟实验装置。
)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图所示是高铁电池的模拟实验装置。
①该电池放电时正极反应式为
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向
③下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有

(2)铜是人类最早使用的金属,它与人类生产、生活关系密切,请运用所学知识解释下列与铜有关的化学现象。
①如图,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生

②如下图,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入
 固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有
固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有 生成,写出由黑色变为光亮红色过程中反应的化学方程式:
生成,写出由黑色变为光亮红色过程中反应的化学方程式:
(3)一定温度下,反应
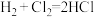 中的某一基元反应为
中的某一基元反应为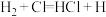 ,其能量变化如图所示。
,其能量变化如图所示。 表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
该基元反应的活化能为
 为
为(4)键能也可以用于估算化学反应的反应热(
 )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:| 化学键 |  |  |  | 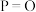 |
| 键能/(kJ/mol) | 172 | 335 | 498 | X |

您最近半年使用:0次
解题方法
9 . 研究金属腐蚀和防腐的原理很有现实意义。
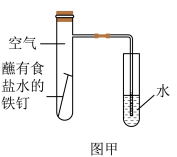
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有_______(填序号)。
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如表,根据数据判断腐蚀的速率随时间逐渐_______ (填“加快”、“不变”、“减慢”),你认为影响因素为_______ 。
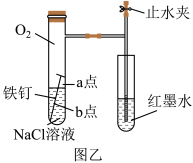
(3)为探究铁钉腐蚀实验a、b两点所发生的反应,进行以下实验,完成表格空白(已知铁氰化钾溶液遇亚铁离子显蓝色,常用于亚铁离子的检验);
根据以上实验探究,试判断③_______ (填“a”或“b”)为负极,该点腐蚀更严重。
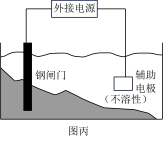
(4)图丙中钢闸门应与外接电源的_______ 相连(填“正极”或“负极”)钢闸门不会被腐蚀,属于_______ 保护法。
(5)金属阳极钝化是另一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,写出该阳极电极反应式是_______ 。
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有_______(填序号)。

| A.用纯氧气代替试管内空气 | B.用酒精灯加热试管提高温度 |
| C.将铁钉换成铁粉和炭粉混合粉末 | D.换成更细的导管,水中滴加红墨水 |
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如表,根据数据判断腐蚀的速率随时间逐渐

| 时间/min | 1 | 3 | 5 | 7 | 9 |
| 液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
(3)为探究铁钉腐蚀实验a、b两点所发生的反应,进行以下实验,完成表格空白(已知铁氰化钾溶液遇亚铁离子显蓝色,常用于亚铁离子的检验);
| 实验操作 | 实验现象 | 实验结论 |
| 向NaCl溶液中滴加2~3滴酚酞指示剂 | a点附近溶液出现红色 | a点电极反应为① |
| 然后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为② |
(4)图丙中钢闸门应与外接电源的

(5)金属阳极钝化是另一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,写出该阳极电极反应式是
您最近半年使用:0次
2023-11-18更新
|
172次组卷
|
2卷引用:福建省漳州市十校2023-2024学年高二上学期期中联考化学试题
名校
解题方法
10 . 某小相同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和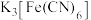 溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知:
溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知: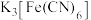 遇到
遇到 能产生蓝色沉淀,对有关实验现象及分析不正确的是
能产生蓝色沉淀,对有关实验现象及分析不正确的是
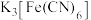 溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知:
溶液,混合均匀,分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如表。已知: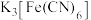 遇到
遇到 能产生蓝色沉淀,对有关实验现象及分析不正确的是
能产生蓝色沉淀,对有关实验现象及分析不正确的是变红变蓝 | 变红 |
| ⅰ.包裹铜片的铁钉 | ⅱ.包裹锌片的铁钉 |
| A.两个培养皿中金属均发生吸氧腐蚀,且铁钉腐蚀速度ⅰ快 |
| B.该实验证明,若给金属表面镀活泼性比被保护金属强的金属,则破损后依旧可以防护 |
| C.培养皿ⅱ中对铁钉的防护是牺牲阳极的阴极保护法 |
| D.随着反应的进行,培养皿ⅰ和ⅱ中均出现红褐色浑浊 |
您最近半年使用:0次
2023-11-16更新
|
395次组卷
|
2卷引用:福建省龙岩第一中学2023-2024学年高二上学期第三次月考化学试题



