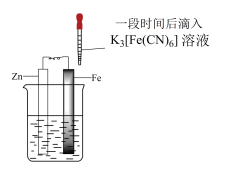
1 . 验证牺牲阳极法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
下列说法不正确 的是
| ① | ② | ③ |
 |  | 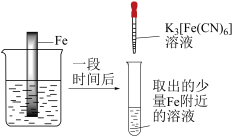 |
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
A.对比①②,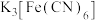 可能将Fe氧化 可能将Fe氧化 |
| B.对比②③,可以判定Zn保护了Fe |
C.用 酸性溶液代替 酸性溶液代替 溶液,也可验证牺牲阳极法 溶液,也可验证牺牲阳极法 |
| D.将Zn换成Cu,用①的方法无法判断Fe比Cu活泼 |
您最近一年使用:0次
2023-01-07更新
|
604次组卷
|
3卷引用:北京师范大学附属中学2022-2023学年上学期高二化学期末试题
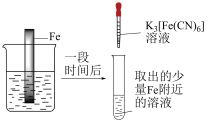
2 . 实验小组研究金属电化学腐蚀,实验如下:
实验Ⅰ

5min时的现象:铁钉表面及周边未见明显变化。
25min时的现象:铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成。
实验Ⅱ
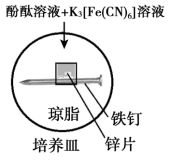
5min时的现象:铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化。
25min时的现象:铁钉周边红色加深,区域变大,未见蓝色出现,锌片周边未见明显变化。
下列说法不正确的是
实验Ⅰ

5min时的现象:铁钉表面及周边未见明显变化。
25min时的现象:铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成。
实验Ⅱ

5min时的现象:铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化。
25min时的现象:铁钉周边红色加深,区域变大,未见蓝色出现,锌片周边未见明显变化。
下列说法不正确的是
| A.实验Ⅱ中Zn保护了Fe,使铁的腐蚀速率比实验Ⅰ慢 |
B.实验Ⅱ中正极的电极反应式: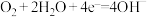 |
C.实验Ⅰ的现象说明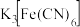 溶液与Fe反应生成了 溶液与Fe反应生成了 |
| D.若将Zn片换成Cu片,推测Cu片周边会出现红色,铁钉周边会出现蓝色 |
您最近一年使用:0次
2022-09-04更新
|
1372次组卷
|
13卷引用:北京市第十二中学2021-2022学年高一下学期6月月考化学试题
北京市第十二中学2021-2022学年高一下学期6月月考化学试题北京十二中2021-2022学年高一下学期六月月考(等级考)化学试题北京市海淀实验中学2022-2023学年高三上学期10月学科展示化学试题北京市北京师范大学燕化附中2022-2023学年高二上学期10月月考化学试题北京市朝阳区2021届高三上学期期末考试化学试题(已下线)北京市第四中学2021-2022学年高二上学期期中考试化学试题(已下线)【教材实验热点】17 金属的腐蚀与防护第四章 综合拔高练福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(2卷)试题山东省枣庄市第一中学2022-2023学年高二上学期期末达标化学试题(已下线)2021年高考化学押题预测卷(辽宁卷)(03)福建省龙岩市连城县第一中学2023-2024学年高二上学期8月月考化学试题山东省滨州市2023-2024学年高三上学期11月期中考试化学试题
3 . 铁的腐蚀与防护与生产生活密切相关。
Ⅰ.研究铁的腐蚀
实验步骤如下:
步骤1:将铁粉放置于0.002
 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。
步骤2:向15.00 mL 1 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。
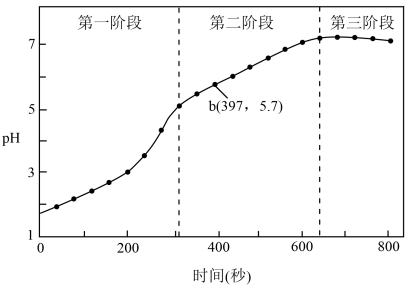
(1)第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为___________ 。
(2)第二、三阶段主要发生吸氧腐蚀。
①选取b点进行分析,经检验溶液中含有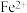 ,写出Fe被腐蚀的总反应
,写出Fe被腐蚀的总反应___________ 。
②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。写出b点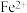 被氧化的离子方程式
被氧化的离子方程式___________ 。
③依据b点发生的反应,分析第二阶段pH上升的原因是___________ 。
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知: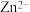 放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
①镀件Fe应与电源的___________ 相连。
②向 电解液中加入NaCN溶液,将
电解液中加入NaCN溶液,将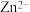 转化为
转化为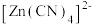 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是___________ 。
(4)电镀后的废水中含有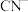 ,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c
,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c 
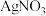 溶液滴定,消耗
溶液滴定,消耗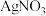 溶液V mL。已知:
溶液V mL。已知: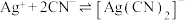 (无色)
(无色) 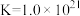 ,
,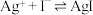
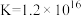 。
。
①滴定终点的现象是___________ 。
②废水中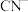 的含量是
的含量是___________  (填计算式)。
(填计算式)。
Ⅰ.研究铁的腐蚀
实验步骤如下:
步骤1:将铁粉放置于0.002

 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。步骤2:向15.00 mL 1
 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。步骤3:采集溶液pH随时间变化的数据。

(1)第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为
(2)第二、三阶段主要发生吸氧腐蚀。
①选取b点进行分析,经检验溶液中含有
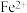 ,写出Fe被腐蚀的总反应
,写出Fe被腐蚀的总反应②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。写出b点
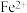 被氧化的离子方程式
被氧化的离子方程式③依据b点发生的反应,分析第二阶段pH上升的原因是
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知:
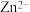 放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。①镀件Fe应与电源的
②向
 电解液中加入NaCN溶液,将
电解液中加入NaCN溶液,将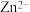 转化为
转化为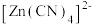 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是(4)电镀后的废水中含有
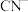 ,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c
,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c 
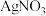 溶液滴定,消耗
溶液滴定,消耗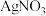 溶液V mL。已知:
溶液V mL。已知: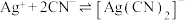 (无色)
(无色) 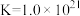 ,
,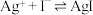
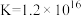 。
。①滴定终点的现象是
②废水中
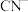 的含量是
的含量是 (填计算式)。
(填计算式)。
您最近一年使用:0次
2022-03-25更新
|
719次组卷
|
5卷引用:北京市丰台区2022届高三一模化学试题
4 . 某学习小组探究 溶液与
溶液与 溶液在某种条件下的反应。
溶液在某种条件下的反应。
已知:FeS、 均为黑色固体,难溶于水。
均为黑色固体,难溶于水。
(1) 只能大量存在于碱性溶液环境的原因是
只能大量存在于碱性溶液环境的原因是___________ (用化学用语回答)。
(2)小组同学们对试管b中黑色沉淀的提出猜想
猜想1:黑色沉淀是FeS
猜想2:黑色沉淀是
①若猜想1成立,甲同学推测还应该有S生成。甲同学推测所依据的离子方程式___________ 。经检验后确认黑色沉淀中无S单质,猜想1不成立。
②乙同学根据 溶液呈碱性,推测试管b中黑色沉淀除
溶液呈碱性,推测试管b中黑色沉淀除 外,还可能存在
外,还可能存在 ,进行如下实验,以便获得有效信息。
,进行如下实验,以便获得有效信息。
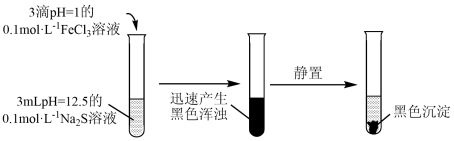
向 浊液中滴加pH=12.5的0.1mol/L
浊液中滴加pH=12.5的0.1mol/L  溶液,观察到红褐色沉淀很快转化为黑色。
溶液,观察到红褐色沉淀很快转化为黑色。
该实验现象能确定的结论是___________ ;不能确定的是___________ 。
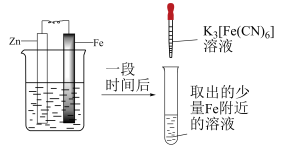
(3)丙同学利用电化学原理继续进行探究并设计实验:
丙同学依据实验得出结论:pH=1的0.1mol/L  溶液与pH=12.5的0.1mol/L
溶液与pH=12.5的0.1mol/L  溶液
溶液___________ (填“能”或“不能”)发生氧化还原反应。
(4)综合以上研究,分析试管b中黑色沉淀是 而不是FeS的原因
而不是FeS的原因___________ 。
 溶液与
溶液与 溶液在某种条件下的反应。
溶液在某种条件下的反应。
已知:FeS、
 均为黑色固体,难溶于水。
均为黑色固体,难溶于水。(1)
 只能大量存在于碱性溶液环境的原因是
只能大量存在于碱性溶液环境的原因是(2)小组同学们对试管b中黑色沉淀的提出猜想
猜想1:黑色沉淀是FeS
猜想2:黑色沉淀是

①若猜想1成立,甲同学推测还应该有S生成。甲同学推测所依据的离子方程式
②乙同学根据
 溶液呈碱性,推测试管b中黑色沉淀除
溶液呈碱性,推测试管b中黑色沉淀除 外,还可能存在
外,还可能存在 ,进行如下实验,以便获得有效信息。
,进行如下实验,以便获得有效信息。向
 浊液中滴加pH=12.5的0.1mol/L
浊液中滴加pH=12.5的0.1mol/L  溶液,观察到红褐色沉淀很快转化为黑色。
溶液,观察到红褐色沉淀很快转化为黑色。该实验现象能确定的结论是
(3)丙同学利用电化学原理继续进行探究并设计实验:
| 装置 | 操作及现象 |
 | ①电流计指针有微弱偏转 ②2分钟后,取左侧烧杯溶液,滴加 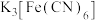 溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加 溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加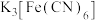 溶液,有大量蓝色沉淀。 溶液,有大量蓝色沉淀。 |
 溶液与pH=12.5的0.1mol/L
溶液与pH=12.5的0.1mol/L  溶液
溶液(4)综合以上研究,分析试管b中黑色沉淀是
 而不是FeS的原因
而不是FeS的原因
您最近一年使用:0次
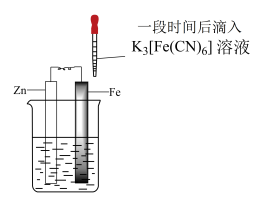
5 . 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
下列说法不正确 的是
| ① | ② | ③ |
|
|
|
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
| A.对比②③,可以判定Zn保护了Fe |
| B.对比①②,K3[Fe(CN)6]可能将Fe氧化 |
| C.验证Zn保护Fe时不能用①的方法 |
| D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼 |
您最近一年使用:0次
2018-06-09更新
|
11503次组卷
|
78卷引用:北京市清华大学附属中学2022-2023学年高二上学期期中考试化学试题
北京市清华大学附属中学2022-2023学年高二上学期期中考试化学试题2018年全国普通高等学校招生统一考试化学(北京卷)北京市通州区2019-2020学年高二下学期期末考试化学试题河南省中原名校联盟2021-2022学年高二上学期第三次适应性联考化学试题北京师范大学附属中学2021-2022学年高二上学期期末考试化学试题广东省东莞市七校2021-2022学年高二下学期期中联考化学试题山东省泰安市泰安一中2021-2022学年高一下学期6月学情诊断化学试题(已下线)考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点18 原电池 化学电源-备战2023年高考化学一轮复习考点帮(全国通用)重庆市西南大学附属中学校2021-2022学年高一广延班下学期期末考试化学试题(已下线)第17讲 电解池 金属的腐蚀与防护 (练)-2023年高考化学一轮复习讲练测(新教材新高考)山东省枣庄市第三中学(实验班)2022-2023学年高二11月线上测试化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题(已下线)2018年高考题及模拟题汇编 专题11 化学实验基础安徽省阜阳市第三中学竞培中心2017-2018学年高一年级第二学期第三次调研考试化学试题【全国百强校】河南省信阳市高级中学2018-2019学年高二上学期10月月考化学试题1(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)浙江省东阳中学2018-2019学年高一下学期期中考试化学试题四川省攀枝花市2018-2019学年高二下学期期末调研检测化学试题四川省树德中学2020届高三11月月考化学试题(已下线)【南昌新东方】江西省南昌市第三中学2019-2020学年度高三上学期11月月考化学试题四川省成都市龙泉第二中学2019-2020学年高三上学期1月月考理科综合化学试题(已下线)专题十 化学能与电能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训江西省宜春市宜丰县宜丰中学2019-2020学年高二下学期开学考试化学试题(已下线)专题6.3 电解池 金属的腐蚀与防护(练)——2020年高考化学一轮复习讲练测江西省宜春市2020届高三5月模拟理科综合-化学试题(已下线)专题6.3 电解池 金属的腐蚀与防护(讲)——2020年高考化学一轮复习讲练测河南省驻马店市2018-2019学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第4节 金属的腐蚀与防护高中必刷题高二选择性必修1第四章 化学反应与电能 第四章素养检测河南省漯河市临颍县南街高级中学2020届高三阶段性测试化学试题人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第三节 金属的腐蚀与防护1(已下线)第21讲 电解池 金属的电化学腐蚀与防护 (精讲)——2021年高考化学一轮复习讲练测人教版(2019)高二化学选择性必修1第四章 化学反应与电能 过高考 3年真题强化闯关(已下线)第四章 化学反应与电能(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)河南省郑州市郑州中学2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP406】【化学】河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研化学试题(已下线)小题必刷26 电解池原理及其应用——2021年高考化学一轮复习小题必刷(通用版本)福建省平和县第一中学2021届高三年上学期第二次月考化学试题江苏省泰州中学2020-2021学年高二上学期期中考试化学试题(已下线)练习16 金属的电化学腐蚀-2020-2021学年【补习教材·寒假作业】高二化学(人教版)辽宁省丹东市2020-2021学年高二上学期期末考试化学试题甘肃省陇南市徽县第二中学2020-2021学年高二上学期期末考试化学试题四川省三台中学实验学校2020-2021学年高二下学期开学考试理综化学试题陕西省咸阳市2021届高考五月检测三模理综化学试题(已下线)课时34 金属的腐蚀与防护-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第17讲 电解池 金属的腐蚀与防护(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)江苏省泰州中学2021-2022学年高二上学期第一次月度检测化学试题山东省实验中学2022届高三第一次诊断考试化学试题河南省南阳市第一中学校2021-2022学年高二上学期第二次月考化学试题福建省厦门市厦门双十中学2021-2022学年上学期期中考试化学试题山东省泰安第二中学2021-2022学年高二上学期期中考试化学试题(已下线)4.3 金属的腐蚀和防护-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)河南省重点高中2021-2022学年高二上学期阶段性调研联考二化学试题(已下线)2020年江苏卷化学高考真题变式题11-15山东省济南外国语学校2021-2022学年高三上学期11月月考化学试题黑龙江省牡丹江市第三高级中学2021-2022学年高三上学期第四次月考化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题河南省洛阳市2022-2023学年高二上学期期末考试化学试题(已下线)题型107 电化学原理在金属防腐蚀中的应用辽宁省凌源市高中2022-2023学年高二下学期3月联考化学试题(已下线)专题六 金属的化学腐蚀与防护(练习)天津市第一中学2022-2023学年高二上学期期末考试化学试题作业(二十六) 金属的腐蚀与防护云南省普洱市第一中学2022-2023学年高二下学期期末考试化学试题第四章 化学反应与电能 第三节 金属的腐蚀与防护山东省泰安新泰市第一中学(实验部)2023-2024学年高二上学期第一次质量检测化学试题(已下线)不定项选择题福建省泉州市泉港区第一中学2023-2024学年高二上学期12月月考化学试题山东省百师联盟2023-2024学年高二上学期12月大联考化学试题 陕西省安康市2023-2024学年高二上学期12月联考化学试题
17-18高三·湖北宜昌·阶段练习
名校
解题方法
6 . 生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
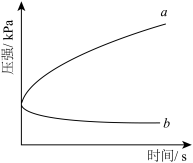

| A.两容器中负极反应均为Fe-2e-═Fe2+ |
| B.曲线a记录的是pH=2的盐酸中压强的变化 |
| C.曲线b记录的容器中正极反应是O2+4e-+2H2O═4OH- |
| D.在弱酸性溶液中,生铁能发生吸氧腐蚀 |
您最近一年使用:0次
2018-01-10更新
|
1109次组卷
|
9卷引用:北京市第四中学2022-2023学年高三上学期期中考试化学试题
(已下线)北京市第四中学2022-2023学年高三上学期期中考试化学试题(已下线)第14练 金属腐蚀和防护-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)湖北省宜昌市第一中学2018届高三年级适应性训练(二)理综化学试题河北省定州中学2018届高三上学期高中毕业班期末考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第4节 金属的腐蚀与防护高中必刷题高二选择性必修1第四章 化学反应与电能 第三节 金属的腐蚀与防护江西省南昌市第二中学2020-2021学年高二上学期期末考试化学试题选择性必修1专题1第三单元 金属的腐蚀与防护1.3金属的腐蚀和防护 课后