2020高三·全国·专题练习
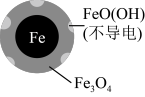
1 . 用零价铁(Fe)去除水体中的硝酸盐( )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。
(1)Fe还原水体中 的反应原理如图所示。
的反应原理如图所示。

①作负极的物质化学式为___________ 。
②正极的电极反应式是_____________ 。
(2)将足量铁粉投入水体中,经24小时测定 的去除率和pH,结果如下:
的去除率和pH,结果如下:
pH=4.5时, 的去除率低。其原因是
的去除率低。其原因是_________________ 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高 的去除率。对Fe2+的作用提出两种假设:
的去除率。对Fe2+的作用提出两种假设:
I.Fe2+直接还原 ;
;
II.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________ 。
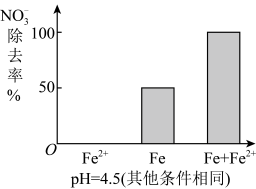
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________ ,解释加入Fe2+提高 去除率的原因:
去除率的原因:___________ 。
 )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。(1)Fe还原水体中
 的反应原理如图所示。
的反应原理如图所示。
①作负极的物质化学式为
②正极的电极反应式是
(2)将足量铁粉投入水体中,经24小时测定
 的去除率和pH,结果如下:
的去除率和pH,结果如下:初始pH | pH=2.5 | pH=4.5 |
| 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
 的去除率低。其原因是
的去除率低。其原因是(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高
 的去除率。对Fe2+的作用提出两种假设:
的去除率。对Fe2+的作用提出两种假设:I.Fe2+直接还原
 ;
;II.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是
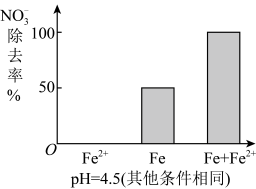
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为
 去除率的原因:
去除率的原因:
您最近一年使用:0次
名校
2 . 下列图示内容的对应说明正确的是
| 编号 | A | B | C | D |
| 图示 | 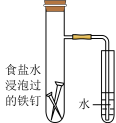 食盐水 |  片刻后在Fe 电极附近滴入K3[Fe(CN)6]溶液 | 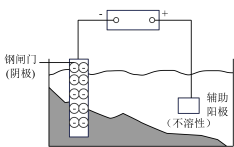 |  |
| 说明 | 验证铁钉发生 吸氧腐蚀 | 验证 Fe 电极被保护 | 该装置是牺牲阳极的阴极保护法 | 该化学反应为放热反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-07-04更新
|
430次组卷
|
4卷引用:专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)
(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)模拟卷03(必考+选考)——2020年秋高三化学开学摸底考试卷(全国通用)北京市八一学校2019-2020学年高二下学期期末考试化学试题
名校
3 . 宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是
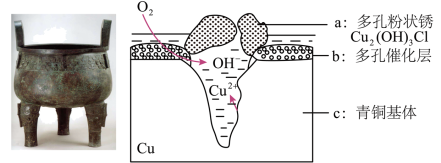

| A.青铜器发生电化学腐蚀,图中c作负极 |
| B.潮湿环境中Cl-浓度大有利于多孔粉状锈的生成 |
| C.若生成0.2 mol Cu2(OH)3Cl,则消耗的O2体积为4.48L |
| D.环境中的Cl−与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH−+Cl−===Cu2 (OH)3Cl↓ |
您最近一年使用:0次
2019-01-28更新
|
899次组卷
|
10卷引用:第36练 金属的腐蚀与防护-2023年高考化学一轮复习小题多维练(全国通用)
(已下线)第36练 金属的腐蚀与防护-2023年高考化学一轮复习小题多维练(全国通用)(已下线)课时34 金属的腐蚀与防护-2022年高考化学一轮复习小题多维练(全国通用)陕西省西安市铁一中滨河高级中学2021-2022学年高三上学期第三次模拟考试理综化学试题【校级联考】福建省八县(市)一中2018-2019学年高二上学期期末考试化学试题福建省永泰县第一中学2018-2019学年高二上学期期末考试+化学高中必刷题高二选择性必修1第四章 化学反应与电能 第三节 金属的腐蚀与防护选择性必修1专题1第三单元 金属的腐蚀与防护云南省玉溪第一中学2021-2022学年高二上学期期中考试化学试题湖南省湘潭市第一中学2022-2023学年高二下学期第一次月考化学试题1.3金属的腐蚀和防护 课后
4 . 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
下列说法不正确 的是
| ① | ② | ③ |
|
|
|
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
| A.对比②③,可以判定Zn保护了Fe |
| B.对比①②,K3[Fe(CN)6]可能将Fe氧化 |
| C.验证Zn保护Fe时不能用①的方法 |
| D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼 |
您最近一年使用:0次
2018-06-09更新
|
11571次组卷
|
78卷引用:考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点18 原电池 化学电源-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第17讲 电解池 金属的腐蚀与防护 (练)-2023年高考化学一轮复习讲练测(新教材新高考)2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题11 化学实验基础(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)四川省树德中学2020届高三11月月考化学试题(已下线)【南昌新东方】江西省南昌市第三中学2019-2020学年度高三上学期11月月考化学试题四川省成都市龙泉第二中学2019-2020学年高三上学期1月月考理科综合化学试题(已下线)专题十 化学能与电能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)专题6.3 电解池 金属的腐蚀与防护(练)——2020年高考化学一轮复习讲练测江西省宜春市2020届高三5月模拟理科综合-化学试题(已下线)专题6.3 电解池 金属的腐蚀与防护(讲)——2020年高考化学一轮复习讲练测河南省漯河市临颍县南街高级中学2020届高三阶段性测试化学试题(已下线)第21讲 电解池 金属的电化学腐蚀与防护 (精讲)——2021年高考化学一轮复习讲练测(已下线)小题必刷26 电解池原理及其应用——2021年高考化学一轮复习小题必刷(通用版本)福建省平和县第一中学2021届高三年上学期第二次月考化学试题陕西省咸阳市2021届高考五月检测三模理综化学试题(已下线)课时34 金属的腐蚀与防护-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第17讲 电解池 金属的腐蚀与防护(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)山东省实验中学2022届高三第一次诊断考试化学试题河南省中原名校联盟2021-2022学年高二上学期第三次适应性联考化学试题(已下线)2020年江苏卷化学高考真题变式题11-15山东省济南外国语学校2021-2022学年高三上学期11月月考化学试题黑龙江省牡丹江市第三高级中学2021-2022学年高三上学期第四次月考化学试题广东省东莞市七校2021-2022学年高二下学期期中联考化学试题山东省泰安市泰安一中2021-2022学年高一下学期6月学情诊断化学试题重庆市西南大学附属中学校2021-2022学年高一广延班下学期期末考试化学试题北京市清华大学附属中学2022-2023学年高二上学期期中考试化学试题山东省枣庄市第三中学(实验班)2022-2023学年高二11月线上测试化学试题(已下线)题型107 电化学原理在金属防腐蚀中的应用(已下线)专题六 金属的化学腐蚀与防护(练习)(已下线)不定项选择题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题安徽省阜阳市第三中学竞培中心2017-2018学年高一年级第二学期第三次调研考试化学试题【全国百强校】河南省信阳市高级中学2018-2019学年高二上学期10月月考化学试题1浙江省东阳中学2018-2019学年高一下学期期中考试化学试题四川省攀枝花市2018-2019学年高二下学期期末调研检测化学试题江西省宜春市宜丰县宜丰中学2019-2020学年高二下学期开学考试化学试题北京市通州区2019-2020学年高二下学期期末考试化学试题河南省驻马店市2018-2019学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第4节 金属的腐蚀与防护高中必刷题高二选择性必修1第四章 化学反应与电能 第四章素养检测人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第三节 金属的腐蚀与防护1人教版(2019)高二化学选择性必修1第四章 化学反应与电能 过高考 3年真题强化闯关(已下线)第四章 化学反应与电能(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)河南省郑州市郑州中学2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP406】【化学】河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研化学试题江苏省泰州中学2020-2021学年高二上学期期中考试化学试题(已下线)练习16 金属的电化学腐蚀-2020-2021学年【补习教材·寒假作业】高二化学(人教版)辽宁省丹东市2020-2021学年高二上学期期末考试化学试题甘肃省陇南市徽县第二中学2020-2021学年高二上学期期末考试化学试题四川省三台中学实验学校2020-2021学年高二下学期开学考试理综化学试题江苏省泰州中学2021-2022学年高二上学期第一次月度检测化学试题河南省南阳市第一中学校2021-2022学年高二上学期第二次月考化学试题福建省厦门市厦门双十中学2021-2022学年上学期期中考试化学试题山东省泰安第二中学2021-2022学年高二上学期期中考试化学试题(已下线)4.3 金属的腐蚀和防护-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)河南省重点高中2021-2022学年高二上学期阶段性调研联考二化学试题北京师范大学附属中学2021-2022学年高二上学期期末考试化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题河南省洛阳市2022-2023学年高二上学期期末考试化学试题辽宁省凌源市高中2022-2023学年高二下学期3月联考化学试题天津市第一中学2022-2023学年高二上学期期末考试化学试题作业(二十六) 金属的腐蚀与防护云南省普洱市第一中学2022-2023学年高二下学期期末考试化学试题第四章 化学反应与电能 第三节 金属的腐蚀与防护山东省泰安新泰市第一中学(实验部)2023-2024学年高二上学期第一次质量检测化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题福建省泉州市泉港区第一中学2023-2024学年高二上学期12月月考化学试题山东省百师联盟2023-2024学年高二上学期12月大联考化学试题 陕西省安康市2023-2024学年高二上学期12月联考化学试题
名校
解题方法
5 . 生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
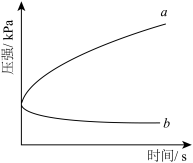

| A.两容器中负极反应均为Fe-2e-═Fe2+ |
| B.曲线a记录的是pH=2的盐酸中压强的变化 |
| C.曲线b记录的容器中正极反应是O2+4e-+2H2O═4OH- |
| D.在弱酸性溶液中,生铁能发生吸氧腐蚀 |
您最近一年使用:0次
2018-01-10更新
|
1117次组卷
|
9卷引用:北京市第四中学2022-2023学年高三上学期期中考试化学试题
(已下线)北京市第四中学2022-2023学年高三上学期期中考试化学试题湖北省宜昌市第一中学2018届高三年级适应性训练(二)理综化学试题河北省定州中学2018届高三上学期高中毕业班期末考试化学试题(已下线)第14练 金属腐蚀和防护-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第4节 金属的腐蚀与防护高中必刷题高二选择性必修1第四章 化学反应与电能 第三节 金属的腐蚀与防护江西省南昌市第二中学2020-2021学年高二上学期期末考试化学试题选择性必修1专题1第三单元 金属的腐蚀与防护1.3金属的腐蚀和防护 课后
6 . 化学科技工作者对含有碳杂质的金属铝的腐蚀与溶液酸碱性的关系进行了研究,在25℃时得出溶液pH值对铝的腐蚀影响关系如图所示,下列说法正确的是
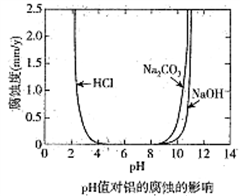

| A.金属铝在浓硫酸中的腐蚀速率大于盐酸中的腐蚀速率 |
| B.金属铝在中性环境中不易被腐蚀 |
| C.金属铝在pH=8.5的Na2CO3 溶液中会发生电化学腐蚀析出氧气 |
| D.不能用电解的方法在金属铝的表面生成致密的氧化物薄膜 |
您最近一年使用:0次
2017-12-24更新
|
460次组卷
|
5卷引用:第36练 金属的腐蚀与防护-2023年高考化学一轮复习小题多维练(全国通用)
(已下线)第36练 金属的腐蚀与防护-2023年高考化学一轮复习小题多维练(全国通用)辽宁省百校联盟2018届高三TOP20十二月联考(Ⅱ卷)理综化学试题2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(C卷)(已下线)课时34 金属的腐蚀与防护-2022年高考化学一轮复习小题多维练(全国通用)(已下线)黄金30题系列 高二化学(选修4) 小题好拿分【提升版】
7 . 支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
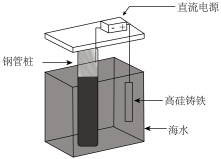

| A.通入保护电流使钢管桩表面腐蚀电流接近于零 |
| B.通电后外电路电子被强制从高硅铸铁流向钢管桩 |
| C.高硅铸铁的作用是作为损耗阳极材料和传递电流 |
| D.通入的保护电流应该根据环境条件变化进行调整 |
您最近一年使用:0次
2017-08-09更新
|
10686次组卷
|
59卷引用:解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)上海市七宝中学2022-2023学年高三上学期9月月考化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅰ卷精编版)(已下线)《考前20天终极攻略》-5月22日 电化学基础(已下线)解密09 电化学(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)2020届高三化学知识点强化训练----化学能与电能贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题(已下线)专题十 化学能与电能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训云南省大理白族自治州祥云县第一中学2020届高三下学期4月月考理综化学试题河北省衡水中学2020届高三四月份质量监测理综化学试题湖南长沙长郡中学2020届高三2月份网络教学质量监测卷理综化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题2020届浙江省杭州学军中学高三教学质量监测卷化学试题湖南省长沙市礼雅中学2020届高三下学期三月份网络教学质量监测理科综合化学试题广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题(已下线)专题6.3 电解池 金属的腐蚀与防护(练)——2020年高考化学一轮复习讲练测(已下线)专题6.3 电解池 金属的腐蚀与防护(讲)——2020年高考化学一轮复习讲练测四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题(已下线)第21讲 电解池 金属的电化学腐蚀与防护 (精讲)——2021年高考化学一轮复习讲练测(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)【浙江新东方】高中化学20210513-015【2021】【高三下】(已下线)课时34 金属的腐蚀与防护-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(浙江专用)湖北省武汉市华中师范大学第一附属中学2020届高三3月份网络教学质量监测卷理综化学试题(已下线)4.3 金属的腐蚀与防护-同步学习必备知识(已下线)第六章 化学反应与能量 第37讲 电解池 金属的腐蚀与防护(已下线)题型107 电化学原理在金属防腐蚀中的应用(已下线)专题六 金属的化学腐蚀与防护(练习)山东省枣庄市薛城区2017-2018学年高二上学期期末化学试题【全国百强校】江苏省海安高级中学2018-2019学年高一(创新班)上学期第一次月考化学试题(已下线)2018年12月13日 《每日一题》人教选修4-金属的电化学防护【全国百强校】黑龙江省大庆市第一中学2018-2019学年高二下学期开学检测化学试题浙江省宁波诺丁汉大学附属中学2017-2018学年高二上学期期中考试化学试题河北省张家口市第一中学2019-2020学年高二上学期期中考试化学试题(已下线)2019年12月12日 《每日一题》化学人教版(选修4)——金属的电化学防护步步为赢 高二化学寒假作业:作业十四 金属的腐蚀与防护湖北省武汉市武昌区水果湖高中 2019-2020 学年高二下学期期中考试化学试题云南省曲靖市会泽县第一中学2019-2020学年高二上学期第一次段考化学试题江西省宜春市宜丰县宜丰中学2019-2020学年高二下学期开学考试化学试题广东省茂名市五校联盟2019-2020学年高二下学期期末联考化学试题黑龙江省哈尔滨市第一中学校2019-2020学年高一下学期期末考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第4节 金属的腐蚀与防护山东省章丘市第一中学2020-2021学年高二上学期9月月考化学试题河南省南阳市2020-2021学年高二上学期期中质量评估化学试题(已下线)第四章 化学反应与电能(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)河北省石家庄市第一中学2020-2021学年高二上学期学情反馈(一) 化学试题山东省枣庄市薛城区2021-2022学年高二上学期期中考试化学试题河南省南阳市第一中学校2021-2022学年高二上学期第二次月考化学试题(已下线)4.3.2 金属的防护(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)4.3 金属的腐蚀和防护-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)湖北省孝感市2022-2023学年高二上学期1月期末考试化学试题作业(二十六) 金属的腐蚀与防护山西省运城市河津中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
8 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。
2H++SnO22- Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-
请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_______ 。
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是_______ ;此锡粉样品中锡的质量分数________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:
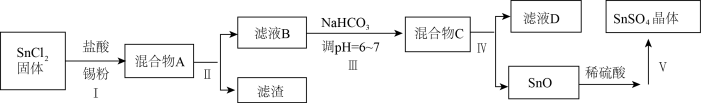
① 步骤I加入Sn粉的作用:___________ 及调节溶液pH。
② 步骤Ⅲ生成SnO的离子方程式:____________________ 。
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是____________ ,镀锡铁破损后在潮湿的环境中容易发生腐蚀的原因是_________ ,若是在较弱的酸性环境中发生腐蚀,正极反应式是____________ 。
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为___________ 。
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是________ ;
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用________ 。
2H++SnO22-
 Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:

① 步骤I加入Sn粉的作用:
② 步骤Ⅲ生成SnO的离子方程式:
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用
您最近一年使用:0次
2017-05-15更新
|
706次组卷
|
2卷引用:山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题
名校
9 . 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是
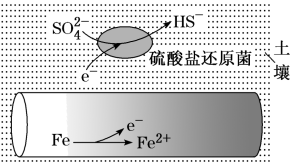
| A.正极反应为:SO42-+5H2O+8e-=HS-+9OH- |
| B.输送暖气的管道不易发生此类腐蚀 |
| C.这种情况下,Fe腐蚀的最终产物为Fe2O3·xH2O |
| D.管道上刷富锌油漆可以延缓管道的腐蚀 |
您最近一年使用:0次
2017-04-17更新
|
2102次组卷
|
17卷引用:考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)2017届安徽省淮北市高三第二次模拟考试化学试卷(已下线)专题十 化学能与电能(提分特训)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)天津市和平区2021届高三上学期期末考试化学试题(已下线)第14练 金属腐蚀和防护-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)考点20 金属的腐蚀与防护(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)青海省西宁市第五中学2016-2017学年高二下学期期中考试化学试题河北安平中学2019-2020学年高二上学期第二次月考化学试题2020年北京高二下学期 复习模拟试题二(选修4人教版)山东省新泰市第一中学2020-2021学年高二上学期第一次阶段性考试化学试题内蒙古通辽实验中学2020-2021学年高二上学期自主检测化学试题福建省三明市四地四校2021-2022学年高二上学期期中联考协作卷化学试题宁夏石嘴山市第三中学2022-2023学年高二下学期第一次月考化学(理)试题第四章 章末训练山东省枣庄市第三中学2023-2024学年高二上学期10月月考化学试题
名校
10 . 宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是
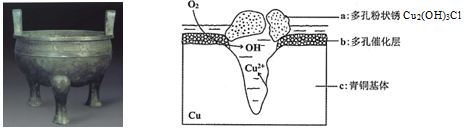

| A.青铜器发生电化学腐蚀,图中c作负极,被氧化 |
| B.正极发生的电极反应为O2+ 4e-+2H2O=4OH- |
| C.环境中的Cl-与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl↓ |
| D.若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L |
您最近一年使用:0次
2017-01-10更新
|
586次组卷
|
5卷引用:湖南省株洲市第一中学2022-2023学年高三上学期第一次月考化学试题