1 . 请说明以下防锈方法的原理。
(1)在电线的外面常包裹一层塑料________ 。
(2)海轮的外壳上除了喷一层漆外,还会附上一些锌块________ 。
(3)大型水闸常与直流电源的负极相连,再在电源的正极连上惰性电极,置于附近的水中________ 。
(1)在电线的外面常包裹一层塑料
(2)海轮的外壳上除了喷一层漆外,还会附上一些锌块
(3)大型水闸常与直流电源的负极相连,再在电源的正极连上惰性电极,置于附近的水中
您最近一年使用:0次
2022-11-25更新
|
54次组卷
|
2卷引用:苏教2020版选择性必修1专题1第三单元 金属的腐蚀与防护课后习题
2 . 下列事实中,与电化学腐蚀无关的是________
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
您最近一年使用:0次
3 . 从金属材料到无机非金属材料,再到高分子材料,不同的组成和性能决定了材料独特的功能和用途。
(1)合金是生活中常见的材料。某合金具有密度小、强度高的优良性能,常用于制造门窗框架,该合金中含量最高的金属为_______ (填元素符号)。
(2)铁锈的主要成分是_______ (填化学式),它是钢铁在潮湿的空气中发生_______ 腐蚀的结果。
(3)生产、生活中常见的无机非金属材料主要有_______ 。
(4)结合实例比较金属材料与无机非金属材料各有什么优缺点___________ 。
(1)合金是生活中常见的材料。某合金具有密度小、强度高的优良性能,常用于制造门窗框架,该合金中含量最高的金属为
(2)铁锈的主要成分是
(3)生产、生活中常见的无机非金属材料主要有
(4)结合实例比较金属材料与无机非金属材料各有什么优缺点
您最近一年使用:0次
解题方法
4 . 在打捞出来的“南海一号”沉船的文物中,“鎏金龙纹手镯”光彩夺目,完好无损;铜镜表面有铜锈;铁器则锈迹斑斑,残存很少。请结合所学知识解释出现这些现象的原因_______ 。
您最近一年使用:0次
解题方法
5 . 完成下列各小题
(1)已知在25℃、101kPa时,4gH2完全燃烧生成液态水,放出571.6kJ的热量,写出表示H2摩尔燃烧焓的热化学方程式:_______ 。
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生_______ 腐蚀而生锈。请写出铁锅生锈过程的正极反应式:_______ 。
(1)已知在25℃、101kPa时,4gH2完全燃烧生成液态水,放出571.6kJ的热量,写出表示H2摩尔燃烧焓的热化学方程式:
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生
您最近一年使用:0次
解题方法
6 . 如图所示,甲、乙两试管中各放一枚铁钉,甲试管中为稀盐酸,乙试管中为NaCl溶液,导管中有一段红墨水。

(1)一段时间后导管中红墨水的左端液面_______ 。
(2)甲中铁钉的腐蚀主要属于_______ (填“化学”或“电化学”)腐蚀,正极反应为_______ 。
(3)乙中铁钉的腐蚀主要属于_______ 腐蚀,(填“吸氧”或“析氢”)正极反应式为_______ ,负极反应式为_______ ,铁锈中铁的化合价为_______ 。

(1)一段时间后导管中红墨水的左端液面
(2)甲中铁钉的腐蚀主要属于
(3)乙中铁钉的腐蚀主要属于
您最近一年使用:0次
2022-10-30更新
|
61次组卷
|
2卷引用:福建省泉州科技中学2022-2023学年高二上学期第一次月考化学试题
7 . 北京冬奥会赛区内将使用氢燃料清洁能源车辆,就是利用原电池原理提供清洁电能,回答下面问题:
(1)某氢氧燃料电池工作示意图如图1。

①电极a是_______ (填“正极”“负极”“阳极”或“阴极”),电极a发生的电极反应是_______ 。
②电解质KOH溶液中K+向_______ 电极移动(填“a”或“b”)。
(2)利用图1中的原电池电解饱和食盐水,可以有效的利用海水资源,原理如图:
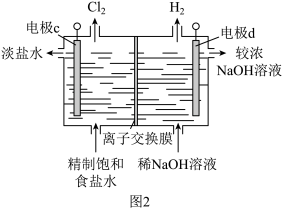
①电极d应连接图1装置的_______ 电极(填“a”或“b”),离子交换膜是_______ (填“阴离子交换膜”或“阳离子交换膜”)。
②写出电极c的电极反应_______ 。
③写出电解饱和食盐水的离子方程式_______ 。
(3)将铁钉的下半部分分别镀上铜和锌,放入培养皿中,加入饱和食盐水溶液,再各滴入几滴酚酞溶液和K3[Fe(CN)6]溶液。装置如图3:
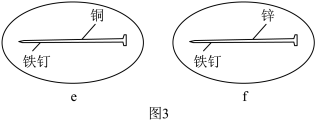
①在铁钉下半部分镀上铜的装置中,阳极材料是_______ (填化学式)。
②e装置中出现蓝色沉淀,铜电极发生的电极反应是_______ 。
③f装置中可能出现的现象是_______ 。
(1)某氢氧燃料电池工作示意图如图1。

①电极a是
②电解质KOH溶液中K+向
(2)利用图1中的原电池电解饱和食盐水,可以有效的利用海水资源,原理如图:

①电极d应连接图1装置的
②写出电极c的电极反应
③写出电解饱和食盐水的离子方程式
(3)将铁钉的下半部分分别镀上铜和锌,放入培养皿中,加入饱和食盐水溶液,再各滴入几滴酚酞溶液和K3[Fe(CN)6]溶液。装置如图3:

①在铁钉下半部分镀上铜的装置中,阳极材料是
②e装置中出现蓝色沉淀,铜电极发生的电极反应是
③f装置中可能出现的现象是
您最近一年使用:0次
名校
8 . 铜是生物必需的微量元素,也是人类最早使用的金属之一、铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式___________ 。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式___________ 。
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2,该反应的氧化剂是
6Cu+SO2,该反应的氧化剂是___________ ;当生成19.2gCu时,反应中转移的电子为___________ mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜),试写出上述过程中负极的电极反应式___________ 。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成,写出该反应的离子方程式___________ 。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为:I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol/L的Na2S2O3溶液VmL。则试样中CuSO4·5H 2O的质量分数为___________ 。
(1)写出铜与稀硝酸反应的化学方程式
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用,写出溶出铜的离子方程式
(3)工业上以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S
 6Cu+SO2,该反应的氧化剂是
6Cu+SO2,该反应的氧化剂是(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜诱的主要成分为Cu2(OH)2CO3(碱式碳酸铜),试写出上述过程中负极的电极反应式
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成,写出该反应的离子方程式
您最近一年使用:0次
9 . 对金属制品进行抗腐蚀处理可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

以铝材为阳极,在 溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
溶液中电解,铝材表面形成氧化膜,阳极电极反应式为_______ 。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是_______ 。
(3)利用下图装置可以模拟铁的两种电化学防护的方法:若X为碳棒,为减缓铁的腐蚀,开关K应置于_______ (填“M”或“N”)处。若X为锌,开关K置于_______ (同上)处,该电化学保护法称为_______ 。

(1)以下为铝材表面处理的一种方法:

以铝材为阳极,在
 溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
溶液中电解,铝材表面形成氧化膜,阳极电极反应式为(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是
(3)利用下图装置可以模拟铁的两种电化学防护的方法:若X为碳棒,为减缓铁的腐蚀,开关K应置于

您最近一年使用:0次
10 . 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一
(1)如图装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵溶液(显酸性)和食盐水,各加入生铁块,放置一段时间均被腐蚀。
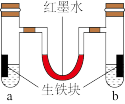
①红墨水柱两边的液面变为左低右高,则_______ (填“a”或“b”)试管内盛有食盐水。
②a试管中铁发生的是_______ (填“析氢”或“吸氧”)腐蚀,生铁中碳上发生的电极反应式为_______ 。
(2)钢铁表面常电镀一层铬(Cr)达到防腐蚀的目的,这是由于铬具有优良的抗腐蚀性能。电镀时,把待镀的金属制品与直流电源的_______ 极(填“正”或“负”)相连,把镀层金属铬作_______ 极(填“阳”或“阴”)。电镀铬时,不能用含有CrO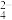 或Cr2O
或Cr2O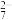 的溶液作电镀液,原因是
的溶液作电镀液,原因是_______ (用电极反应式表明原因)。
(3)利用如图装置,可以模拟铁的电化学保护。
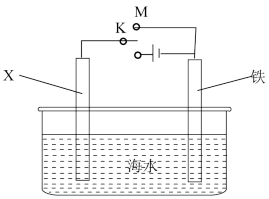
若X为碳棒,为减缓铁的腐蚀,开关K应置于N处,该电化学保护法称为_______ 若X为锌,开关K置于M处,铁棒上发生的电极反应式_______
(1)如图装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵溶液(显酸性)和食盐水,各加入生铁块,放置一段时间均被腐蚀。

①红墨水柱两边的液面变为左低右高,则
②a试管中铁发生的是
(2)钢铁表面常电镀一层铬(Cr)达到防腐蚀的目的,这是由于铬具有优良的抗腐蚀性能。电镀时,把待镀的金属制品与直流电源的
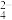 或Cr2O
或Cr2O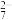 的溶液作电镀液,原因是
的溶液作电镀液,原因是(3)利用如图装置,可以模拟铁的电化学保护。

若X为碳棒,为减缓铁的腐蚀,开关K应置于N处,该电化学保护法称为
您最近一年使用:0次



