1 . 以NaCl为主要成分的融雪剂会腐蚀桥梁、铁轨等钢铁设备。某研究小组探究NaCl溶液对钢铁腐蚀的影响。
(1)将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、炭粉的混合物,贴在表面皿上。在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如图1所示。_____ ,炭粉的作用是_____ 。
②为了说明NaCl的作用,需要补充的对照实验是_____ 。
(2)向图2所示装置的烧杯a、b中各加入30mL3.5%的NaCl溶液,闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。取a、b中溶液少量,滴加 溶液,a中出现蓝色沉淀,b中无变化,b中铁片作
溶液,a中出现蓝色沉淀,b中无变化,b中铁片作_____ 极。外电路中电子流动方向为_____ (填“a→b”或“b→a”)。
实验Ⅱ中,b中电极发生的电极反应为_____ 。根据上述实验可知,对钢铁腐蚀有影响的因素是_____ 和NaCl溶液的浓度。
(1)将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、炭粉的混合物,贴在表面皿上。在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如图1所示。

②为了说明NaCl的作用,需要补充的对照实验是
(2)向图2所示装置的烧杯a、b中各加入30mL3.5%的NaCl溶液,闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。取a、b中溶液少量,滴加
 溶液,a中出现蓝色沉淀,b中无变化,b中铁片作
溶液,a中出现蓝色沉淀,b中无变化,b中铁片作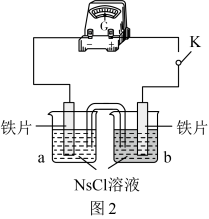
| 实验 | a | b | 指针偏转方向 |
| Ⅰ | 0.1% | 0.01% | 向右 |
| Ⅱ | 0.1% | 3.5% | 向左 |
您最近半年使用:0次
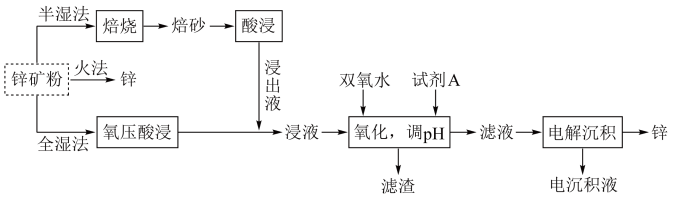
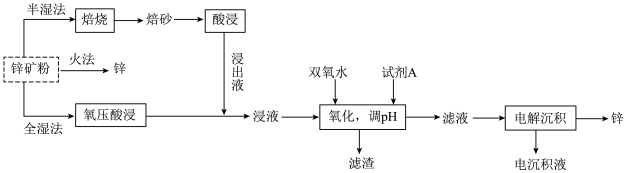
2 . 锌及锌合金(如黄铜、白口铁等)广泛用于生产、生活。某小组拟以锌矿(主要成分是ZnS,含少量FeS等杂质)为原料采用多种方法冶炼锌的流程如下:
已知: 是两性氢氧化物,易溶于
是两性氢氧化物,易溶于 溶液,也溶于氨水,能发生相关反应:
溶液,也溶于氨水,能发生相关反应: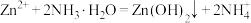 ,
,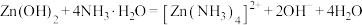 。
。
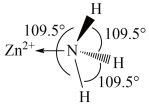
(1)已知 (结构如图所示)中
(结构如图所示)中 采用
采用 杂化,由此推知:
杂化,由此推知: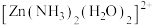 有
有___________ 种结构。NH3分子中键角为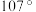 ,与
,与 中配体
中配体 键角不同的原因是
键角不同的原因是___________ 。
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载人一泥罐内,封裹泥固,……然后逐层用煤炭饼垫盛,其底铺薪,发火㲎红,……冷定毁罐取出。……即倭铅也。”(炉甘石主要成分是 ,倭铅即指
,倭铅即指 )。由此可知,古代炼锌方法类似上述三种方法中
)。由此可知,古代炼锌方法类似上述三种方法中___________ (填字母,下同)。
a.半湿法 b.火法 c.全湿法
上述三种方法中,最佳方法是___________ 。
(3)“氧压酸浸”即在一定浓度稀硫酸中加入锌矿粉,并在加压下通入 ,除生成
,除生成 外,还能回收非金属单质。写出主要反应的离子方程式:
外,还能回收非金属单质。写出主要反应的离子方程式:___________ 。
(4)若将“氧化、调 ”步骤改为直接用过量的
”步骤改为直接用过量的 或氨水进行除杂,该操作是否会对“电解沉积”过程造成影响,
或氨水进行除杂,该操作是否会对“电解沉积”过程造成影响,___________ (填“是”或“否”),请说明原因:___________ 。
(5)“电解沉积”(以情性材料为电极)中阳极反应式为___________ 。航母外壳常镶嵌一些锌块,这种保护航母的电化学方法叫___________ 。

已知:
 是两性氢氧化物,易溶于
是两性氢氧化物,易溶于 溶液,也溶于氨水,能发生相关反应:
溶液,也溶于氨水,能发生相关反应: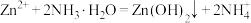 ,
,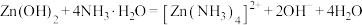 。
。(1)已知
 (结构如图所示)中
(结构如图所示)中 采用
采用 杂化,由此推知:
杂化,由此推知: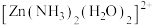 有
有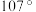 ,与
,与 中配体
中配体 键角不同的原因是
键角不同的原因是
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载人一泥罐内,封裹泥固,……然后逐层用煤炭饼垫盛,其底铺薪,发火㲎红,……冷定毁罐取出。……即倭铅也。”(炉甘石主要成分是
 ,倭铅即指
,倭铅即指 )。由此可知,古代炼锌方法类似上述三种方法中
)。由此可知,古代炼锌方法类似上述三种方法中a.半湿法 b.火法 c.全湿法
上述三种方法中,最佳方法是
(3)“氧压酸浸”即在一定浓度稀硫酸中加入锌矿粉,并在加压下通入
 ,除生成
,除生成 外,还能回收非金属单质。写出主要反应的离子方程式:
外,还能回收非金属单质。写出主要反应的离子方程式:(4)若将“氧化、调
 ”步骤改为直接用过量的
”步骤改为直接用过量的 或氨水进行除杂,该操作是否会对“电解沉积”过程造成影响,
或氨水进行除杂,该操作是否会对“电解沉积”过程造成影响,(5)“电解沉积”(以情性材料为电极)中阳极反应式为
您最近半年使用:0次
3 . 化学能与电能的相互转化在生产、生活中应用广泛。
(1)高铁电池因其具有众多的优点而成为电动汽车首选的动力电池,其工作原理为:3Zn+2K2FeO4+8H2O 3Zn (OH)2+4KOH+2Fe (OH)3. 则放电时正极的电极反应式为
3Zn (OH)2+4KOH+2Fe (OH)3. 则放电时正极的电极反应式为___________ ,充电时阴极附近溶液的pH___________ (填“增大”、“减小”、“不变”)。
(2)某公司开发出一种以Pt作电极的高效甲醇燃料电池,以该电池电解CuSO4溶液的装置如下图所示:

①工作时负极的电极反应式为___________ 。
②若乙池中Fe电极质量增加12.8g,在相同时间内,甲池中理论上消耗O2___________ L(标准状况下)。
③通电一段时间后,向所得溶液中加入0. 3molCu(OH)2后,恰好恢复到电解前的浓度和pH,则电解过程中转移电子的物质的量为___________ 。
(3)研究电化学腐蚀及防护的装置如图所示。
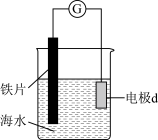
若电极d为石墨,写出此电极的反应式___________ 。
(1)高铁电池因其具有众多的优点而成为电动汽车首选的动力电池,其工作原理为:3Zn+2K2FeO4+8H2O
 3Zn (OH)2+4KOH+2Fe (OH)3. 则放电时正极的电极反应式为
3Zn (OH)2+4KOH+2Fe (OH)3. 则放电时正极的电极反应式为(2)某公司开发出一种以Pt作电极的高效甲醇燃料电池,以该电池电解CuSO4溶液的装置如下图所示:

①工作时负极的电极反应式为
②若乙池中Fe电极质量增加12.8g,在相同时间内,甲池中理论上消耗O2
③通电一段时间后,向所得溶液中加入0. 3molCu(OH)2后,恰好恢复到电解前的浓度和pH,则电解过程中转移电子的物质的量为
(3)研究电化学腐蚀及防护的装置如图所示。

若电极d为石墨,写出此电极的反应式
您最近半年使用:0次
名校
解题方法
4 . 回答下列问题:
(1)金属腐蚀是指金属与周围接触到的空气或液体发生
(2)金属腐蚀可分为
(3)金属发生电化学腐蚀时,可分为析氢腐蚀和 吸氧腐蚀。两者的本质相同,但正极反应不同,析氢腐蚀的正极反应为
(4)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。

①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中负极电极反应式为
②为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用
A.铜 B.钠 C.锌 D.石墨
③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的
您最近半年使用:0次
名校
解题方法
5 . 完成下列问题。
(1)下列状态的N原子或离子在跃迁时;用光谱仪可捕捉到发射光谱的是_______ 。
a. b.
b.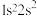 c.
c. d.
d.
(2)已知下图均与第三周期的主族元素有关。
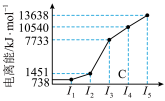
图甲
图甲表示第一至第五电离能数据,则该元素的原子有_______ 种不同运动状态的电子,基态原子未成对电子数为_______ 。
(3)以 燃料电池为电源电解法制取
燃料电池为电源电解法制取 ,二氧化氯(
,二氧化氯( )为一稀黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
)为一稀黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
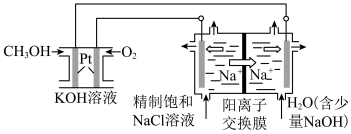
①图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ,阳极产生
,阳极产生 的反应式为
的反应式为_______ 。
②电解一段时间,从阴极处收集到的气体比阳极处收集到气体多1.12L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为_______ mol(精确到小数点后两位)。
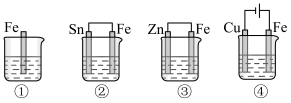
(4)下图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是_______。
(1)下列状态的N原子或离子在跃迁时;用光谱仪可捕捉到发射光谱的是
a.
 b.
b.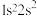 c.
c. d.
d.
(2)已知下图均与第三周期的主族元素有关。

图甲
图甲表示第一至第五电离能数据,则该元素的原子有
(3)以
 燃料电池为电源电解法制取
燃料电池为电源电解法制取 ,二氧化氯(
,二氧化氯( )为一稀黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
)为一稀黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
①图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取
 ,阳极产生
,阳极产生 的反应式为
的反应式为②电解一段时间,从阴极处收集到的气体比阳极处收集到气体多1.12L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为
(4)下图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是_______。

| A.④>②>③>① | B.②>①>③>④ | C.④>②>①>③ | D.③>②>④>① |
您最近半年使用:0次
名校
6 . 锌及锌合金(如黄铜)广泛应用于生产、生活。某小组拟以锌矿(主要成分是ZnS,含少量FeS等杂质)为原料采用多种方法冶炼锌,流程如图。回答下列问题:

已知:① 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应: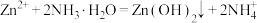 、
、
②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
(1)已知 中
中 采用
采用 杂化,则
杂化,则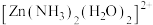 有
有___________ 种结构。
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,……然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定,毁罐取出。……即倭铅也。”(炉甘石主要成分是 ,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的
,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的___________ (填标号,下同)。从环保的角度来看,这三种方法中,最佳方法是___________ 。
a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为___________ 。
(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是___________ 。
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为___________ 。航母外壳常镶嵌一些锌块,这种保护航母的方法叫___________ 。
(6)通常认为离子浓度 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算
___________ 。

已知:①
 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应: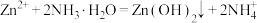 、
、
②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 6.5 | 9.7 |
 | 5.4 | 8.0 |
 | 2.3 | 4.1 |
 中
中 采用
采用 杂化,则
杂化,则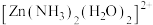 有
有(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,……然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定,毁罐取出。……即倭铅也。”(炉甘石主要成分是
 ,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的
,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入
 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为
(6)通常认为离子浓度
 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算
您最近半年使用:0次
7 . 电解尿素( )是一种低能耗制氢气的方法,工作原理如图:
)是一种低能耗制氢气的方法,工作原理如图:
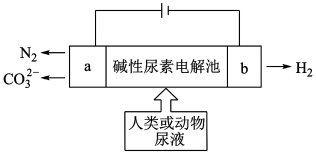
(1)溶液中 的移动方向为
的移动方向为___________ 。
A.a→b B.b→a
(2)写出b电极的电极方程式___________ 。
(3)已知尿素中C元素为+4价,一段时间后在a电极收集到标况下4.48L气体,则整个电路中转移的电子数为___________ 个。
(4)___________ 极的材料可用铁棒,
A.a B.b
且铁棒能够较长时间保持光亮不生锈,该防腐原理称为___________ 。
(5)若将电路中的电源换成导线,此时铁棒会逐渐被腐蚀,写出腐蚀过程中另一电极材料(石墨)上发生的电极方程式:___________ 。
(6)与铵态氮肥相比,写出施用尿素的两个优点:___________ 。
 )是一种低能耗制氢气的方法,工作原理如图:
)是一种低能耗制氢气的方法,工作原理如图:
(1)溶液中
 的移动方向为
的移动方向为A.a→b B.b→a
(2)写出b电极的电极方程式
(3)已知尿素中C元素为+4价,一段时间后在a电极收集到标况下4.48L气体,则整个电路中转移的电子数为
(4)
A.a B.b
且铁棒能够较长时间保持光亮不生锈,该防腐原理称为
(5)若将电路中的电源换成导线,此时铁棒会逐渐被腐蚀,写出腐蚀过程中另一电极材料(石墨)上发生的电极方程式:
(6)与铵态氮肥相比,写出施用尿素的两个优点:
您最近半年使用:0次
8 . 金属的腐蚀与防腐是科学研究的重点领域,现代防腐技术日益受到关注。回答下列问题:
(1)“经远舰”在海底多年,舰体腐蚀严重。舰体发生电化学腐蚀时,其正极的电极反应式为___________ (已知正常海水呈弱碱性);为保护舰体,科研人员提出将舰体与电源___________ (填“正极”或“负极”)相连,这种保护方法称为___________ 。
(2)金属铬具有优良的抗腐蚀性能。常在钢铁表面镀一层铬达到防腐的目的。一般电镀过程中,金属铬作为___________ (填“阳极”或“阴极”)材料。工业上常用沉淀法处理含 (橙色)和
(橙色)和 (黄色)的电镀废水,工艺流程如图所示:
(黄色)的电镀废水,工艺流程如图所示:
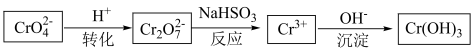
①“转化”过程存在平衡,下列能说明转化达到平衡状态的是___________ 。
A.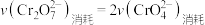 B.溶液颜色保持不变
B.溶液颜色保持不变
C. D.含铬微粒的总浓度保持不变
D.含铬微粒的总浓度保持不变
②“反应”过程中发生反应的离子方程式为___________ 。
③“沉淀”过程中,室温下当 恰好沉淀完全时,溶液的pH=
恰好沉淀完全时,溶液的pH=___________ 。(已知: ,c(Cr3+)≤10-5mol/L时沉淀完全)
,c(Cr3+)≤10-5mol/L时沉淀完全)
(3)钼酸钠和苯并三氮䂳(BTA)的混合液常作为碳钢的缓蚀剂。常温下,碳钢在不同浓度的硫酸和缓蚀剂介质中的腐蚀速率[单位: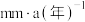 ]数据如图所示。
]数据如图所示。
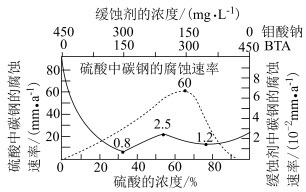
①要使碳钢的缓蚀效果最优,钼酸钠和BTA的浓度比应为___________ 。
②硫酸中碳钢的最高腐蚀速率和缓蚀剂中碳钢的最低腐蚀速率之比为___________ 。
(1)“经远舰”在海底多年,舰体腐蚀严重。舰体发生电化学腐蚀时,其正极的电极反应式为
(2)金属铬具有优良的抗腐蚀性能。常在钢铁表面镀一层铬达到防腐的目的。一般电镀过程中,金属铬作为
 (橙色)和
(橙色)和 (黄色)的电镀废水,工艺流程如图所示:
(黄色)的电镀废水,工艺流程如图所示:
①“转化”过程存在平衡,下列能说明转化达到平衡状态的是
A.
 B.溶液颜色保持不变
B.溶液颜色保持不变C.
 D.含铬微粒的总浓度保持不变
D.含铬微粒的总浓度保持不变②“反应”过程中发生反应的离子方程式为
③“沉淀”过程中,室温下当
 恰好沉淀完全时,溶液的pH=
恰好沉淀完全时,溶液的pH= ,c(Cr3+)≤10-5mol/L时沉淀完全)
,c(Cr3+)≤10-5mol/L时沉淀完全)(3)钼酸钠和苯并三氮䂳(BTA)的混合液常作为碳钢的缓蚀剂。常温下,碳钢在不同浓度的硫酸和缓蚀剂介质中的腐蚀速率[单位:
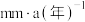 ]数据如图所示。
]数据如图所示。
①要使碳钢的缓蚀效果最优,钼酸钠和BTA的浓度比应为
②硫酸中碳钢的最高腐蚀速率和缓蚀剂中碳钢的最低腐蚀速率之比为
您最近半年使用:0次
9 . 锌及锌合金(如黄铜)广泛应用于生产、生活。某小组拟以锌矿(主要成分是ZnS,含少量FeS等杂质)为原料采用多种方法冶炼锌,流程如图。回答下列问题:
已知:① 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
 ,
,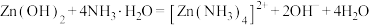 。
。
②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
(1) 中Zn的化合价为
中Zn的化合价为______ 价。
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,……然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红,……冷定,毁罐取出。……即倭铅也。”(炉甘石主要成分是 ,倭铅即指Zn)
,倭铅即指Zn)
古代炼锌方法类似于上述三种方法中的______ (填标号,下同)。从环保的角度来看,这三种方法中,最佳方法是______ 。
a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为____________ 。
(4)“氧化,调pH”时试剂A为______ (填化学式);试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是____________ 。
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为______ 。航母外壳常镶嵌一些锌块,这种保护航母的方法叫______ 。
(6)通常认为离子浓度 mol⋅L
mol⋅L 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算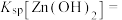
______ 。

已知:①
 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
 ,
, 。
。②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 6.5 | 9.7 |
 | 5.4 | 8.0 |
 | 2.3 | 4.1 |
(1)
 中Zn的化合价为
中Zn的化合价为(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,……然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红,……冷定,毁罐取出。……即倭铅也。”(炉甘石主要成分是
 ,倭铅即指Zn)
,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的
a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入
 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为(4)“氧化,调pH”时试剂A为
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为
(6)通常认为离子浓度
 mol⋅L
mol⋅L 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算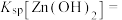
您最近半年使用:0次
名校
解题方法
10 . 如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
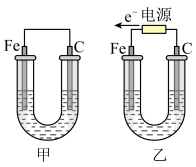
(1)若两装置中均为 溶液,反应一段时间后:
溶液,反应一段时间后:
①有红色物质析出的是甲装置中的___________ 棒,乙装置中的___________ 棒。
②乙装置的电化学防护法称为___________ ,其中碳极的电极反应式是:___________ 。
③取少量甲装置中负极附近溶液加入2滴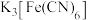 溶液,现象为
溶液,现象为___________ ,生成沉淀的化学式为___________ 。
(2)若两装置中均为饱和 溶液:
溶液:
①写出乙装置中总反应的离子方程式:___________ 。
②将湿润的淀粉 试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因
试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因___________ 。
(3)用惰性电极电解(电解质足量)下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来完全一样的是___________。
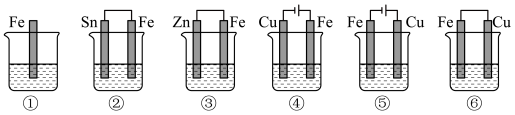
(4)下列各容器中盛有海水,则铁被腐蚀的速率由快到慢的顺序___________ 。

(1)若两装置中均为
 溶液,反应一段时间后:
溶液,反应一段时间后:①有红色物质析出的是甲装置中的
②乙装置的电化学防护法称为
③取少量甲装置中负极附近溶液加入2滴
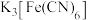 溶液,现象为
溶液,现象为(2)若两装置中均为饱和
 溶液:
溶液:①写出乙装置中总反应的离子方程式:
②将湿润的淀粉
 试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因
试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因(3)用惰性电极电解(电解质足量)下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来完全一样的是___________。
A. | B. | C. | D.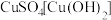 |
(4)下列各容器中盛有海水,则铁被腐蚀的速率由快到慢的顺序

您最近半年使用:0次



