解题方法
1 . 利用如图装置,可以模拟铁的电化学防护。
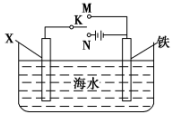
(1)若 为铜,为减缓铁的腐蚀,开关
为铜,为减缓铁的腐蚀,开关 应置于
应置于 _______ 处,铁棒上发生的电极反应为 _______ ,该种防护方法称为 _______ 。
(2)若 为锌棒,开关
为锌棒,开关 置于
置于 _______ 处,铁棒上的电极反应为 _______ 该电化学防护法称为 _______ 。

(1)若
 为铜,为减缓铁的腐蚀,开关
为铜,为减缓铁的腐蚀,开关 应置于
应置于 (2)若
 为锌棒,开关
为锌棒,开关 置于
置于
您最近一年使用:0次
2 . 某课外活动小组用如图装置进行实验,试回答下列问题:
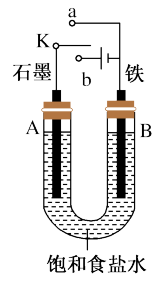
(1)若开始时开关K与a连接,B极的Fe发生_______ 腐蚀(填“析氢”或“吸氧”)。
(2)若开始时开关K与b连接,下列说法正确的是_______ (填序号)。
① 溶液中Na+向A极移动
② 从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③ 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④ 若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

① 该电解槽的阳极反应式为_______ ,此时通过阴离子交换膜的离子数_______ (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
② 制得的氢氧化钾溶液从出口_______ (填“A”“B”“C”或“D”)导出。
(4)用惰性电极电解体积为1L的CuSO4溶液,当阴阳极都产生3.36L(标况)气体时,请问硫酸铜的浓度为_______ ,若要此溶液恢复到原状态需要加入_______ (填选项)。
ACuSO4 BCuO CCu(OH)2 DCu2(OH)2CO3

(1)若开始时开关K与a连接,B极的Fe发生
(2)若开始时开关K与b连接,下列说法正确的是
① 溶液中Na+向A极移动
② 从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③ 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④ 若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

① 该电解槽的阳极反应式为
② 制得的氢氧化钾溶液从出口
(4)用惰性电极电解体积为1L的CuSO4溶液,当阴阳极都产生3.36L(标况)气体时,请问硫酸铜的浓度为
ACuSO4 BCuO CCu(OH)2 DCu2(OH)2CO3
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题
(1)下列事实中,与电化学腐蚀无关的是_______
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
(2)以石墨为电极,电解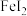 溶液,阳极电极反应式为
溶液,阳极电极反应式为_______ 。
(3)利用反应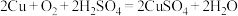 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应式为
,若将该反应设计为原电池,其正极电极反应式为_______ 。
(4)利用人工光合作用可将 转化为甲酸,反应原理为
转化为甲酸,反应原理为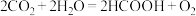 ,装置如图所示:
,装置如图所示:
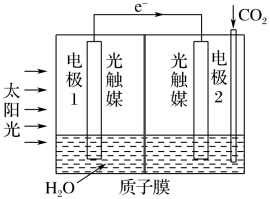
电极2的电极反应式是_______ ;
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、 和
和 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的_______ 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______ 。
(6)已知 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)开始时:
均为石墨电极)开始时: 棒电极反应式
棒电极反应式_______ ,当电流表_______ 时,反应达到化学平衡状态。
(1)下列事实中,与电化学腐蚀无关的是
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
(2)以石墨为电极,电解
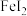 溶液,阳极电极反应式为
溶液,阳极电极反应式为(3)利用反应
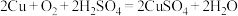 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应式为
,若将该反应设计为原电池,其正极电极反应式为(4)利用人工光合作用可将
 转化为甲酸,反应原理为
转化为甲酸,反应原理为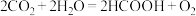 ,装置如图所示:
,装置如图所示:
电极2的电极反应式是
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、
 和
和 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的(6)已知
 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)开始时:
均为石墨电极)开始时: 棒电极反应式
棒电极反应式
您最近一年使用:0次
名校
4 . 应用电化学原理,解决下列问题:

(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,即可观察到的现象是_____ ,表明铁被氧化。
(2)装置2中的石墨是_____ 极(填“正”或“负”),该装置发生的总反应的离子方程式为_____ 。
(3)装置3中甲烧杯盛放100mL0.2mol/L的NaCl溶液,乙烧杯盛放100mL0.5mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,回答下列问题:
①甲烧杯中铁电极的电极反应为_____ 。
②乙烧杯中电解反应的离子方程式为_____ 。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体(标准状况下)体积为_____ mL。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,即可观察到的现象是
(2)装置2中的石墨是
(3)装置3中甲烧杯盛放100mL0.2mol/L的NaCl溶液,乙烧杯盛放100mL0.5mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,回答下列问题:
①甲烧杯中铁电极的电极反应为
②乙烧杯中电解反应的离子方程式为
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体(标准状况下)体积为
您最近一年使用:0次
5 . 我们周围很多物品是由各种各样的材料做成的,金属、陶瓷和塑料是生活中最常用的材料。
(1)氮化硅是一种高温陶瓷材料,它硬度大、熔点高、化学性质稳定,根据上述性质推测氮化硅陶瓷的用途是_______ (填字母)。
A.制汽轮机叶片 B.制包装材料 C.制人造骨骼 D.制柴油机
现用四氯化硅和氮气在氢气气氛的保护下,加强热发生反应,可获得较高纯度的氮化硅,同时生成一种酸,反应的化学方程式为_______ 。
(2)“白口铁”(铁外面镀一层锌)和“马口铁”(铁外面镀一层锡)是日常生活中两种常见的铁制品,以下为两种铁制品的腐蚀情况:
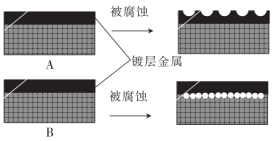
请分别写出A、B两种铁制品的名称及腐蚀时负极的电极反应式:
A:_______ ,负极:_______ 。
B:_______ ,负极:_______ 。
(3)目前我国建筑节能(建筑保温)领域中用于建筑物外墙保温材料主要是聚苯板,用它作外墙材料符合低碳生活。以下为聚苯板基础材料的结构片断:
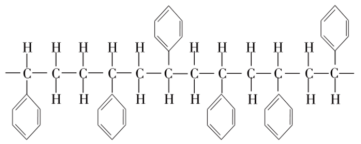
用于合成聚苯板基础材料的有机小分子(单体)是_______ (填结构简式),该合成反应的反应类型为_______ 。
(1)氮化硅是一种高温陶瓷材料,它硬度大、熔点高、化学性质稳定,根据上述性质推测氮化硅陶瓷的用途是
A.制汽轮机叶片 B.制包装材料 C.制人造骨骼 D.制柴油机
现用四氯化硅和氮气在氢气气氛的保护下,加强热发生反应,可获得较高纯度的氮化硅,同时生成一种酸,反应的化学方程式为
(2)“白口铁”(铁外面镀一层锌)和“马口铁”(铁外面镀一层锡)是日常生活中两种常见的铁制品,以下为两种铁制品的腐蚀情况:

请分别写出A、B两种铁制品的名称及腐蚀时负极的电极反应式:
A:
B:
(3)目前我国建筑节能(建筑保温)领域中用于建筑物外墙保温材料主要是聚苯板,用它作外墙材料符合低碳生活。以下为聚苯板基础材料的结构片断:

用于合成聚苯板基础材料的有机小分子(单体)是
您最近一年使用:0次
6 . 材料是人类赖以生存和发展的重要物质基础。
(1)下列材料中属于合金的是_____ (填字母代号,下同):属下复合材料的是_____ ;属于纤维的是_____ 。
a.腈纶 b.玻璃钢 c.青铜 d.塑料
(2)生产普通玻璃的主要原料是石灰石、石英砂和_____ 。
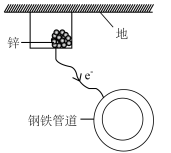
(3)用牺牲金属锌的方法来防止地下钢铁管道的腐蚀(如图所示),则钢铁管道作_____ 极,负极的电极反应电极方程为_____ 。
(1)下列材料中属于合金的是
a.腈纶 b.玻璃钢 c.青铜 d.塑料
(2)生产普通玻璃的主要原料是石灰石、石英砂和
(3)用牺牲金属锌的方法来防止地下钢铁管道的腐蚀(如图所示),则钢铁管道作

您最近一年使用:0次
2023-01-07更新
|
193次组卷
|
2卷引用:2021年河南省普通高中学生学业水平考试化学试题
名校
7 . 钢铁腐蚀现象在生产、生活中普遍存在,也是科学研究的关注点之一
(1)碳钢管发生电化学腐蚀是因为形成了原电池,其负极的电极反应式为_______ 。
(2)外加电流的阴极保护法是防止钢铁腐蚀的常用方法之一,该方法中,需将被保护的碳钢管与直流电源的_______ (填“正极”或“负极”)相连。
(3)在铁制品表面镀锌可防止铁制品被腐蚀,镀锌层即使局部破损,仍可防止破损部位被腐蚀,原因是_______ 。
(4)研究人员就大气环境对碳钢腐蚀的影响进行了研究。其中,A、B两个城市的气候环境和碳钢腐蚀速率数据如下:
①研究人员认为,A、B两城市中碳钢同时发生吸氧腐蚀和析氢腐蚀。碳钢发生析氢腐蚀时,正极的电极反应式为_______ 。
②结合化学用语解释A、B两城市中碳钢能发生析氢腐蚀的原因:_______ 。
③用电化学原理分析B城市碳钢腐蚀速率高于A城市的主要原因:_______ 。
(1)碳钢管发生电化学腐蚀是因为形成了原电池,其负极的电极反应式为
(2)外加电流的阴极保护法是防止钢铁腐蚀的常用方法之一,该方法中,需将被保护的碳钢管与直流电源的
(3)在铁制品表面镀锌可防止铁制品被腐蚀,镀锌层即使局部破损,仍可防止破损部位被腐蚀,原因是
(4)研究人员就大气环境对碳钢腐蚀的影响进行了研究。其中,A、B两个城市的气候环境和碳钢腐蚀速率数据如下:
| 城市 | 年均温度℃ | 年均湿度% |  的浓度( 的浓度(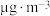 ) ) | 大气 沉积速率( 沉积速率( ) ) | 腐蚀速率(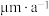 ) ) |
| A | 17.0 | 76 | 61 | 29 | 58 |
| B | 12.3 | 72 | 54 | 420 | 79 |
②结合化学用语解释A、B两城市中碳钢能发生析氢腐蚀的原因:
③用电化学原理分析B城市碳钢腐蚀速率高于A城市的主要原因:
您最近一年使用:0次
2023-01-06更新
|
485次组卷
|
4卷引用:北京海淀区2022-2023学年高二上学期期末考试化学试题
解题方法
8 . 根据所学电化学知识填空。
(1)如图为锌铜原电池的装置示意图,其中盐桥内装有含饱和KCl溶液的琼胶。请回答下列问题:
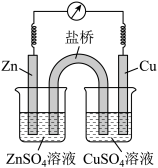
①Zn电极为电池的______ (填“正极”或“负极”)。
②写出电极反应式:Zn电极______ ,Cu电极______ 。
③盐桥中向CuSO4溶液中迁移的离子是______ (填离子符号)。
(2)金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答下列问题:
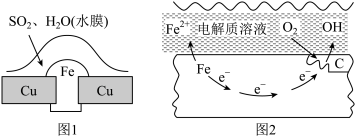
①图1中被腐蚀的金属为______ (填化学式);图2中金属腐蚀类型属于______ (填字母)。
A.化学腐蚀 B.析氢腐蚀 C.吸氧腐蚀
②图1中Cu的作用是______ (填“负极”或“正极”)。
③图2中铁的生锈过程中正极反应式为______ 。
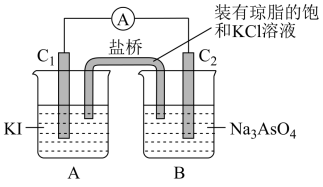
(1)如图为锌铜原电池的装置示意图,其中盐桥内装有含饱和KCl溶液的琼胶。请回答下列问题:

①Zn电极为电池的
②写出电极反应式:Zn电极
③盐桥中向CuSO4溶液中迁移的离子是
(2)金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答下列问题:

①图1中被腐蚀的金属为
A.化学腐蚀 B.析氢腐蚀 C.吸氧腐蚀
②图1中Cu的作用是
③图2中铁的生锈过程中正极反应式为
您最近一年使用:0次
9 . 如图装置中,小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片。实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。
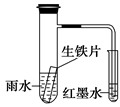
(1)开始时,生铁发生_____ 腐蚀,负极反应式为______ 。
(2)一段时间后,生铁发生______ 腐蚀,正极反应式为______ ,具支试管内雨水的pH的变化情况为_____ ,最后生铁片表面形成红棕色铁锈(Fe2O3•xH2O),那么后期溶液中发生的反应方程式有______ 、2Fe(OH)3=Fe2O3•xH2O+(3-x)H2O。

(1)开始时,生铁发生
(2)一段时间后,生铁发生
您最近一年使用:0次
名校
解题方法
10 . 对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)镀铜可防止铁制品腐蚀,电镀时用铜作阳极,阳极电极方程式是:_______ 。在此过程中,两个电极上质量的变化值:阴极_______ 阳极(填“>”“<”或“=”)。
(2)利用如图所示的装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于_______ (填“M”或“N”)处。若X为锌,开关K置于M处,该电化学防护法称为_______ 。
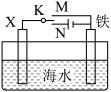
(1)镀铜可防止铁制品腐蚀,电镀时用铜作阳极,阳极电极方程式是:
(2)利用如图所示的装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于

您最近一年使用:0次



