名校
解题方法
1 . 研究青铜器在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生腐蚀的原理示意图。下列说法错误的是
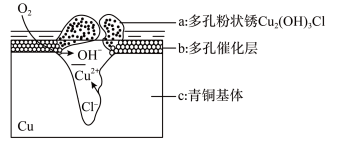
| A.青铜器在潮湿环境中发生腐蚀的主要原因是构成了原电池 |
| B.青铜器在干燥环境中的腐蚀速率较潮湿环境慢 |
C.O2参与的反应为: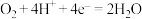 |
D.环境中的Cl-与正负极的产物形成a的离子方程式为: |
您最近一年使用:0次
名校
2 . 结合如图装置判断,下列叙述正确的是
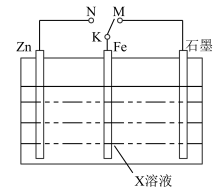
A.若X为NaCl,K与M相连时,石墨电极反应为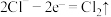 |
| B.若X为硫酸,K与M相连时,Fe作负极受到保护 |
C.若X为硫酸,K与N相连时,溶液中 向Fe电极移动 向Fe电极移动 |
| D.若X为NaCl,K与N相连时,Fe电极上会有灰绿色沉淀生成,最终变为红褐色 |
您最近一年使用:0次
2023-07-18更新
|
174次组卷
|
2卷引用:上海市上海中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
3 . 化学与我们的生活息息相关,下列说法不正确的是
| A.喷油漆、涂油脂、电镀或金属表面钝化,都是金属防护的物理方法 |
| B.在轮船外壳上镶入锌块可减缓船体的腐蚀速率 |
C.泡沫灭火器原理:Al3++3HCO =Al(OH)3↓+3CO2↑ =Al(OH)3↓+3CO2↑ |
| D.使用纯碱溶液清洗餐具比使用洗涤剂更环保 |
您最近一年使用:0次
名校
解题方法
4 . 潮湿土壤中的铁管道在硫酸盐还原菌(最佳生存环境 为7~8)作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示。下列说法错误的是
为7~8)作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示。下列说法错误的是
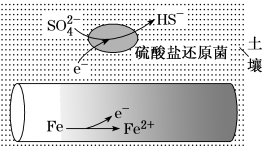
 为7~8)作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示。下列说法错误的是
为7~8)作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示。下列说法错误的是
| A.铁作负极发生氧化反应 |
B.正极反应为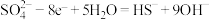 |
| C.将管道连接废锌块可防止腐蚀 |
| D.酸性环境下铁管道不易被硫酸根腐蚀 |
您最近一年使用:0次
2022-07-07更新
|
824次组卷
|
5卷引用:山东省潍坊2021-2022学年高一下学期期末测试化学试题
解题方法
5 . 工业废水中的六价铬[Cr(VI)]常采用还原沉淀法、离子交换法和微生物法等方法进行处理。
(1)室温下,含Cr(VI)的微粒在水溶液中存在如下平衡:
H2CrO4⇌H++HCrO ΔH1
ΔH1
HCrO ⇌H++CrO
⇌H++CrO ΔH2
ΔH2
2HCrO ⇌
⇌ +H2O ΔH3
+H2O ΔH3
室温下,反应2CrO +2H+⇌
+2H+⇌ +H2O的ΔH=
+H2O的ΔH=_______ (用含ΔH1、ΔH2或ΔH3的代数式表示)。
(2)还原沉淀法:使用Na2SO3将Cr(VI)还原为Cr3+,再将Cr3+转化为沉淀除去。
①酸性条件下Cr(VI)具有很强的氧化能力, 将
将 还原为Cr3+的离子方程式为
还原为Cr3+的离子方程式为_______ 。
②其他条件相同,用Na2SO3处理不同初始pH的含Cr(VI)废水相同时间,当pH<2时,Cr(VI)的去除率随pH降低而降低的原因是_______ 。
(3)微生物法:
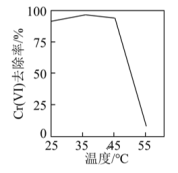
①用硫酸盐还原菌(SRB)处理含Cr(VI)废水时,Cr(VI)去除率随温度的变化如图所示。55℃时,Cr(VI)的去除率很低的原因是_______ 。
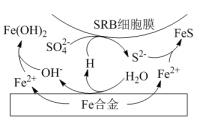
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+,_______ 。
(4)离子交换法:用强碱性离子交换树脂(ROH)与 和HCrO
和HCrO 等发生离子交换,交换过程中发生如下反应:
等发生离子交换,交换过程中发生如下反应:
ROH(s)+HCrO (aq)⇌ RHCrO4(s)+OH-(aq)
(aq)⇌ RHCrO4(s)+OH-(aq)
2ROH(s)+ (aq)⇌ R2CrO4(s)+2OH-(aq)
(aq)⇌ R2CrO4(s)+2OH-(aq)
其他条件相同,当pH>4时,Cr(VI)去除率随pH升高而下降的原因是_______ 。
(1)室温下,含Cr(VI)的微粒在水溶液中存在如下平衡:
H2CrO4⇌H++HCrO
 ΔH1
ΔH1HCrO
 ⇌H++CrO
⇌H++CrO ΔH2
ΔH22HCrO
 ⇌
⇌ +H2O ΔH3
+H2O ΔH3室温下,反应2CrO
 +2H+⇌
+2H+⇌ +H2O的ΔH=
+H2O的ΔH=(2)还原沉淀法:使用Na2SO3将Cr(VI)还原为Cr3+,再将Cr3+转化为沉淀除去。
①酸性条件下Cr(VI)具有很强的氧化能力,
 将
将 还原为Cr3+的离子方程式为
还原为Cr3+的离子方程式为②其他条件相同,用Na2SO3处理不同初始pH的含Cr(VI)废水相同时间,当pH<2时,Cr(VI)的去除率随pH降低而降低的原因是
(3)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(VI)废水时,Cr(VI)去除率随温度的变化如图所示。55℃时,Cr(VI)的去除率很低的原因是

②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+,

(4)离子交换法:用强碱性离子交换树脂(ROH)与
 和HCrO
和HCrO 等发生离子交换,交换过程中发生如下反应:
等发生离子交换,交换过程中发生如下反应:ROH(s)+HCrO
 (aq)⇌ RHCrO4(s)+OH-(aq)
(aq)⇌ RHCrO4(s)+OH-(aq)2ROH(s)+
 (aq)⇌ R2CrO4(s)+2OH-(aq)
(aq)⇌ R2CrO4(s)+2OH-(aq)其他条件相同,当pH>4时,Cr(VI)去除率随pH升高而下降的原因是
您最近一年使用:0次
6 . 铁的腐蚀与防护与生产生活密切相关。
Ⅰ.研究铁的腐蚀
实验步骤如下:
步骤1:将铁粉放置于0.002
 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。
步骤2:向15.00 mL 1 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。
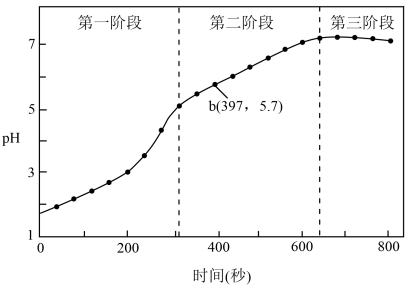
(1)第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为___________ 。
(2)第二、三阶段主要发生吸氧腐蚀。
①选取b点进行分析,经检验溶液中含有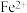 ,写出Fe被腐蚀的总反应
,写出Fe被腐蚀的总反应___________ 。
②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。写出b点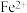 被氧化的离子方程式
被氧化的离子方程式___________ 。
③依据b点发生的反应,分析第二阶段pH上升的原因是___________ 。
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知: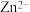 放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
①镀件Fe应与电源的___________ 相连。
②向 电解液中加入NaCN溶液,将
电解液中加入NaCN溶液,将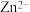 转化为
转化为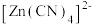 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是___________ 。
(4)电镀后的废水中含有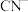 ,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c
,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c 
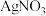 溶液滴定,消耗
溶液滴定,消耗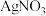 溶液V mL。已知:
溶液V mL。已知: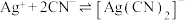 (无色)
(无色) 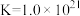 ,
,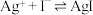
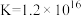 。
。
①滴定终点的现象是___________ 。
②废水中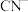 的含量是
的含量是___________  (填计算式)。
(填计算式)。
Ⅰ.研究铁的腐蚀
实验步骤如下:
步骤1:将铁粉放置于0.002

 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。步骤2:向15.00 mL 1
 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。步骤3:采集溶液pH随时间变化的数据。

(1)第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为
(2)第二、三阶段主要发生吸氧腐蚀。
①选取b点进行分析,经检验溶液中含有
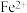 ,写出Fe被腐蚀的总反应
,写出Fe被腐蚀的总反应②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。写出b点
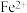 被氧化的离子方程式
被氧化的离子方程式③依据b点发生的反应,分析第二阶段pH上升的原因是
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知:
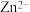 放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。①镀件Fe应与电源的
②向
 电解液中加入NaCN溶液,将
电解液中加入NaCN溶液,将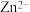 转化为
转化为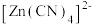 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是(4)电镀后的废水中含有
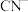 ,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c
,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c 
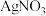 溶液滴定,消耗
溶液滴定,消耗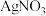 溶液V mL。已知:
溶液V mL。已知: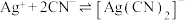 (无色)
(无色) 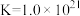 ,
,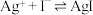
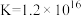 。
。①滴定终点的现象是
②废水中
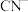 的含量是
的含量是 (填计算式)。
(填计算式)。
您最近一年使用:0次
2022-03-25更新
|
730次组卷
|
5卷引用:北京市丰台区2022届高三一模化学试题
名校
7 . 下列离子方程式书写不正确 的是
| A.钢铁发生吸氧腐蚀的总反应:2Fe + O2 + 2H2O = 2Fe(OH)2 |
B.用铁作阳极电解饱和食盐水:2Cl—+ 2H2O 2OH— + Cl2↑ + H2↑ 2OH— + Cl2↑ + H2↑ |
C.向多元弱酸H3PO4中加入过量烧碱:H3PO4 + 3OH— = PO + 3H2O + 3H2O |
D.向ZnS沉淀中滴加CuSO4溶液可得到CuS沉淀:Cu2+(aq) + ZnS(s)  CuS(s) + Zn2+(aq) CuS(s) + Zn2+(aq) |
您最近一年使用:0次
2022-01-21更新
|
191次组卷
|
2卷引用:浙江省温州市2021-2022学年高二上学期期末教学质量统一检测化学试题
名校
解题方法
8 . 关于下列各装置图的叙述错误的是
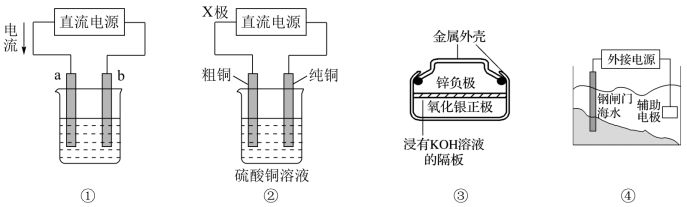
| A.图①装置用于实现铁上镀铜,a极为铜,b极为铁 |
| B.图②装置中的X极若为负极,则该装置可实现粗铜的精炼 |
C.图③装置中正极的电极反应式为: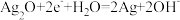 |
| D.图④装置中钢闸门应与外接电源的负极相连以实现外加电流的保护 |
您最近一年使用:0次
2021-07-09更新
|
1073次组卷
|
10卷引用:四川省南充市2020-2021学年高二下学期期末考试化学试题
四川省南充市2020-2021学年高二下学期期末考试化学试题(已下线)1.3.2 金属的电化学防护-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)第4章 化学反应与电能(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)甘肃省永昌县第一高级中学2021-2022学年高二上学期期中考试化学(理)试题宁夏永宁县永宁中学2021-2022学年高二上学期期末考试化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题福建省连城县第一中学2022-2023学年高二上学期月考(一)化学试题河北省石家庄市第四十二中学2022-2023高二上学期10月月考化学试题内蒙古自治区包头市第九中学2022-2023学年高二上学期期末考试化学试题陕西省西安市蓝田县乡镇学校联考2023-2024学年高二上学期1月期末化学试题
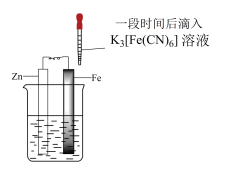
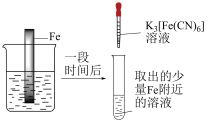
9 . 验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
下列说法不正确 的是
| ① | ② | ③ |
|
|
|
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
| A.对比②③,可以判定Zn保护了Fe |
| B.对比①②,K3[Fe(CN)6]可能将Fe氧化 |
| C.验证Zn保护Fe时不能用①的方法 |
| D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼 |
您最近一年使用:0次
2018-06-09更新
|
11568次组卷
|
78卷引用:2018年全国普通高等学校招生统一考试化学(北京卷)
2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题11 化学实验基础安徽省阜阳市第三中学竞培中心2017-2018学年高一年级第二学期第三次调研考试化学试题【全国百强校】河南省信阳市高级中学2018-2019学年高二上学期10月月考化学试题1(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)浙江省东阳中学2018-2019学年高一下学期期中考试化学试题四川省攀枝花市2018-2019学年高二下学期期末调研检测化学试题四川省树德中学2020届高三11月月考化学试题(已下线)【南昌新东方】江西省南昌市第三中学2019-2020学年度高三上学期11月月考化学试题四川省成都市龙泉第二中学2019-2020学年高三上学期1月月考理科综合化学试题(已下线)专题十 化学能与电能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训江西省宜春市宜丰县宜丰中学2019-2020学年高二下学期开学考试化学试题(已下线)专题6.3 电解池 金属的腐蚀与防护(练)——2020年高考化学一轮复习讲练测江西省宜春市2020届高三5月模拟理科综合-化学试题(已下线)专题6.3 电解池 金属的腐蚀与防护(讲)——2020年高考化学一轮复习讲练测北京市通州区2019-2020学年高二下学期期末考试化学试题河南省驻马店市2018-2019学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第4节 金属的腐蚀与防护高中必刷题高二选择性必修1第四章 化学反应与电能 第四章素养检测河南省漯河市临颍县南街高级中学2020届高三阶段性测试化学试题人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第三节 金属的腐蚀与防护1(已下线)第21讲 电解池 金属的电化学腐蚀与防护 (精讲)——2021年高考化学一轮复习讲练测人教版(2019)高二化学选择性必修1第四章 化学反应与电能 过高考 3年真题强化闯关(已下线)第四章 化学反应与电能(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)河南省郑州市郑州中学2020-2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP406】【化学】河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研化学试题(已下线)小题必刷26 电解池原理及其应用——2021年高考化学一轮复习小题必刷(通用版本)福建省平和县第一中学2021届高三年上学期第二次月考化学试题江苏省泰州中学2020-2021学年高二上学期期中考试化学试题(已下线)练习16 金属的电化学腐蚀-2020-2021学年【补习教材·寒假作业】高二化学(人教版)辽宁省丹东市2020-2021学年高二上学期期末考试化学试题甘肃省陇南市徽县第二中学2020-2021学年高二上学期期末考试化学试题四川省三台中学实验学校2020-2021学年高二下学期开学考试理综化学试题陕西省咸阳市2021届高考五月检测三模理综化学试题(已下线)课时34 金属的腐蚀与防护-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点22 电解池 金属的腐蚀与防护-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第17讲 电解池 金属的腐蚀与防护(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)江苏省泰州中学2021-2022学年高二上学期第一次月度检测化学试题山东省实验中学2022届高三第一次诊断考试化学试题河南省南阳市第一中学校2021-2022学年高二上学期第二次月考化学试题福建省厦门市厦门双十中学2021-2022学年上学期期中考试化学试题山东省泰安第二中学2021-2022学年高二上学期期中考试化学试题(已下线)4.3 金属的腐蚀和防护-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)河南省重点高中2021-2022学年高二上学期阶段性调研联考二化学试题河南省中原名校联盟2021-2022学年高二上学期第三次适应性联考化学试题(已下线)2020年江苏卷化学高考真题变式题11-15山东省济南外国语学校2021-2022学年高三上学期11月月考化学试题黑龙江省牡丹江市第三高级中学2021-2022学年高三上学期第四次月考化学试题北京师范大学附属中学2021-2022学年高二上学期期末考试化学试题广东省东莞市七校2021-2022学年高二下学期期中联考化学试题山东省泰安市泰安一中2021-2022学年高一下学期6月学情诊断化学试题(已下线)考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点18 原电池 化学电源-备战2023年高考化学一轮复习考点帮(全国通用)重庆市西南大学附属中学校2021-2022学年高一广延班下学期期末考试化学试题内蒙古包头市第四中学2021-2022学年高二上学期期中考试化学试题(已下线)第17讲 电解池 金属的腐蚀与防护 (练)-2023年高考化学一轮复习讲练测(新教材新高考)北京市清华大学附属中学2022-2023学年高二上学期期中考试化学试题山东省枣庄市第三中学(实验班)2022-2023学年高二11月线上测试化学试题河南省洛阳市2022-2023学年高二上学期期末考试化学试题(已下线)题型107 电化学原理在金属防腐蚀中的应用辽宁省凌源市高中2022-2023学年高二下学期3月联考化学试题(已下线)专题六 金属的化学腐蚀与防护(练习)天津市第一中学2022-2023学年高二上学期期末考试化学试题作业(二十六) 金属的腐蚀与防护云南省普洱市第一中学2022-2023学年高二下学期期末考试化学试题第四章 化学反应与电能 第三节 金属的腐蚀与防护山东省泰安新泰市第一中学(实验部)2023-2024学年高二上学期第一次质量检测化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题(已下线)不定项选择题福建省泉州市泉港区第一中学2023-2024学年高二上学期12月月考化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题山东省百师联盟2023-2024学年高二上学期12月大联考化学试题 陕西省安康市2023-2024学年高二上学期12月联考化学试题
10 . Ⅰ.如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中.

(1)仅K1闭合,石墨棒周围溶液pH升高,其电极反应式为___________________ .
(2)仅K2闭合,在铁棒附近滴加酚酞显红色,理由是______________________ (用平衡移动原理解释).
(3)仅K2闭合,发生总反应的离子方程式为________________________________ .
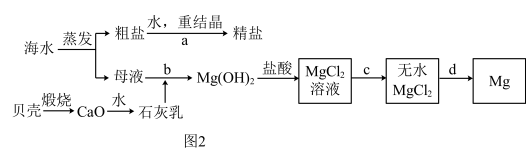
Ⅱ. 海水的综合利用可以制备金属镁和精盐,其流程如图所示:
(1)步骤a中,溶解、过滤、蒸发三个阶段都要用到的一种玻璃仪器是________ .
(2)为使母液中的Mg2+完全转化为Mg(OH)2(离子浓度小于10﹣5mol•L﹣1时,沉淀就达完全),步骤b中溶液的pH至少要控制在___________ .(常温下,Mg(OH)2的Ksp=1×10﹣11)
(3)步骤c必须在氯化氢气体的氛围中加热蒸发才能完成,试用化学方程式表示在无氯化氢的情况下不能生成无水MgCl2的原理_________________________________ .
(4)完成步骤d的化学方程式____________________________ .


(1)仅K1闭合,石墨棒周围溶液pH升高,其电极反应式为
(2)仅K2闭合,在铁棒附近滴加酚酞显红色,理由是
(3)仅K2闭合,发生总反应的离子方程式为
Ⅱ. 海水的综合利用可以制备金属镁和精盐,其流程如图所示:
(1)步骤a中,溶解、过滤、蒸发三个阶段都要用到的一种玻璃仪器是
(2)为使母液中的Mg2+完全转化为Mg(OH)2(离子浓度小于10﹣5mol•L﹣1时,沉淀就达完全),步骤b中溶液的pH至少要控制在
(3)步骤c必须在氯化氢气体的氛围中加热蒸发才能完成,试用化学方程式表示在无氯化氢的情况下不能生成无水MgCl2的原理
(4)完成步骤d的化学方程式
您最近一年使用:0次