名校
解题方法
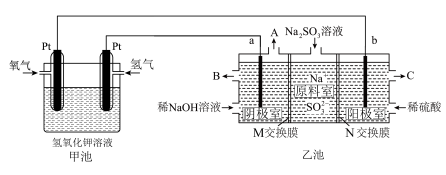
1 . 工业上常用 溶液除去烟气中的
溶液除去烟气中的 ,某小组设计如图所示装置(a、b电极均为石墨),对除硫后产物
,某小组设计如图所示装置(a、b电极均为石墨),对除硫后产物 溶液进行电解,制得
溶液进行电解,制得 和循环再生
和循环再生 。
。_______ 极(填“正”或“负”),写出通入氢气的电极反应式_______ 。
(2)①乙池中阳极室 口流出的是较浓的
口流出的是较浓的 ,则
,则 为
为_______ (填“阳”或“阴”)离子交换膜,写出阳极室的电极反应式_______ 。
②阴极室中 溶液浓度增大的原因是:阴极室中水电离出的
溶液浓度增大的原因是:阴极室中水电离出的_______ (用离子符号或化学式填空,下同)得电子反应生成_______ ,其浓度减小,使溶液中_______ 浓度增大,为了保持阴极室溶液中阴阳离子电荷平衡,_______ 从原料室向阴极室迁移,从而使阴极室中 的浓度增大。
的浓度增大。
(3)在标准状况下,若甲池中有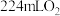 参加反应,理论上乙池可生成
参加反应,理论上乙池可生成_______ 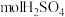 。
。
(4)比能量是指参与反应单位质量的电极材料所能输出电能的多少,电池输出电能与反应的电子转移数目成正比。理论上, 与
与 均作负极时,它们的比能量之比为
均作负极时,它们的比能量之比为_______ 。
 溶液除去烟气中的
溶液除去烟气中的 ,某小组设计如图所示装置(a、b电极均为石墨),对除硫后产物
,某小组设计如图所示装置(a、b电极均为石墨),对除硫后产物 溶液进行电解,制得
溶液进行电解,制得 和循环再生
和循环再生 。
。
(2)①乙池中阳极室
 口流出的是较浓的
口流出的是较浓的 ,则
,则 为
为②阴极室中
 溶液浓度增大的原因是:阴极室中水电离出的
溶液浓度增大的原因是:阴极室中水电离出的 的浓度增大。
的浓度增大。(3)在标准状况下,若甲池中有
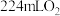 参加反应,理论上乙池可生成
参加反应,理论上乙池可生成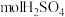 。
。(4)比能量是指参与反应单位质量的电极材料所能输出电能的多少,电池输出电能与反应的电子转移数目成正比。理论上,
 与
与 均作负极时,它们的比能量之比为
均作负极时,它们的比能量之比为
您最近一年使用:0次
2024-01-21更新
|
165次组卷
|
2卷引用:广东省深圳市光明区2023-2024学年高二上学期1月期末学业水平调研化学试题
2 . 暖贴的主要成分有铁粉、水、食盐、活性炭、吸水性树脂等,下列说法正确的是
| A.暖贴工作时发生了析氢腐蚀 |
B.负极反应式: |
C.暖贴使用后铁粉最终转化为 |
| D.食盐是电解质,活性炭作正极材料 |
您最近一年使用:0次
21-22高一·全国·假期作业
名校
3 . 按要求回答下列问题:
(1)已知H2和O2反应时放热,且断裂1molH-H键、1molO=O键、1molO-H键需要吸收的能量分别为Q1kJ、Q2kJ、Q3kJ。下列关系一定正确的是_________。
(2)下列变化中满足如图图示的是_________ (填选项字母)。
A镁和稀盐酸的反应 B.Ba(OH)2•8H2O与NH4Cl的反应 C.氯化铵固体加入水中 D.氢气燃烧 E.H-O-H→2H+O
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为_________ (填选项字母)。
A铝片、铜片 B.铜片、铝片 C.铝片、铝片
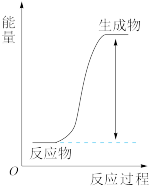
(4)2020年上海进博会展览中,诸多氢能源汽车纷纷亮相。氢燃料电池被誉为氢能源汽车的心脏。某种氢燃料电池的内部结构如图所示,a 处通入气体的是_________ ,左侧的电极为电池的_________ (填“正极”或“负极”), 右侧电极发生的反应为:_________ 。
(1)已知H2和O2反应时放热,且断裂1molH-H键、1molO=O键、1molO-H键需要吸收的能量分别为Q1kJ、Q2kJ、Q3kJ。下列关系一定正确的是_________。
| A.Q1+Q2>Q3 | B.2Q1+Q2>2Q3 | C.2Q1+Q2<4Q3 | D.2Q1+Q2>4Q3 |

A镁和稀盐酸的反应 B.Ba(OH)2•8H2O与NH4Cl的反应 C.氯化铵固体加入水中 D.氢气燃烧 E.H-O-H→2H+O
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A铝片、铜片 B.铜片、铝片 C.铝片、铝片
(4)2020年上海进博会展览中,诸多氢能源汽车纷纷亮相。氢燃料电池被誉为氢能源汽车的心脏。某种氢燃料电池的内部结构如图所示,a 处通入气体的是

您最近一年使用:0次
名校
解题方法
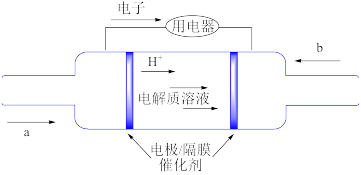
4 . 我国科学家设计的一种甲酸(HCOOH)燃料电池如下图所示(半透膜只允许K+、H+通过),下列说法错误的是

| A.物质A可以是硫酸氢钾 |
B.左侧为电池负极,HCOO-发生氧化反应生成 |
C.该燃料电池的总反应为: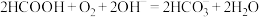 |
| D.右侧每消耗11.2 LO2(标况),左侧有1 mol K+通过半透膜移向右侧 |
您最近一年使用:0次
2022-02-05更新
|
429次组卷
|
3卷引用:广东省华南师范大学附属中学2022届高三下学期押题预测(三)化学试题
名校
解题方法
5 . 由铁氰化钾和亚铁氰化钾混合溶液组成的电池体系是一种研究较多的热电化学电池,其放电原理如图所示,将两个电极置于温度不同的电解液环境中,电极之间便可以形成电势差。下列说法正确的是

| A.热端电极为负极,发生还原反应 |
B.放电一段时间后,Fe(CN) 浓度增大,Fe(CN) 浓度增大,Fe(CN) 浓度减小 浓度减小 |
C.冷端电极上发生反应Fe(CN) +e-=FeCN) +e-=FeCN) |
| D.反应过程中,K+向热端电极扩散 |
您最近一年使用:0次
2024-09-18更新
|
225次组卷
|
3卷引用:广东省多校2025届高三上学期摸底联考化学试题
6 . 2022年冬奥会期间,我国使用了铁-铬液流电池作为备用电源,其工作原理如图示。已知充电时 被还原,下列说法不正确的是
被还原,下列说法不正确的是
 被还原,下列说法不正确的是
被还原,下列说法不正确的是
| A.放电时,a极电极电势低于b极 |
B.充电时,a极的电极反应式为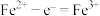 |
C.充电时,若有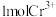 被还原,则电池中有 被还原,则电池中有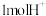 由左向右移动 由左向右移动 |
D.若用该电池做电源给镀件镀铜,镀件增重 时,理论上有 时,理论上有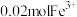 被还原 被还原 |
您最近一年使用:0次
2024-05-28更新
|
388次组卷
|
3卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
解题方法
7 . 高铁酸钾( )是一种强氧化剂,可作为水处理剂和高容量电池材料,由
)是一种强氧化剂,可作为水处理剂和高容量电池材料,由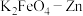 可组成碱性电池。下列关于该电池的说法中正确的是
可组成碱性电池。下列关于该电池的说法中正确的是
 )是一种强氧化剂,可作为水处理剂和高容量电池材料,由
)是一种强氧化剂,可作为水处理剂和高容量电池材料,由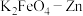 可组成碱性电池。下列关于该电池的说法中正确的是
可组成碱性电池。下列关于该电池的说法中正确的是A.Zn为负极, 为正极 为正极 |
| B.工作时将电能转为化学能 |
| C.工作时碱性物质(如KOH)没有发挥作用 |
| D.阴离子由负极迁移到正极 |
您最近一年使用:0次
名校
解题方法
8 . 请回答下列问题:
(1)I氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
已知:①N2(g)+O2(g)= 2NO(g) △H1 =+ 180.5kJ/mol
②2NO(g)+ O2(B) = 2NO2(g) △H2 = - 114.14kJ/mol
③3NO(g) = N2O(g)+ NO2(g) △H3 = -115.52kJ/mol
则反应:2N2O(g) = 2N2(g)+ O2(g) △H =___________ kJ/mol
II.依据氧化还原反应:2Ag+(aq)+ Cu(s)= Cu2+(aq)+ 2Ag(s)设计的原电池如图所示。请回答下列问题:
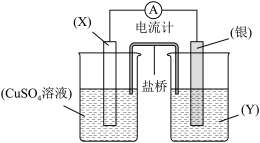
(2)电极X的材料是___________ ;电解质溶液Y是 ___________ ;
(3)银电极为电池的___________ 极,发生的电极反应为___________ ;X电极上发生的电极反应为 ___________ ;
III.锂锰电池的体积小,性能优良,是常用的一次电池,该电池的反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入 MnO2晶格中,生成LiMnO2。回答下列问题:
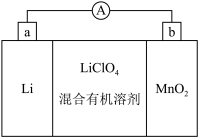
(4)电池正极反应式为___________ 。
(5)是否可用水代替电池中的混合有机溶剂?___________ (填“是”或“否”),原因是: ___________ 。
(6)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为___ 。
(1)I氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
已知:①N2(g)+O2(g)= 2NO(g) △H1 =+ 180.5kJ/mol
②2NO(g)+ O2(B) = 2NO2(g) △H2 = - 114.14kJ/mol
③3NO(g) = N2O(g)+ NO2(g) △H3 = -115.52kJ/mol
则反应:2N2O(g) = 2N2(g)+ O2(g) △H =
II.依据氧化还原反应:2Ag+(aq)+ Cu(s)= Cu2+(aq)+ 2Ag(s)设计的原电池如图所示。请回答下列问题:

(2)电极X的材料是
(3)银电极为电池的
III.锂锰电池的体积小,性能优良,是常用的一次电池,该电池的反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入 MnO2晶格中,生成LiMnO2。回答下列问题:

(4)电池正极反应式为
(5)是否可用水代替电池中的混合有机溶剂?
(6)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为
您最近一年使用:0次
解题方法
9 . 新型化学电池Zn- 、能量密度大、体积小、重量轻、寿命长、无污染。下列关于其放电时的说法错误的是
、能量密度大、体积小、重量轻、寿命长、无污染。下列关于其放电时的说法错误的是
 、能量密度大、体积小、重量轻、寿命长、无污染。下列关于其放电时的说法错误的是
、能量密度大、体积小、重量轻、寿命长、无污染。下列关于其放电时的说法错误的是| A.负极发生失电子的氧化反应 | B.将化学能转化为电能 |
C. 在正极得电子 在正极得电子 | D.阳离子向负极移动 |
您最近一年使用:0次
2022-03-02更新
|
276次组卷
|
4卷引用:广东省茂名市五校联盟2021-2022学年高三下学期第三次联考化学试卷
广东省茂名市五校联盟2021-2022学年高三下学期第三次联考化学试卷(已下线)押广东卷化学第9题 原电池-备战2022年高考化学临考题号押题(广东卷)(已下线)专题15 原电池-备战2023年高考化学母题题源解密(广东卷)广东省珠海市六校联考2023-2024学年高一下学期4月期中考试化学试题
名校
10 . 回答下列问题
(1)依据反应: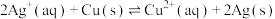 设计的原电池如下图甲所示。
设计的原电池如下图甲所示。
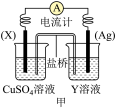
①电极 的材料是
的材料是_______ ;Y溶液可以是_______ ;
②银电极上发生的电极反应式是_______ , 电极上发生的电极反应为
电极上发生的电极反应为_______ 反应(填“氧化”或“还原”);外电路中的电子_______ (填“流出”或“流向”)Ag电极。
(2)次磷酸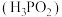 是一种精细化工产品,已知
是一种精细化工产品,已知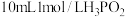 与
与 的
的 溶液充分反应后生成组成为
溶液充分反应后生成组成为 的盐,则:
的盐,则:
①次磷酸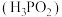 属于
属于_______ (填“一元酸”“二元酸”或“无法确定”)。
②设计实验方案,证明次磷酸是弱酸:_______ 。
(3)某课外兴趣小组用 的
的 标准溶液滴定未知浓度的盐酸溶液,实验操作如下,请完成以下问题。
标准溶液滴定未知浓度的盐酸溶液,实验操作如下,请完成以下问题。
①该小组同学选用酚酞做指示剂,滴定终点的现象为_______ 。
②该小组某一次滴定操作中,酸式滴定管的始终液面如图所示,则本次滴入的盐酸体积为_______  。
。
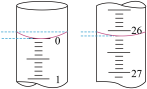
③下列操作中,可能使所测盐酸溶液的浓度值偏低的是_______
A.碱式滴定管末用标准氢氧化钠溶液润洗就直接注入标准溶液
B.碱式滴定管在滴定前有气泡,滴定后气泡消失
C.读取氢氧化钠体积时,滴定结束时俯视读数
D.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
(1)依据反应:
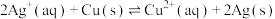 设计的原电池如下图甲所示。
设计的原电池如下图甲所示。
①电极
 的材料是
的材料是②银电极上发生的电极反应式是
 电极上发生的电极反应为
电极上发生的电极反应为(2)次磷酸
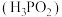 是一种精细化工产品,已知
是一种精细化工产品,已知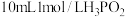 与
与 的
的 溶液充分反应后生成组成为
溶液充分反应后生成组成为 的盐,则:
的盐,则:①次磷酸
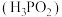 属于
属于②设计实验方案,证明次磷酸是弱酸:
(3)某课外兴趣小组用
 的
的 标准溶液滴定未知浓度的盐酸溶液,实验操作如下,请完成以下问题。
标准溶液滴定未知浓度的盐酸溶液,实验操作如下,请完成以下问题。①该小组同学选用酚酞做指示剂,滴定终点的现象为
②该小组某一次滴定操作中,酸式滴定管的始终液面如图所示,则本次滴入的盐酸体积为
 。
。
③下列操作中,可能使所测盐酸溶液的浓度值偏低的是
A.碱式滴定管末用标准氢氧化钠溶液润洗就直接注入标准溶液
B.碱式滴定管在滴定前有气泡,滴定后气泡消失
C.读取氢氧化钠体积时,滴定结束时俯视读数
D.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
您最近一年使用:0次
2023-01-08更新
|
185次组卷
|
2卷引用:广东省广州中学2022-2023学年高二上学期期末考试化学试题



