解题方法
1 . 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。
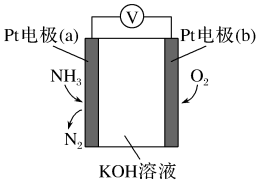
(1)Pt电极(a)为_______ 极(填“正”或“负”);
(2)Pt电极(b)上发生的反应为_______ (填“氧化”或“还原”)反应。
(3)该过程总反应的化学反应方程式为_______ 。

(1)Pt电极(a)为
(2)Pt电极(b)上发生的反应为
(3)该过程总反应的化学反应方程式为
您最近一年使用:0次
解题方法
2 . 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是
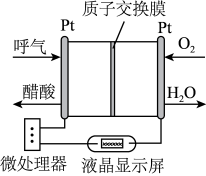

| A.电流由O2所在的铂电极经外电路流向另一电极 |
| B.O2所在的铂电极处发生氧化反应 |
C.该电池的负极反应式为 |
| D.微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
您最近一年使用:0次
名校
3 .  是汽车尾气中的主要污染物之一、通过
是汽车尾气中的主要污染物之一、通过 传感器可监测
传感器可监测 的含量,其工作原理如图所示。下列说法正确的是
的含量,其工作原理如图所示。下列说法正确的是
 是汽车尾气中的主要污染物之一、通过
是汽车尾气中的主要污染物之一、通过 传感器可监测
传感器可监测 的含量,其工作原理如图所示。下列说法正确的是
的含量,其工作原理如图所示。下列说法正确的是
A. 电极作负极, 电极作负极, 电极作正极 电极作正极 |
B. 电极上发生的是氧化反应 电极上发生的是氧化反应 |
C. 电极上发生的是还原反应 电极上发生的是还原反应 |
D. 电极的电极反应式为 电极的电极反应式为 |
您最近一年使用:0次
解题方法
4 . 一定温度下,在体积为2.0L的恒容密闭容器中, 和
和 之间发生反应:
之间发生反应: (红棕色)
(红棕色)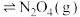 (无色),反应过程中各物质的物质的量与时间的关系如图所示,回答下列问题:
(无色),反应过程中各物质的物质的量与时间的关系如图所示,回答下列问题:
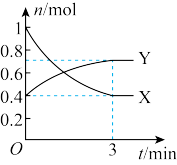
(1)曲线_______ (填“X”或“Y”)表示 的物质的量随时间的变化曲线。
的物质的量随时间的变化曲线。
(2)在0~3min内,用 表示的反应速率为
表示的反应速率为_______ 。
(3)下列叙述能说明该反应已达到化学平衡状态的是_______(填字母)。
(4)反应达到平衡后,若降低温度,混合气体的颜色变浅,相对于降温前v(正)_______ (填“增大”“减小”或“不变”,下同),v(逆)_______ 。
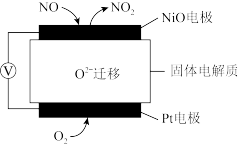
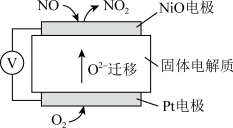
(5)氮氧化物是重要的大气污染物,如上图是监测NO含量的传感器工作原理示意图。NiO电极发生_______ (填“氧化”或“还原“)反应,Pt电极是电池_______ (填“正极”或“负极”)。
 和
和 之间发生反应:
之间发生反应: (红棕色)
(红棕色)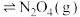 (无色),反应过程中各物质的物质的量与时间的关系如图所示,回答下列问题:
(无色),反应过程中各物质的物质的量与时间的关系如图所示,回答下列问题:
(1)曲线
 的物质的量随时间的变化曲线。
的物质的量随时间的变化曲线。(2)在0~3min内,用
 表示的反应速率为
表示的反应速率为(3)下列叙述能说明该反应已达到化学平衡状态的是_______(填字母)。
| A.容器内压强不再发生变化 |
B. 的颜色不再发生变化 的颜色不再发生变化 |
| C.容器内原子总数不再发生变化 |
D.相同时间内消耗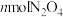 的同时生成 的同时生成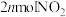 |

(5)氮氧化物是重要的大气污染物,如上图是监测NO含量的传感器工作原理示意图。NiO电极发生
您最近一年使用:0次
解题方法
5 . 化学反应速率和限度与生产、生活密切相关。
Ⅰ.用纯净的锌粒与稀盐酸反应制取氢气,请回答:
(1)实验过程如图所示,分析判断_______ 段化学反应速率最快(答“O~E”、“E~F”或“F~G”)。
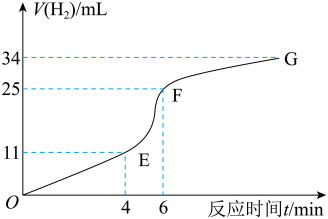
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生 的速率逐渐加快,其原因是
的速率逐渐加快,其原因是_______ 。
Ⅱ.一定温度下,在体积为0.5L的恒容密闭容器中, 和之间发生反应:
和之间发生反应: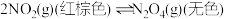 ,反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:
,反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:
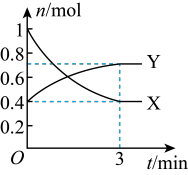
(3)曲线_______ (填“X”或“Y”)表示 的物质的量随时间的变化曲线。
的物质的量随时间的变化曲线。
(4)在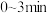 内,用
内,用 表示的反应速率为
表示的反应速率为_______ 。
(5)若在一绝热(不与外界发生热交换)容器中加入一定量 ,反应一段时间后,混合气体温度升高,说明
,反应一段时间后,混合气体温度升高,说明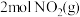 的能量比
的能量比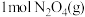 的能量
的能量_______ (填“高”或“低)。
(6)下列叙述能说明该反应已达到化学平衡状态的是_______ (填标号)。
A.容器内压强不再发生变化
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.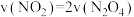
E.相同时间内消耗nmol的Y的同时消耗2nmol的X
(7)氮氧化物是重要的大气污染物,如图是监测NO含量的传感器工作原理示意图。NiO电极为_______ 极(填“正”或“负”)。

Ⅰ.用纯净的锌粒与稀盐酸反应制取氢气,请回答:
(1)实验过程如图所示,分析判断

(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生
 的速率逐渐加快,其原因是
的速率逐渐加快,其原因是Ⅱ.一定温度下,在体积为0.5L的恒容密闭容器中,
 和之间发生反应:
和之间发生反应: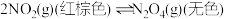 ,反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:
,反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:
(3)曲线
 的物质的量随时间的变化曲线。
的物质的量随时间的变化曲线。(4)在
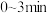 内,用
内,用 表示的反应速率为
表示的反应速率为(5)若在一绝热(不与外界发生热交换)容器中加入一定量
 ,反应一段时间后,混合气体温度升高,说明
,反应一段时间后,混合气体温度升高,说明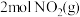 的能量比
的能量比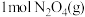 的能量
的能量(6)下列叙述能说明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.
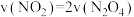
E.相同时间内消耗nmol的Y的同时消耗2nmol的X
(7)氮氧化物是重要的大气污染物,如图是监测NO含量的传感器工作原理示意图。NiO电极为

您最近一年使用:0次
解题方法
6 . “碳呼吸”电池原理如图所示,电解质溶液为含C2O 的盐溶液,电池总反应为2Al+6CO2=Al2(C2O4)3。下列有关说法错误的是
的盐溶液,电池总反应为2Al+6CO2=Al2(C2O4)3。下列有关说法错误的是

 的盐溶液,电池总反应为2Al+6CO2=Al2(C2O4)3。下列有关说法错误的是
的盐溶液,电池总反应为2Al+6CO2=Al2(C2O4)3。下列有关说法错误的是
| A.Al作负极 |
| B.气体A中CO2含量比空气中低 |
C.负极反应式为2CO2+2e-=C2O |
| D.每生成1molAl2(C2O4)3,消耗负极材料的质量为54g |
您最近一年使用:0次
名校
7 . 尿液燃料电池是一种微生物燃料电池,可利用微生物的新陈代谢将有机物转化为无污染气体,同时将化学能转换成电能。利用这种燃料电池既能去除工业废水中的尿素[CO(NH2)2],又能发电。其工作原理如图所示,微生物附着在多孔碳电极上。___________ (填“正极”或“负极”),其电极反应式为___________ ,电子从___________ (填“甲电极”或“乙电极”)流出。
(2)电池工作时,若交换膜为阴离子交换膜,则溶液中SO 经过交换膜的移动方向为
经过交换膜的移动方向为___________ (填“由左室移向右室”或“由右室移向左室”);若交换膜为阳离子交换膜,当有 通过交换膜时,消耗的尿素为
通过交换膜时,消耗的尿素为___________ g。
(3)该电池中发生反应的总化学方程式为___________ ,该电池不能在高温条件下工作的原因是___________ 。
(4)假设工业废水中含有9g/L的尿素,向电解装置中盛装1L工业废水,一段时间后消耗了4.48L氧气(标准状况下),此时,废水中尿素的含量___________ (填“达到”或“未达到”)排放标准(10mg/L),因为废水中尿素的含量为___________ g/L。

(2)电池工作时,若交换膜为阴离子交换膜,则溶液中SO
 经过交换膜的移动方向为
经过交换膜的移动方向为 通过交换膜时,消耗的尿素为
通过交换膜时,消耗的尿素为(3)该电池中发生反应的总化学方程式为
(4)假设工业废水中含有9g/L的尿素,向电解装置中盛装1L工业废水,一段时间后消耗了4.48L氧气(标准状况下),此时,废水中尿素的含量
您最近一年使用:0次
2022-01-21更新
|
108次组卷
|
3卷引用:山西省吕梁市2021-2022学年高二上学期期末考试化学试题
名校
8 . 原电池原理在生产生活中有着广泛的应用。
(1)食品保鲜常用的“双吸剂”是由还原铁粉、生石灰、氯化钠、炭粉按一定比例组成的混合物,可同时吸收水和氧气。“双吸剂”中CaO的主要作用是___________ ;在吸收氧气的过程中形成了原电池,则炭粉上发生的电极反应式为___________ 。
(2)电化学气敏传感器可用于监测大气环境中的SO2含量,其工作原理如图所示,电极a、b均为惰性电极。电极b是___________ 极(填“正”或“负”),请写出负极的电极反应式___________ ,放电时 向
向___________ 极(填“a”或“b”)迁移。

(3)铅蓄电池是一种广泛使用的二次电池,其放电时的反应方程式为: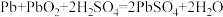 ,则其正极的电极反应式为
,则其正极的电极反应式为___________ ,当电路中通过2mol电子时负极质量增加___________ g。
(1)食品保鲜常用的“双吸剂”是由还原铁粉、生石灰、氯化钠、炭粉按一定比例组成的混合物,可同时吸收水和氧气。“双吸剂”中CaO的主要作用是
(2)电化学气敏传感器可用于监测大气环境中的SO2含量,其工作原理如图所示,电极a、b均为惰性电极。电极b是
 向
向
(3)铅蓄电池是一种广泛使用的二次电池,其放电时的反应方程式为:
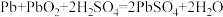 ,则其正极的电极反应式为
,则其正极的电极反应式为
您最近一年使用:0次
2021-12-25更新
|
478次组卷
|
2卷引用:四川省成都市蓉城名校联盟2021-2022学年高二上学期期末联考化学试题
名校
9 . 一定温度下,在体积为0.5L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色) N2O4(g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:
N2O4(g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:

(1)曲线___ (填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线。
(2)在0~3min内,用NO2表示的反应速率为___ 。
(3)若在一保温容器中加入一定量NO2,反应一段时间后,混合气体温度升高,说明2molNO2(g)的能量比1mol N2O4(g)的能量___ (填“高”或“低”)。
(4)反应达到平衡后,若降低温度,混合气体的颜色变浅,相对于降温前v(正)___ (填“增大”“减小”或“不变”,下同),v(逆)___ 。
(5)氮氧化物是重要的大气污染物,如图是监测NO含量的传感器工作原理示意图。NiO电极发生___ (填“氧化”或“还原”)反应,Pt电极是电池___ (填“正极”或“负极”)。

 N2O4(g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:
N2O4(g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:
(1)曲线
(2)在0~3min内,用NO2表示的反应速率为
(3)若在一保温容器中加入一定量NO2,反应一段时间后,混合气体温度升高,说明2molNO2(g)的能量比1mol N2O4(g)的能量
(4)反应达到平衡后,若降低温度,混合气体的颜色变浅,相对于降温前v(正)
(5)氮氧化物是重要的大气污染物,如图是监测NO含量的传感器工作原理示意图。NiO电极发生

您最近一年使用:0次
2021-10-10更新
|
333次组卷
|
2卷引用:广东省茂名高州市2020-2021学年高一下学期期末考试化学试题
名校
10 . 执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法错误的是
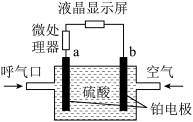
| A.呼出气体中酒精含量越高,微处理器中通过的电流越大 |
| B.b为正极,电极反应式为O2+2H2O+4e-=4OH- |
| C.电解质溶液中的H+移向b电极 |
| D.a极上的电极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+ |
您最近一年使用:0次



