名校
解题方法
1 . CH3OH、CO、CH4等都是重要的能源,也是重要的化工原料。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
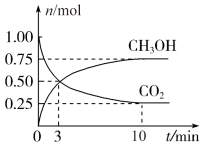
①从反应开始到平衡,CO2的平均反应速率v(CO2)=____ 。
②达到平衡时,H2的浓度为____ mol/L。
(2)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是____ 。
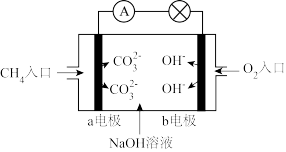
(3)某种甲烷燃料电池的工作原理如图所示氧气通入的一极为电源的____ 极,a电极反应式:____ ,b电极反应式:____ 。
(4)当电路中累计有2 mol电子通过时,消耗的甲烷体积为(在标准状况下)____ L。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②达到平衡时,H2的浓度为
(2)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是| A.反应中CO与CH3OH的物质的量之比为1:1 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |
(4)当电路中累计有2 mol电子通过时,消耗的甲烷体积为(在标准状况下)

您最近半年使用:0次
2022-05-12更新
|
427次组卷
|
3卷引用:河南省南阳市2021-2022学年高一下学期期中质量评估化学试题
名校
解题方法
2 . 根据题中提供的信息,请回答下列问题:
(1)学习原电池原理后,小江同学根据反应 设计了一个原电池并得到老师的肯定,则小江同学选用的负极材料是
设计了一个原电池并得到老师的肯定,则小江同学选用的负极材料是______ ,正极材料可能是______ (填一种)。
(2)小河同学设计了如图所示的原电池,利用不同的电解质溶液进行实验。______ 。
②当以NaOH溶液作为电解质溶液时,电流表指针也发生了偏转,若负极失去1mol电子,理论上负极的质量变化为______ g。
(3)燃料电池是一种高效化学电池,以稀硫酸为电解质溶液的氢氧燃料电池的工作原理如图所示,a和b都是Pt电极(惰性电极)。______ 。
②该电池工作时,电解质溶液中 的移动方向是
的移动方向是______ 。(填“a向b”或“b向a”,下同),外电路中电子的流动方向是______ 。
③若将a极通入的气体换为 ,同时将电解质溶液换为NaOH溶液,则a极的电极反应式为
,同时将电解质溶液换为NaOH溶液,则a极的电极反应式为______ 。当a极有1mol 发生反应时,理论上b极参加反应的氧气在标准状况下的体积为
发生反应时,理论上b极参加反应的氧气在标准状况下的体积为______ L。
(4)小海同学在做氢气的制备实验时,用锌粒和稀硫酸为原料,结果发现反应速率较慢。其他同学给出以下建议,其中能加快制备 的反应速率的有______(填字母)。
的反应速率的有______(填字母)。
(1)学习原电池原理后,小江同学根据反应
 设计了一个原电池并得到老师的肯定,则小江同学选用的负极材料是
设计了一个原电池并得到老师的肯定,则小江同学选用的负极材料是(2)小河同学设计了如图所示的原电池,利用不同的电解质溶液进行实验。

②当以NaOH溶液作为电解质溶液时,电流表指针也发生了偏转,若负极失去1mol电子,理论上负极的质量变化为
(3)燃料电池是一种高效化学电池,以稀硫酸为电解质溶液的氢氧燃料电池的工作原理如图所示,a和b都是Pt电极(惰性电极)。

②该电池工作时,电解质溶液中
 的移动方向是
的移动方向是③若将a极通入的气体换为
 ,同时将电解质溶液换为NaOH溶液,则a极的电极反应式为
,同时将电解质溶液换为NaOH溶液,则a极的电极反应式为 发生反应时,理论上b极参加反应的氧气在标准状况下的体积为
发生反应时,理论上b极参加反应的氧气在标准状况下的体积为(4)小海同学在做氢气的制备实验时,用锌粒和稀硫酸为原料,结果发现反应速率较慢。其他同学给出以下建议,其中能加快制备
 的反应速率的有______(填字母)。
的反应速率的有______(填字母)。| A.将稀硫酸换成质量分数为98%的浓硫酸 | B.向反应液中滴入几滴硫酸铜溶液 |
| C.改换合适的装置并适当加热 | D.将锌粒换成质量相等的锌粉 |
您最近半年使用:0次
3 .  的排放与燃烧化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
的排放与燃烧化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝
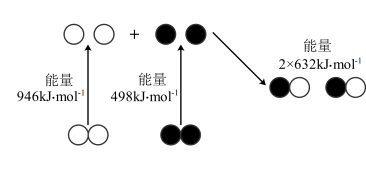
(1)汽车尾气中 生成过程中的能量变化如图所示。
生成过程中的能量变化如图所示。 和
和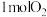 完全反应生成NO会吸收
完全反应生成NO会吸收___________  的能量。
的能量。
(2) 催化还原氮氧化物(SCR)技术是目前应用最广泛的脱硝技术,用Fe做催化剂时,在氨气足量的情况下,不同
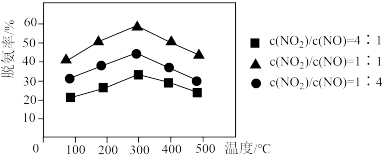
催化还原氮氧化物(SCR)技术是目前应用最广泛的脱硝技术,用Fe做催化剂时,在氨气足量的情况下,不同 对应的脱氨率如图所示,当温度为
对应的脱氨率如图所示,当温度为___________ ℃,
___________ ,脱氮效果最佳。
Ⅱ.脱碳
(3)一定条件下 和
和 反应合成
反应合成 进行脱碳处理,其方程式为:
进行脱碳处理,其方程式为: 。在2L密闭容器中,该反应过程中的部分数据如下表:
。在2L密闭容器中,该反应过程中的部分数据如下表:
①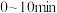 ,以
,以 的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为___________  。
。
②下列情况能说明该反应达到化学平衡状态的是___________ 。
A.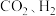 浓度之比为
浓度之比为 B.该密闭容器内压强保持不变
B.该密闭容器内压强保持不变
C.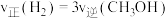 D.该密闭容器内混合气体的密度保持不变
D.该密闭容器内混合气体的密度保持不变
③平衡时, 的体积分数为
的体积分数为___________ (结果保留三位有效数字)。
Ⅲ.脱硫
(4)将 转化为重要的化工原料
转化为重要的化工原料 进行脱硫的原理示意图。
进行脱硫的原理示意图。
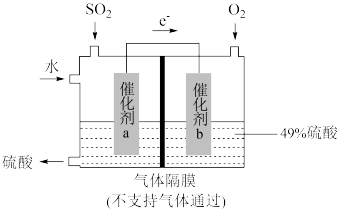
催化剂a表面的电极反应式为___________ ,若得到的硫酸质量分数仍为49%,则理论上参加反应的 与加入的
与加入的 的物质的量之比为
的物质的量之比为___________ 。
 的排放与燃烧化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
的排放与燃烧化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。Ⅰ.脱硝
(1)汽车尾气中
 生成过程中的能量变化如图所示。
生成过程中的能量变化如图所示。 和
和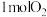 完全反应生成NO会吸收
完全反应生成NO会吸收 的能量。
的能量。
(2)
 催化还原氮氧化物(SCR)技术是目前应用最广泛的脱硝技术,用Fe做催化剂时,在氨气足量的情况下,不同
催化还原氮氧化物(SCR)技术是目前应用最广泛的脱硝技术,用Fe做催化剂时,在氨气足量的情况下,不同 对应的脱氨率如图所示,当温度为
对应的脱氨率如图所示,当温度为

Ⅱ.脱碳
(3)一定条件下
 和
和 反应合成
反应合成 进行脱碳处理,其方程式为:
进行脱碳处理,其方程式为: 。在2L密闭容器中,该反应过程中的部分数据如下表:
。在2L密闭容器中,该反应过程中的部分数据如下表:反应时间/ | 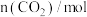 | 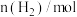 | 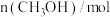 | 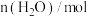 |
| 0 | 3 | 9 | 0 | 0 |
| 10 | 6 | |||
| 20 | 1.5 | |||
| 30 | 1.5 |
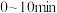 ,以
,以 的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为 。
。②下列情况能说明该反应达到化学平衡状态的是
A.
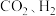 浓度之比为
浓度之比为 B.该密闭容器内压强保持不变
B.该密闭容器内压强保持不变C.
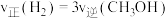 D.该密闭容器内混合气体的密度保持不变
D.该密闭容器内混合气体的密度保持不变③平衡时,
 的体积分数为
的体积分数为Ⅲ.脱硫
(4)将
 转化为重要的化工原料
转化为重要的化工原料 进行脱硫的原理示意图。
进行脱硫的原理示意图。
催化剂a表面的电极反应式为
 与加入的
与加入的 的物质的量之比为
的物质的量之比为
您最近半年使用:0次
名校
解题方法
4 . SO2可形成酸雨,是大气污染物。利用如图装置既可以吸收工厂排放的SO2又可以制得硫酸溶液。下列说法正确的是


| A.a极为负极,发生还原反应 |
B.b极的电极反应式为 |
| C.电子的流动方向:a极→电解质溶液→b极 |
| D.从左下口流出的硫酸溶液的质量分数一定大于50% |
您最近半年使用:0次
2023-07-11更新
|
274次组卷
|
5卷引用:广东省清远市2022-2023学年高一下学期期末质量检测化学试题
名校
解题方法
5 . 含氮化合物在农业、工业、国防等领域都有着广泛的应用。氮元素部分常见物质间的相互转化如图所示。
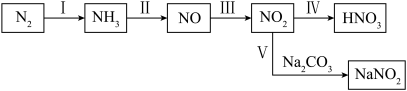
回答相关问题。
Ⅰ.
(1)图示中标示出了以氨为原料制备硝酸的全过程,写出过程Ⅱ的化学方程式:_____ ;过程Ⅳ不断通入空气,理论上能使 最终完全吸收,则1.7吨
最终完全吸收,则1.7吨 理论上可以得到
理论上可以得到_____ 吨质量分数为63%的硝酸。
(2)某温度下,在容积恒定为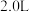 的密闭容器中充入
的密闭容器中充入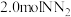 和
和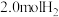 ,一段时间后反应达平衡状态,实验数据如下表所示
,一段时间后反应达平衡状态,实验数据如下表所示
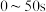 内的平均反应速率
内的平均反应速率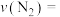
_____ ,250s时, 的转化率为
的转化率为_____ 。
Ⅱ.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是 )和水分子通过。其工作原理的示意图如图所示,请回答下列问题:
)和水分子通过。其工作原理的示意图如图所示,请回答下列问题:

(3)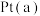 电极是电池的
电极是电池的_____ (填“正”或“负”)极。
(4)电解质溶液中的 向
向_____ (填“a”或“b”)极移动。
(5)该电池的负极反应式为_____

回答相关问题。
Ⅰ.
(1)图示中标示出了以氨为原料制备硝酸的全过程,写出过程Ⅱ的化学方程式:
 最终完全吸收,则1.7吨
最终完全吸收,则1.7吨 理论上可以得到
理论上可以得到(2)某温度下,在容积恒定为
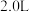 的密闭容器中充入
的密闭容器中充入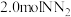 和
和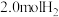 ,一段时间后反应达平衡状态,实验数据如下表所示
,一段时间后反应达平衡状态,实验数据如下表所示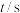 | 0 | 50 | 150 | 250 | 350 |
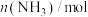 | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
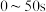 内的平均反应速率
内的平均反应速率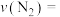
 的转化率为
的转化率为Ⅱ.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是
 )和水分子通过。其工作原理的示意图如图所示,请回答下列问题:
)和水分子通过。其工作原理的示意图如图所示,请回答下列问题:
(3)
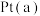 电极是电池的
电极是电池的(4)电解质溶液中的
 向
向(5)该电池的负极反应式为
您最近半年使用:0次
6 .  一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
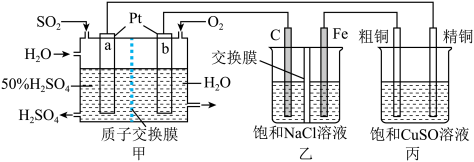
(1)a极的电极反应式为___________ ;Fe电极为___________ 极,其电极反应式为___________ 。
(2)甲装置每消耗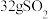 ,溶液中通过质子交换膜的
,溶液中通过质子交换膜的 为
为___________ mol,如果粗铜中含有锌、银等杂质,丙装置中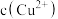
___________ (填“增大”“减小”或“不变”)。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(电极未标出)。
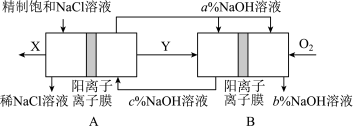
装置A发生反应的化学方程式为___________ ;图中X的化学式为___________ ;NaOH溶液的质量分数为a%、b%、c%,由大到小的顺序为___________ 。
 一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
(1)a极的电极反应式为
(2)甲装置每消耗
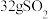 ,溶液中通过质子交换膜的
,溶液中通过质子交换膜的 为
为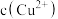
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(电极未标出)。

装置A发生反应的化学方程式为
您最近半年使用:0次
名校
解题方法
7 . 双氧水是工业上常用的绿色氧化剂,也是治疗创伤伤口的消毒清洗剂。
(1)医疗上可用质量分数为 的过氧化氢溶液对伤口进行消毒,当过氧化氢溶液接触到伤口处时,H2O2就会迅速分解,可能原因是
的过氧化氢溶液对伤口进行消毒,当过氧化氢溶液接触到伤口处时,H2O2就会迅速分解,可能原因是___________ 。
(2)为了除去酸性溶液中的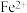 ,常先加入双氧水将
,常先加入双氧水将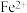 氧化成
氧化成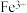 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(3)金属空气电池具有很高的容量和功率密度,但在缺氧条件下性能受到限制。在无氧条件下,双氧水半燃料电池是一个可行的选择。下图为铝、铂电极与双氧水/氢氧化钾溶液构成的原电池。
金属空气电池具有很高的容量和功率密度,但在缺氧条件下性能受到限制。在无氧条件下,双氧水半燃料电池是一个可行的选择。下图为铝、铂电极与双氧水/氢氧化钾溶液构成的原电池。
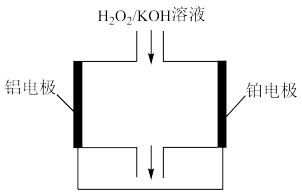
铝电极为原电池的___________ 极(填“正”或“负”),该电极发生___________ 反应(填“氧化”或“还原”)。电池放电时电解质溶液中的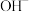 向
向___________ 电极(填“铝”或“铂”)移动。
(4)为探究外界条件对H2O2分解反应速率的影响,相关实验设计如下表所示:
表中a=___________ ;III中加2.0 水的目的是
水的目的是___________ 。
(5)过氧化氢一定条件下可发生分解: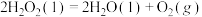 ,断裂1
,断裂1
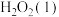 中的
中的 键和1
键和1
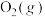 中的
中的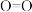 键所需的能量依次为142
键所需的能量依次为142 、497.3
、497.3 ,断裂
,断裂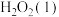 和
和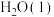 中1
中1
 键所需能量依次为367
键所需能量依次为367 、467
、467 ,则2
,则2
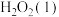 反应生成2
反应生成2
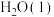 和1
和1
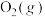
___________ (填“吸收"或“放出”)的能量为___________  。
。
(1)医疗上可用质量分数为
 的过氧化氢溶液对伤口进行消毒,当过氧化氢溶液接触到伤口处时,H2O2就会迅速分解,可能原因是
的过氧化氢溶液对伤口进行消毒,当过氧化氢溶液接触到伤口处时,H2O2就会迅速分解,可能原因是(2)为了除去酸性溶液中的
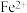 ,常先加入双氧水将
,常先加入双氧水将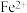 氧化成
氧化成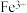 ,该反应的离子方程式为
,该反应的离子方程式为(3)金属空气电池具有很高的容量和功率密度,但在缺氧条件下性能受到限制。在无氧条件下,双氧水半燃料电池是一个可行的选择。下图为铝、铂电极与双氧水/氢氧化钾溶液构成的原电池。
金属空气电池具有很高的容量和功率密度,但在缺氧条件下性能受到限制。在无氧条件下,双氧水半燃料电池是一个可行的选择。下图为铝、铂电极与双氧水/氢氧化钾溶液构成的原电池。

铝电极为原电池的
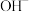 向
向(4)为探究外界条件对H2O2分解反应速率的影响,相关实验设计如下表所示:
| 试管编号 | 实验目的 | H2O2溶液 | 温度 | 水的体积/ |  溶液体积/ 溶液体积/ | |
| 质量分数 | 体积/ | |||||
| I | 为编号II作实验参照 | 10% | 2.0 | 常温 | 0 | 0 |
| II | 温度对反应速率的影响 | a | 2.0 | 50℃ | 0 | 0 |
| III | 为编号IV作实验参照 | 5.0% | 2.0 | 常温 | 2.0 | 0 |
| IV | 催化剂对反应速率的影响 | 5.0% | 2.0 | 常温 | 0 | 2.0 |
 水的目的是
水的目的是(5)过氧化氢一定条件下可发生分解:
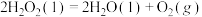 ,断裂1
,断裂1
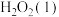 中的
中的 键和1
键和1
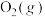 中的
中的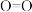 键所需的能量依次为142
键所需的能量依次为142 、497.3
、497.3 ,断裂
,断裂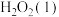 和
和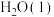 中1
中1
 键所需能量依次为367
键所需能量依次为367 、467
、467 ,则2
,则2
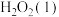 反应生成2
反应生成2
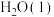 和1
和1
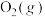
 。
。
您最近半年使用:0次
2023-04-13更新
|
251次组卷
|
2卷引用:河南省焦作市2022-2023学年高一下学期4月期中考试化学试题
名校
解题方法
8 . 某课题研究小组设计如图所示装置(电极材料均为Pt),该装置可将工业废水中的乙胺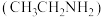 转化为无毒无害物质。下列分析错误的是
转化为无毒无害物质。下列分析错误的是
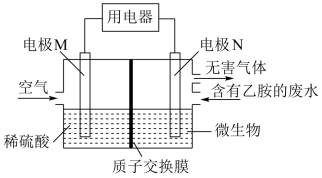
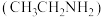 转化为无毒无害物质。下列分析错误的是
转化为无毒无害物质。下列分析错误的是 
| A.电极N为电池的负极 |
B.电池工作时, 由M极区通过交换膜移动到N极区 由M极区通过交换膜移动到N极区 |
C.电极N的电极反应式为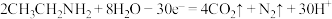 |
| D.当空气(含氧气20%)的进入量为7.5mol时,可以处理含乙胺(质量分数为9%)的废水0.2kg |
您最近半年使用:0次
解题方法
9 . 如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氧气的电极为_______ (填“正极”或“负极”),负极的电极反应式为_______ 。
(2)铁电极为_______ (填“阳极”或“阴极”),石墨电极(C)的电极反应式为_______ 。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______ (填“增大”“减小”或“不变”)
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为_______ (用 为阿伏加德罗常数的值表示)。
为阿伏加德罗常数的值表示)。
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
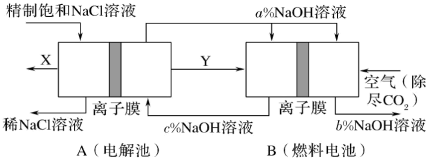
分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为_______ 。

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
 为阿伏加德罗常数的值表示)。
为阿伏加德罗常数的值表示)。(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为
您最近半年使用:0次
解题方法
10 . 如图是一套电化学实验装置,图中C、D均为铂电极,G是灵敏电流计,其指针总是偏向电源正极。回答下列问题:
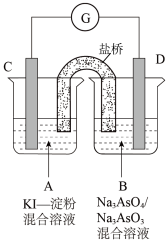
(1)向烧杯B中加入适量较浓的硫酸,发现G的指针向右偏移。则电极C是原电池的_______ (填“正极”或“负极”),电极C上的电极反应式为_______ ,烧杯A中的主要实验现象是_______ 。
(2)一段时间后,再向烧杯B中加入适量质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时整套实验装置总反应的离子方程式为 ,此时电极D为
,此时电极D为_______ (填“正极”或“负极”),其电极反应方程式为_______ 。
(3)再过一段时间后,实验装置中的化学反应已经达到化学平衡状态,则此时G的指针指向_______ (填“右边”“左边”或“0刻度”),理由是_______ 。

(1)向烧杯B中加入适量较浓的硫酸,发现G的指针向右偏移。则电极C是原电池的
(2)一段时间后,再向烧杯B中加入适量质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时整套实验装置总反应的离子方程式为
 ,此时电极D为
,此时电极D为(3)再过一段时间后,实验装置中的化学反应已经达到化学平衡状态,则此时G的指针指向
您最近半年使用:0次



