名校
1 . 按要求回答下列问题。
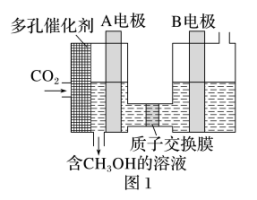
(1)有人研究了用电解的方法把 转化为
转化为 ,其原理如图1所示。已知B电极为惰性电极,则在水溶液中,该极的电极反应式为
,其原理如图1所示。已知B电极为惰性电极,则在水溶液中,该极的电极反应式为_______ 。
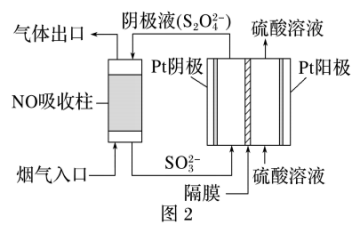
(2)以连二亚硫酸盐(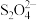 )为还原剂脱除烟气中的
)为还原剂脱除烟气中的 ,并通过电解再生,装置如图2所示。阴极的电极反应式为
,并通过电解再生,装置如图2所示。阴极的电极反应式为_______ ,电解槽中的隔膜为_______ (填“阳”或“阴”)离子交换膜。
(3)甲醛超标会危害人体健康,需对甲醛进行含量检测及污染处理。某甲醛气体传感器的工作原理如图3所示,b极的电极反应式为_______ ,当电路中转移 电子时,传感器内参加反应的甲醛
电子时,传感器内参加反应的甲醛 为
为_______  。
。
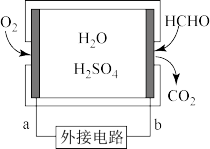
图3
(1)有人研究了用电解的方法把
 转化为
转化为 ,其原理如图1所示。已知B电极为惰性电极,则在水溶液中,该极的电极反应式为
,其原理如图1所示。已知B电极为惰性电极,则在水溶液中,该极的电极反应式为
(2)以连二亚硫酸盐(
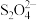 )为还原剂脱除烟气中的
)为还原剂脱除烟气中的 ,并通过电解再生,装置如图2所示。阴极的电极反应式为
,并通过电解再生,装置如图2所示。阴极的电极反应式为
(3)甲醛超标会危害人体健康,需对甲醛进行含量检测及污染处理。某甲醛气体传感器的工作原理如图3所示,b极的电极反应式为
 电子时,传感器内参加反应的甲醛
电子时,传感器内参加反应的甲醛 为
为 。
。
图3
您最近半年使用:0次
名校
解题方法
2 . 某传感器可利用电化学原理测定混合气体中 的含量,工作示意图如下。单位时间内,通过传感器的待测气体为p
的含量,工作示意图如下。单位时间内,通过传感器的待测气体为p (标准状况),某电极质量增加了q
(标准状况),某电极质量增加了q 。下列说法正确的是
。下列说法正确的是

 的含量,工作示意图如下。单位时间内,通过传感器的待测气体为p
的含量,工作示意图如下。单位时间内,通过传感器的待测气体为p (标准状况),某电极质量增加了q
(标准状况),某电极质量增加了q 。下列说法正确的是
。下列说法正确的是
A. 电极上的电极反应式为: 电极上的电极反应式为: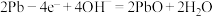 |
B.反应过程中转移的电子数为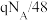 |
C.反应过程中正极区溶液的 减小 减小 |
D.待测气体中 的体积分数为 的体积分数为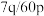 |
您最近半年使用:0次
2022-11-11更新
|
295次组卷
|
3卷引用:山东省菏泽市郓城第一中学2022-2023学年高二上学期期中考试化学试题
解题方法
3 . 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是
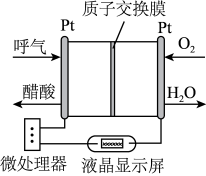

| A.电流由O2所在的铂电极经外电路流向另一电极 |
| B.O2所在的铂电极处发生氧化反应 |
C.该电池的负极反应式为 |
| D.微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
您最近半年使用:0次
名校
4 . 电化学气敏传感器可用于监测环境中NH3的含量,其中工作原理如图所示。则下列说法正确的是


| A.电流由a极流向b极 |
| B.溶液中的OH-向b极移动 |
| C.a极的电极反应式为:4NH3-12e-=2N2+12H+ |
| D.b极的电极反应式为:3O2+12e-+6H2O=12OH- |
您最近半年使用:0次
解题方法
5 . 已知可逆反应: 。设计如图所示装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导电作用)。
。设计如图所示装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导电作用)。
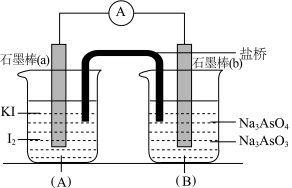
进行如下操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现电流表指针偏转;
(Ⅱ)若改往(B)烧杯中滴加质量分数为40%的NaOH溶液,发现电流表指针向相反方向偏转。
(1)两次操作过程中电流表指针偏转方向为什么会相反?
试用电极反应和化学平衡移动的原理解释此现象:____________________________________ 。
(2)(Ⅰ)操作过程中石墨棒(a)上发生的电极反应为____________________________________ 。
(3)(Ⅱ)操作过程中石墨棒(b)上发生的电极反应为____________________________________ 。
 。设计如图所示装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导电作用)。
。设计如图所示装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导电作用)。
进行如下操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现电流表指针偏转;
(Ⅱ)若改往(B)烧杯中滴加质量分数为40%的NaOH溶液,发现电流表指针向相反方向偏转。
(1)两次操作过程中电流表指针偏转方向为什么会相反?
试用电极反应和化学平衡移动的原理解释此现象:
(2)(Ⅰ)操作过程中石墨棒(a)上发生的电极反应为
(3)(Ⅱ)操作过程中石墨棒(b)上发生的电极反应为
您最近半年使用:0次
解题方法
6 . 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。
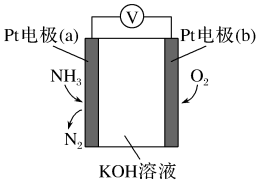
(1)Pt电极(a)为_______ 极(填“正”或“负”);
(2)Pt电极(b)上发生的反应为_______ (填“氧化”或“还原”)反应。
(3)该过程总反应的化学反应方程式为_______ 。

(1)Pt电极(a)为
(2)Pt电极(b)上发生的反应为
(3)该过程总反应的化学反应方程式为
您最近半年使用:0次
名校
解题方法
7 . 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。下列说法正确的是
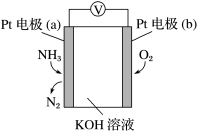

| A.溶液中OH-向电极b移动 |
| B.O2在电极b上发生还原反应 |
| C.反应消耗的NH3与O2的物质的量之比为4:5 |
| D.负极的电极反应式为2NH3-6e-=N2+6H+ |
您最近半年使用:0次
8 . 磷酸铁锂(LiFePO4)电池是新能源汽车主流电池,其结构如图所示。左边由磷酸铁锂晶体和铝箔组成;中间是聚合物隔膜,锂离子可以通过;右边由石墨与Li组成,铜箔与其连接构成另一电极,电池内充满电解质。如图为放电时原理图示。下列说法不正确的是
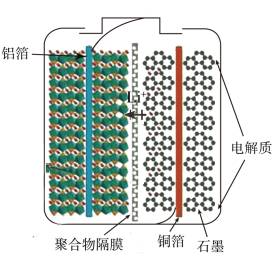

| A.放电时,铜箔所在电极为负极,发生氧化反应 |
| B.充电时,LiFePO4中的锂离子脱出,LiFePO4中的Fe被P氧化 |
| C.电解质可选用锂盐的碳酸二乙酯溶液,不能选用锂盐的水溶液 |
| D.电池充放电一定次数后,电池效率下降可能原因是电解液中的Li+含量下降 |
您最近半年使用:0次
9 . 1909年,德国化学家哈伯经过反复实验研究发现工业合成氨的可能性。1913年,在德国工程师博施努力下,一个年产7000吨的合成氨工厂建成并投产,合成氨的工业化生产终于实现。因此,哈伯和博施都获得了诺贝尔化学奖。
键能:常温常压下,将1 mol理想气体分子AB拆开为中性气态原子A和B所需要的能量。请回答下列问题:
(1)根据上表中所给数据判断:N2(g)+3H2(g) 2NH3(g)为
2NH3(g)为___________ 热反应(填“放”或“吸”);
(2)下列措施中能加快合成氨反应速率的是___________ ;
A.升高温度 B.使用合适的催化剂 C.分离出生成的氨气
D.增大氮气的浓度 E.扩大容器体积
(3)在一个恒温恒容的密闭容器中,发生可逆反应N2(g)+3H2(g) 2NH3(g),下列情况能说明反应已达到化学平衡状态的是
2NH3(g),下列情况能说明反应已达到化学平衡状态的是___________ ;
A.混合气体的总质量不再改变 B.氨气的质量分数不再改变
C.N2、H2和NH3的物质的量之比为1:3:2 D.容器内压强保持不变
(4)为了提高合成氨的物料利用率和工作效率,科学家们正在制作合成氨原电池。右图为合成氨原电池的原理图,则电极a为___________ 极(填“正”或“负”)。
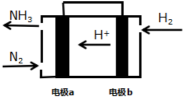
| 化学键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
键能:常温常压下,将1 mol理想气体分子AB拆开为中性气态原子A和B所需要的能量。请回答下列问题:
(1)根据上表中所给数据判断:N2(g)+3H2(g)
 2NH3(g)为
2NH3(g)为(2)下列措施中能加快合成氨反应速率的是
A.升高温度 B.使用合适的催化剂 C.分离出生成的氨气
D.增大氮气的浓度 E.扩大容器体积
(3)在一个恒温恒容的密闭容器中,发生可逆反应N2(g)+3H2(g)
 2NH3(g),下列情况能说明反应已达到化学平衡状态的是
2NH3(g),下列情况能说明反应已达到化学平衡状态的是A.混合气体的总质量不再改变 B.氨气的质量分数不再改变
C.N2、H2和NH3的物质的量之比为1:3:2 D.容器内压强保持不变
(4)为了提高合成氨的物料利用率和工作效率,科学家们正在制作合成氨原电池。右图为合成氨原电池的原理图,则电极a为

您最近半年使用:0次
2021-05-13更新
|
263次组卷
|
3卷引用:浙江省七彩阳光新高考研究联盟2020-2021学年高一下学期期中联考化学试题
浙江省七彩阳光新高考研究联盟2020-2021学年高一下学期期中联考化学试题(已下线)专题06 化学反应速率和限度【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)浙江省舟山市南海实验高中2021-2022学年高一下学期4月月考化学试题
名校
10 . 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后,发现液滴覆盖的圆周中心区(a)已被腐蚀变暗,在液滴外沿出现棕色铁锈环(b),如图所示。下列说法不正确的是
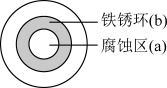

| A.铁锈环的主要成分是Fe2O3·xH2O |
| B.液滴之下氧气含量少,铁片作负极,发生的还原反应为Fe−2e-=Fe2+ |
| C.液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- |
| D.铁片腐蚀最严重的区域不是生锈最多的区域 |
您最近半年使用:0次
2022-04-22更新
|
144次组卷
|
2卷引用:河北省泊头市第一中学2021-2022学年高一下学期第一次月考化学试题



