1 . 1905年哈伯实现了以氮气和氢气为原料合成氨气,生产的氨制造氮肥服务于农业,养活了地球三分之一的人口,哈伯也因此获得了1918年的诺贝尔化学奖。一百多年过去了,对合成氨的研究依然没有止步。
(1)已知在一定温度下进行的化学反应,反应所释放或吸收的能量称为该温度下的反应热。反应热用符号△H表示;△H =反应物断键吸收总能量-生成物成键放出总能量,若△H<0为放热反应,△H>0为吸热反应。如H2和O2反应: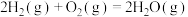 放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为
放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为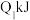 、
、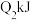 、
、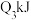 ,可推知△H数值
,可推知△H数值 ,则反应中能量变化为
,则反应中能量变化为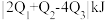 。对工业合成氨的反应如下:
。对工业合成氨的反应如下: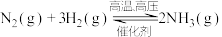 ,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为
,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为_______ kJ;下图能正确表示该反应中能量变化的是_________ (填“A”或“B”)。
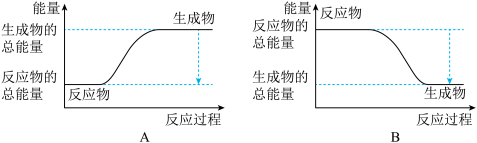
(2)反应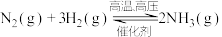 在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
根据上表数据回答:实验①②中,有一个实验使用了催化剂,它是实验_______ (填序号);实验③达平衡时NH3的转化率为_______ 。在恒温恒容条件下,判断该反应达到化学平衡状态的标志是_______ (填字母)。
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
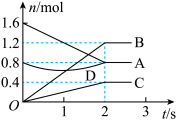
(3)某温度下,在体积为3 L的容器中,A、B、C三种气体物质物质的量随着时间变化的关系如图所示,则①该反应的化学方程式为_______ ,②反应开始至2 s时,B的平均反应速率为_______ 。
(4)氢气是未来最理想的能源。科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用下使海水分解得到氢气的新技术: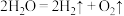 ,制得的氢气可用于制作燃料电池。试回答下列问题:
,制得的氢气可用于制作燃料电池。试回答下列问题:
①某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为 ,则A极是电池的
,则A极是电池的_______ 极。
②一种人工合成汽油的方法是先将煤制成CO和H2,然后在一定条件下将CO与H2转化为碳原子数为5~8的烷烃(人工合成汽油)。若以CnH2n+2表示人工合成汽油的成分,请写出用CO与H2制取CnH2n+2的化学方程式_______ 。
(1)已知在一定温度下进行的化学反应,反应所释放或吸收的能量称为该温度下的反应热。反应热用符号△H表示;△H =反应物断键吸收总能量-生成物成键放出总能量,若△H<0为放热反应,△H>0为吸热反应。如H2和O2反应:
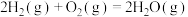 放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为
放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为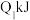 、
、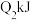 、
、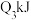 ,可推知△H数值
,可推知△H数值 ,则反应中能量变化为
,则反应中能量变化为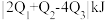 。对工业合成氨的反应如下:
。对工业合成氨的反应如下: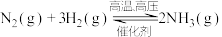 ,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为
,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为
(2)反应
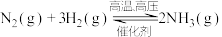 在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。| 实验序号 | 时间浓度温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| ① | 400℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| ② | 400℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| ③ | 500℃ | 1.0 | 0.40 | 0.25 | 0.15 | 0.15 | 0.15 | 0.15 |
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
(3)某温度下,在体积为3 L的容器中,A、B、C三种气体物质物质的量随着时间变化的关系如图所示,则①该反应的化学方程式为

(4)氢气是未来最理想的能源。科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用下使海水分解得到氢气的新技术:
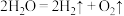 ,制得的氢气可用于制作燃料电池。试回答下列问题:
,制得的氢气可用于制作燃料电池。试回答下列问题:①某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为
 ,则A极是电池的
,则A极是电池的②一种人工合成汽油的方法是先将煤制成CO和H2,然后在一定条件下将CO与H2转化为碳原子数为5~8的烷烃(人工合成汽油)。若以CnH2n+2表示人工合成汽油的成分,请写出用CO与H2制取CnH2n+2的化学方程式
您最近一年使用:0次
解题方法
2 . CH4、CH3OH(甲醇)既是重要的化工原料,又是未来重要的能源物质。
(1)CH4可用作燃料,CH4的燃烧反应属于_______  填“放热,,或“吸热”
填“放热,,或“吸热” 反应,CH4和O2还可以构成燃料电池,通入CH4的一极是
反应,CH4和O2还可以构成燃料电池,通入CH4的一极是_______  填“正”或“负”
填“正”或“负” 极。
极。
(2)将1.0 molCH4和2.0 molH2O(g)通入容积为V L的恒容反应室,在一定条件下发生反应 。测得在5 min时达到平衡,CH4的物质的量为0.6 mol,CO的物质的量浓度为0.04 mol/L。
。测得在5 min时达到平衡,CH4的物质的量为0.6 mol,CO的物质的量浓度为0.04 mol/L。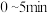 内,用H2表示该反应的平均反应速率v(H2)=
内,用H2表示该反应的平均反应速率v(H2)=_______ ,V=_______ 。
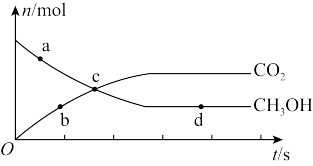
(3)在恒容条件下进行反应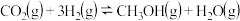 、CO2、CH3OH的物质的量随时间变化关系如图,该反应达到平衡的点是
、CO2、CH3OH的物质的量随时间变化关系如图,该反应达到平衡的点是_______ 。
(1)CH4可用作燃料,CH4的燃烧反应属于
 填“放热,,或“吸热”
填“放热,,或“吸热” 反应,CH4和O2还可以构成燃料电池,通入CH4的一极是
反应,CH4和O2还可以构成燃料电池,通入CH4的一极是 填“正”或“负”
填“正”或“负” 极。
极。(2)将1.0 molCH4和2.0 molH2O(g)通入容积为V L的恒容反应室,在一定条件下发生反应
 。测得在5 min时达到平衡,CH4的物质的量为0.6 mol,CO的物质的量浓度为0.04 mol/L。
。测得在5 min时达到平衡,CH4的物质的量为0.6 mol,CO的物质的量浓度为0.04 mol/L。 内,用H2表示该反应的平均反应速率v(H2)=
内,用H2表示该反应的平均反应速率v(H2)=(3)在恒容条件下进行反应
 、CO2、CH3OH的物质的量随时间变化关系如图,该反应达到平衡的点是
、CO2、CH3OH的物质的量随时间变化关系如图,该反应达到平衡的点是
您最近一年使用:0次
2022-05-06更新
|
25次组卷
|
2卷引用:新疆和田地区皮山县高级中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
3 . 某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下,设计并进行了以下一系列实验,实验结果记录如下。
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同?__ (填“是”或“否”)。
(2)由实验3完成下列填空:
①铝为__ 极,电极反应式:__ 。
②石墨为__ 极,电极反应式:__ 。
③电池总反应式:__ 。
(3)实验4中铝作负极还是正极?__ ,理由是__ 。写出铝电极的电极反应式:__ 。
(4)解释实验5中电流表指针偏向铝的原因:__ 。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:__ 。
| 编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极(正极或负极)是否相同?
(2)由实验3完成下列填空:
①铝为
②石墨为
③电池总反应式:
(3)实验4中铝作负极还是正极?
(4)解释实验5中电流表指针偏向铝的原因:
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:
您最近一年使用:0次
2021-02-19更新
|
1271次组卷
|
8卷引用:2015-2016学年新疆生产建设兵团二中高一下期中化学试卷
4 . 按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________ 极移动(填“正”或“负”)。
②电子流动方向由____________ 极流向____________ 极(填:“正”、“负”)。
③若有1mol e- 流过导线,则理论上负极质量减少____________ g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________ (填“锌极”或“铜极”),原因是_____________ (用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g) bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为a∶b∶c=_________ 。
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为:__________ 。
③下列叙述中能说明上述反应达到平衡状态的是____________________________ 。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗a mol N,同时消耗b mol M
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向
②电子流动方向由
③若有1mol e- 流过导线,则理论上负极质量减少
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g)
 bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
①反应化学方程式中各物质的系数比为a∶b∶c=
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为:
③下列叙述中能说明上述反应达到平衡状态的是
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗a mol N,同时消耗b mol M
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
您最近一年使用:0次
2018-09-22更新
|
473次组卷
|
5卷引用:新疆兵团第二师华山中学2018-2019学年高一下学期期中考试化学试题
新疆兵团第二师华山中学2018-2019学年高一下学期期中考试化学试题天津市部分区2017~2018学年高一下学期期末考试化学试题(已下线)2019年4月14日《每日一题》 必修2 每周一测河北省张家口市第一中学西校区、万全中学2019-2020学年高二第一学期期初考试化学试题(已下线)【南昌新东方】2019 八一中学、洪都中学、麻丘高中等七校 高一下 期末
名校
解题方法
5 . 某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
①通过实验2和3,可得出原电池的形成条件是______________________________ 。
②通过实验1和3,可得出原电池的形成条件是______________________________ 。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________ 。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________ 。
Cu棒:______________________________ 。
(3)实验3的电流是从________ 棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________ g。
(1)请填写有关实验现象并得出相关结论。
| 编号 | 实验装置 | 实验现象 |
| 1 | 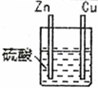 | 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
| 2 | 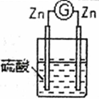 | 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
| 3 | 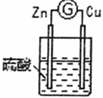 | 铜棒表面的现象是 |
①通过实验2和3,可得出原电池的形成条件是
②通过实验1和3,可得出原电池的形成条件是
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:
Cu棒:
(3)实验3的电流是从
您最近一年使用:0次
2018-07-16更新
|
642次组卷
|
6卷引用:新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高一下学期期中考试化学试题



