名校
1 .  具有强氧化性,能够消毒杀菌,同时能够吸附水中悬浮杂质。可用电解法制备
具有强氧化性,能够消毒杀菌,同时能够吸附水中悬浮杂质。可用电解法制备 ,采用的装置如图B所示,以
,采用的装置如图B所示,以 辅助的
辅助的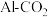 电池(如图A)为电源进行电解。
电池(如图A)为电源进行电解。
(1) 的电子式为
的电子式为___________ 。
(2)图A中正极反应式为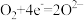 、
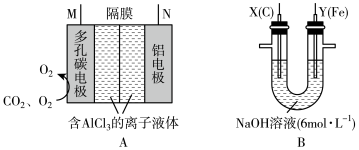
、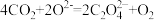 ,则该电池的总反应方程式为
,则该电池的总反应方程式为___________ 。
(3)图A中N极名称是___________ (填“正极”或“负极”),M极与图B___________ (填“X”或“Y”)极相连。
(4)电解过程中,图BX极区溶液的pH___________ (填“增大”“减小”或“不变”)。
(5)图B中两极均有气体产生,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况下的气体体积),则Y电极质量减小___________ g。
 具有强氧化性,能够消毒杀菌,同时能够吸附水中悬浮杂质。可用电解法制备
具有强氧化性,能够消毒杀菌,同时能够吸附水中悬浮杂质。可用电解法制备 ,采用的装置如图B所示,以
,采用的装置如图B所示,以 辅助的
辅助的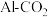 电池(如图A)为电源进行电解。
电池(如图A)为电源进行电解。
(1)
 的电子式为
的电子式为(2)图A中正极反应式为
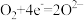 、
、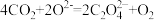 ,则该电池的总反应方程式为
,则该电池的总反应方程式为(3)图A中N极名称是
(4)电解过程中,图BX极区溶液的pH
(5)图B中两极均有气体产生,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况下的气体体积),则Y电极质量减小
您最近一年使用:0次
解题方法
2 . 2009年6月22日,柯达宣布受到数码相机的影响,决定停止彩色胶卷的生产。一代人的回忆在它74岁的时候,画上了句号。黑白相机的底片上涂有一薄层含AgBr的明胶凝胶,曝光时底片上的AgBr分解成极细的银晶核,哪部分感光越强,哪部分就越黑。该过程称之为“潜影”。
已知:Br2在碱性条件下歧化成Br-和BrO 。
。
回答以下问题:
(1)可以利用气体载体N2、H2、CO2等将溴引向物质制备溴化物(加热及夹持装置省略):

①装置的连接顺序为___ 。(按字母顺序填写)
②当载气中存在氧气等杂质气体时溴化作用减慢,溴化作用减慢的原因是___ 。所以待装置气密性检验完毕后,需___ 。
(2)装置B中盛装NaOH溶液的目的___ (用化学方程式解释)。
(3)请用化学方程式表示铁丝处发生的反应__ 。
(4)该实验装置还有一定的缺陷,请改正:___ 。
(5)α—AgI晶体中的Ag+具有高度的可移动性。根据这个原理,以α—AgI为主要成分的物质作为固体电解质电池可以检测外界气氛中氧气的浓度。
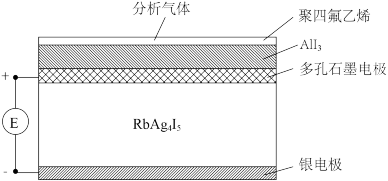
O2透过传感器聚四氟乙烯薄膜,与活性物质AlI3发生氧化还原反应,产物向多孔石墨极片扩散,形成原电池,正极的电极反应式为___ 。
(6)为测定液溴在反应中的转化率,通过沉淀滴定法测量尾气吸收液中的Brˉ浓度(假设通过四段式管子的未反应的Br2全部被吸收液吸收)。先滴加适量的硝酸,再滴加几滴K2CrO4指示剂,然后滴加cmol·L-1的AgNO3溶液至锥形瓶内出现___ ,且30s不变化,停止滴加。此时滴加了VmL。反应共消耗液溴ag,则Br2的转化率是__ 。(已知Ksp[Ag2CrO4红色]=2.0×10-12,Ksp[AgBr]=5.0×10-13,用含a、c、V的式子表示)
已知:Br2在碱性条件下歧化成Br-和BrO
 。
。回答以下问题:
(1)可以利用气体载体N2、H2、CO2等将溴引向物质制备溴化物(加热及夹持装置省略):

①装置的连接顺序为
②当载气中存在氧气等杂质气体时溴化作用减慢,溴化作用减慢的原因是
(2)装置B中盛装NaOH溶液的目的
(3)请用化学方程式表示铁丝处发生的反应
(4)该实验装置还有一定的缺陷,请改正:
(5)α—AgI晶体中的Ag+具有高度的可移动性。根据这个原理,以α—AgI为主要成分的物质作为固体电解质电池可以检测外界气氛中氧气的浓度。

O2透过传感器聚四氟乙烯薄膜,与活性物质AlI3发生氧化还原反应,产物向多孔石墨极片扩散,形成原电池,正极的电极反应式为
(6)为测定液溴在反应中的转化率,通过沉淀滴定法测量尾气吸收液中的Brˉ浓度(假设通过四段式管子的未反应的Br2全部被吸收液吸收)。先滴加适量的硝酸,再滴加几滴K2CrO4指示剂,然后滴加cmol·L-1的AgNO3溶液至锥形瓶内出现
您最近一年使用:0次
3 . 氧化还原反应可拆分为氧化和还原两个“半反应”,某小组同学从“半反应”的角度探究反应规律。
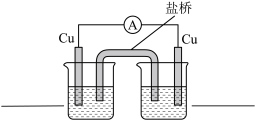
(1)已知: 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。
①该转化的还原半反应是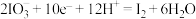 ,则相应的氧化半反应是
,则相应的氧化半反应是___________ 。
②分析上述还原半反应可知:增大 可促进
可促进 得到电子,使其
得到电子,使其___________ 性增强,进而与 发生反应。
发生反应。
(2)探究 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。
①有同学认为 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是___________ 。
用如下装置进行实验【硫酸与浓盐酸中 接近】。
接近】。
②甲实验的目的是___________ 。
③a.丙中气球变鼓是因为生成了___________ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:___________ 。
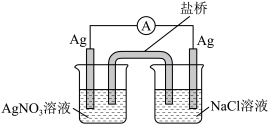
(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧 电极表面有
电极表面有 析出。
析出。
①该装置中左侧  电极作
电极作___________ (填“正”或“负”)极。
②写出该装置右侧 烧杯中的电极反应式___________ 。
对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池__________ 。
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
a.若能,在右装置图中填写烧杯中的试剂,并标出电子的移动方向 。
b.若不能,说明原因。
(1)已知:
 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。①该转化的还原半反应是
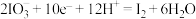 ,则相应的氧化半反应是
,则相应的氧化半反应是②分析上述还原半反应可知:增大
 可促进
可促进 得到电子,使其
得到电子,使其 发生反应。
发生反应。(2)探究
 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。①有同学认为
 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是用如下装置进行实验【硫酸与浓盐酸中
 接近】。
接近】。| 装置 | 序号 | 试管内药品 | 现象 |
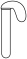 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 |  粉+硫酸 粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 |  粉+浓盐酸 粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在
 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧
 电极表面有
电极表面有 析出。
析出。①该装置中
 电极作
电极作②写出该装置

对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
a.若能,在右装置图中填写烧杯中的试剂,
b.若不能,说明原因。
您最近一年使用:0次
解题方法
4 . 如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氧气的电极为_______ (填“正极”或“负极”),负极的电极反应式为_______ 。
(2)铁电极为_______ (填“阳极”或“阴极”),石墨电极(C)的电极反应式为_______ 。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______ (填“增大”“减小”或“不变”)
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为_______ (用 为阿伏加德罗常数的值表示)。
为阿伏加德罗常数的值表示)。
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
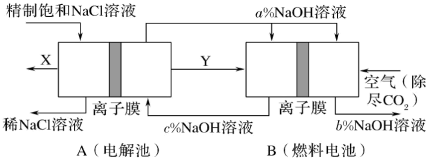
分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为_______ 。

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
 为阿伏加德罗常数的值表示)。
为阿伏加德罗常数的值表示)。(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为
您最近一年使用:0次
名校
解题方法
5 . 电池的种类很多,在生活中有广泛的用途。
Ⅰ.其中纽扣式微型银锌电池广泛的应用于电子表和电子计算器中,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
(1)其正极的电极反应式:_________________________________ ,工作时电池电解质溶液的碱性_______ (填“增强”、“减弱”或“不变”)。
Ⅱ.固体氧化物甲烷燃料电池以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。
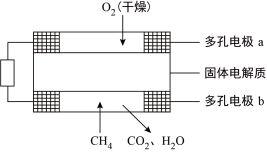
(2) a电极为电源的_______ 极,固体电解质中的阳离子向_______ 极移动;
(3) b电极的电极反应式为:_______________________________________ ;
(4)电池的总反应方程式为:______________________________________ ;
当电路中有2mol电子转移时,理论上负极消耗的标况下气体体积是______________ L。
Ⅰ.其中纽扣式微型银锌电池广泛的应用于电子表和电子计算器中,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
(1)其正极的电极反应式:
Ⅱ.固体氧化物甲烷燃料电池以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。

(2) a电极为电源的
(3) b电极的电极反应式为:
(4)电池的总反应方程式为:
当电路中有2mol电子转移时,理论上负极消耗的标况下气体体积是
您最近一年使用:0次
名校
6 . 如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
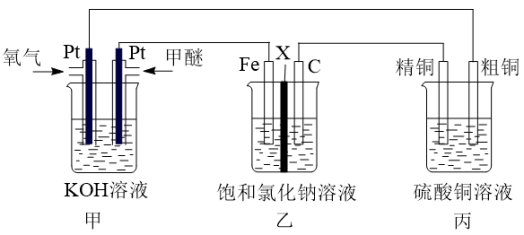
根据要求回答相关问题:
(1)通入氧气的电极为____ (填“正极”或“负极”),该极发生____ 反应(填氧化或还原)。
(2)铁电极为____ (填“阳极”或“阴极”),石墨电极(C)的电极反应式为____ 。反应一段时间后,乙装置中生成氢氧化钠主要在____ (填“铁极”或“石墨极”)区。
(3)如果粗铜中含有锌、银等杂质,反应一段时间,丙装置中硫酸铜溶液浓度将____ (填“增大”“减小”或“不变”)。

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)如果粗铜中含有锌、银等杂质,反应一段时间,丙装置中硫酸铜溶液浓度将
您最近一年使用:0次
名校
7 . 利用化学反应将储存在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产生活提供能量。
Ⅰ.如图是某同学设计的一个简易的原电池装置,请回答下列问题。
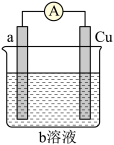
(1)若a电极材料为碳、b溶液为 溶液则正极的电极反应式为
溶液则正极的电极反应式为_______ ,当有3.2g的负极材料溶解时,导线中转移的电子的数目为_______ 。
(2)若a电极材料为铁、b溶液为稀硫酸,电流表的指针也会偏转,则电子的流向为_______ →_______ (填电极材料,下同),溶液中的 向
向_______ 极移动。
Ⅱ.水是生命之源,也是化学反应中的主角。
断开1molAB(g)分子中的化学键使其分别生成气态A原子和气态B原子,所吸收的能量称为A-B键的键能。列出了一些共价键的键能如表:
关于 的反应,请回答下列问题:
的反应,请回答下列问题:
(3)若有1mol 生成,需要
生成,需要_______ (填“吸收”或“放出”)热量_______ kJ;该反应的能量变化可用图_______ 表示(填“甲”或“乙”)

Ⅲ.天然气(主要成分 )和氧应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。
)和氧应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。
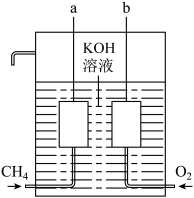
(4)b电极的电极反应式是_______ 。
Ⅰ.如图是某同学设计的一个简易的原电池装置,请回答下列问题。

(1)若a电极材料为碳、b溶液为
 溶液则正极的电极反应式为
溶液则正极的电极反应式为(2)若a电极材料为铁、b溶液为稀硫酸,电流表的指针也会偏转,则电子的流向为
 向
向Ⅱ.水是生命之源,也是化学反应中的主角。
断开1molAB(g)分子中的化学键使其分别生成气态A原子和气态B原子,所吸收的能量称为A-B键的键能。列出了一些共价键的键能如表:
| 共价键 | H-H | O=O | O-H |
| 键能 | 436kJ/mol | 498kJ/mol | 463kJ/mol |
关于
 的反应,请回答下列问题:
的反应,请回答下列问题:(3)若有1mol
 生成,需要
生成,需要
Ⅲ.天然气(主要成分
 )和氧应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。
)和氧应生成二氧化碳和水,该反应为放热的氧化还原反应,可将其设计成燃料电池,构造如图所示,a、b两个电极均由多孔的碳块组成。
(4)b电极的电极反应式是
您最近一年使用:0次
8 . 根据原子结构、元素周期律、电化学的知识,回答下列问题:
(1)现有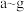 7种元素,它们在周期表中的位置如下:
7种元素,它们在周期表中的位置如下:
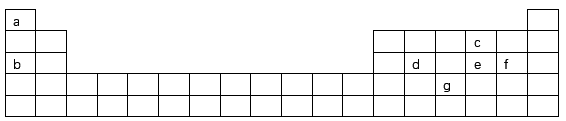
①以上7种元素中,原子半径最小的是___________ (填元素符号);d元素在周期表中的位置是___________ ;c元素的原子结构示意图为___________ 。
②a与f元素形成的化合物中的化学键属于___________ ,其电子式为___________ ;e元素最简单氢化物的化学式为___________ ;g元素最高价氧化物对应的水化物为___________ (填“强”或“弱”)酸。
③d元素最高价氧化物与b元素最高价氧化物对应水化物反应的离子方程式为___________ 。
(2)为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图所示:
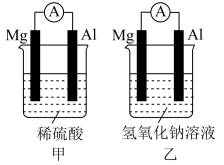
①装置甲的负极材料为___________ ,正极电极反应式为___________ 。
②装置乙中的阴离子向___________ (填“ ”或“
”或“ ”)电极移动,所发生的电池总反应为
”)电极移动,所发生的电池总反应为___________ 。
③甲装置在放电过程中,电解质溶液的酸性___________ (填“增强”“减弱”或“不变”)
(1)现有
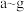 7种元素,它们在周期表中的位置如下:
7种元素,它们在周期表中的位置如下:
①以上7种元素中,原子半径最小的是
②a与f元素形成的化合物中的化学键属于
③d元素最高价氧化物与b元素最高价氧化物对应水化物反应的离子方程式为
(2)为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图所示:

①装置甲的负极材料为
②装置乙中的阴离子向
 ”或“
”或“ ”)电极移动,所发生的电池总反应为
”)电极移动,所发生的电池总反应为③甲装置在放电过程中,电解质溶液的酸性
您最近一年使用:0次
9 . 能源的开发和利用是当前科学研究的重要课题。
(1)原电池是将_____ 能转化为_____ 能的装置。
(2)下列不能用于设计成原电池的化学反应是_____ ,理由是_____ 。
A.2HCl+CaO=CaCl2+H2O
B.2CH3OH+3O2=2CO2+4H2O
C.4Fe(OH)2+2H2O+O2=4Fe(OH)3
D.2H2+O2=2H2O
(3)甲烷是天然气的主要成分。
①写出CH4燃烧的化学方程式_____ 。
②25℃,100kPa时生成或断裂1mol化学键所放出或吸收的能量称为键能。已知键能数据如下:
计算1mol甲烷完全燃烧放出的热量为_____ kJ。
(4)为提高能量转化效率,常将甲烷设计成燃料电池,装置示意图如图(其中A、B为石墨电极)。
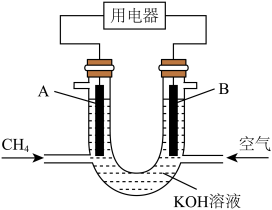
①B是该电池的_____ (填“正”或“负”)极。CH4在该装置中的作用是_____ ,KOH溶液的作用是_____ 。
②已知甲烷与氧气完全氧化时每生成1mol液态水释放能量约为400kJ,又知该甲烷燃料电池每发1kW·h电能生成216g水,则该电池的能量转化率为_____ (1kW·h=3.6×106J)。
(1)原电池是将
(2)下列不能用于设计成原电池的化学反应是
A.2HCl+CaO=CaCl2+H2O
B.2CH3OH+3O2=2CO2+4H2O
C.4Fe(OH)2+2H2O+O2=4Fe(OH)3
D.2H2+O2=2H2O
(3)甲烷是天然气的主要成分。
①写出CH4燃烧的化学方程式
②25℃,100kPa时生成或断裂1mol化学键所放出或吸收的能量称为键能。已知键能数据如下:
| 化学键 | C-H | O=O | C=O | O-H |
| 键能/kJ·mol-1 | 414 | 497 | 803 | 463 |
(4)为提高能量转化效率,常将甲烷设计成燃料电池,装置示意图如图(其中A、B为石墨电极)。

①B是该电池的
②已知甲烷与氧气完全氧化时每生成1mol液态水释放能量约为400kJ,又知该甲烷燃料电池每发1kW·h电能生成216g水,则该电池的能量转化率为
您最近一年使用:0次
2020-07-31更新
|
178次组卷
|
2卷引用:山东省烟台市2019-2020学年高一下学期期末考试化学试题
解题方法
10 . X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________________ 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________ (写化学式),非金属气态氢化物还原性最强的是__________________ (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________ (写出其中两种物质的化学式)。
(4)Z2Y2中的化学键类型是_____________________ ;Z2Y2与水反应放出气体的离子方程式为
___________________________________________ 。
(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2 Fe + 2ZG 放电时,电池的负极材料为
Fe + 2ZG 放电时,电池的负极材料为______ ,发生____ 反应
请回答下列问题:
(1)Y在元素周期表中的位置为
(2)上述元素的最高价氧化物对应的水化物酸性最强的是
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有
(4)Z2Y2中的化学键类型是
(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2
 Fe + 2ZG 放电时,电池的负极材料为
Fe + 2ZG 放电时,电池的负极材料为
您最近一年使用:0次



