名校
解题方法
1 . 如下图设计的串联电池装置,R为变阻器,以调节电路电流。
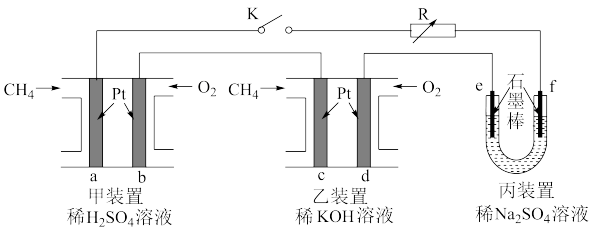
(1)写出b、c电极的电极反应式:b______________ ,c_______________ ;
(2)写出f电极的电极反应式____________________ ,向此电极区域滴入酚酞的现象为:_____________ ;该电极区域水的电离平衡被____________ (填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH__________ (填“变大”、“变小”或“不变”),原因是______________ 。
(4)电解一段时间后丙装置析出芒硝(Na2SO4·10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入______ g H2O就可以将析出的沉淀溶解并恢复到原有浓度。

(1)写出b、c电极的电极反应式:b
(2)写出f电极的电极反应式
(3)闭合K一段时间后,丙装置的电解质溶液pH
(4)电解一段时间后丙装置析出芒硝(Na2SO4·10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入
您最近一年使用:0次
2018-10-19更新
|
487次组卷
|
5卷引用:【全国百强校】黑龙江省哈尔滨师范大学附属中学2018-2019学年高二上学期第一次月考化学试题
名校
2 . 某同学做了如下实验:
下列说法中不正确的是
| 装置 | 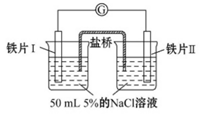 |  |
| 现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
| A.往铁片Ⅰ所在烧杯加入蒸馏水,电流表指针会发生偏转 |
| B.用K3[Fe(CN)3]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极 |
| C.铁片Ⅰ、Ⅲ的腐蚀速率不相等 |
| D.“电流计指针未发生偏转”,铁片Ⅰ、铁片Ⅱ均未被腐蚀 |
您最近一年使用:0次
名校
解题方法
3 . I.由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________ 。
(2)装置乙中正极的电极反应式是________________________________________ 。
(3)四种金属活泼性由强到弱的顺序是______________________ 。
II.分别按图所示甲、乙装置进行实验,图中两个烧杯中的溶液为相同浓度的稀硫酸,甲中A为电流表。
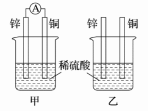
(1)下列叙述正确的是________ 。
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片作正极,乙中铜片作负极
C.两烧杯中溶液中的H+浓度均减小 D.产生气泡的速率甲中的比乙中的慢
(2)甲装置中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是________________________________________________________________________ 。
(3)甲装置中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应________________________ 。
| 装置 |  | 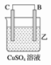 | 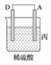 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是
(2)装置乙中正极的电极反应式是
(3)四种金属活泼性由强到弱的顺序是
II.分别按图所示甲、乙装置进行实验,图中两个烧杯中的溶液为相同浓度的稀硫酸,甲中A为电流表。

(1)下列叙述正确的是
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片作正极,乙中铜片作负极
C.两烧杯中溶液中的H+浓度均减小 D.产生气泡的速率甲中的比乙中的慢
(2)甲装置中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是
(3)甲装置中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应
您最近一年使用:0次
2018-07-17更新
|
615次组卷
|
4卷引用:【全国百强校】黑龙江省哈尔滨市第六中学2017-2018学年高一下学期期末考试化学试题
名校
4 . 铁是人类最早使用的金属,它在日常生活中的应用十分广泛。
I.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如下图所示:

①作负极的物质是______________ 。
②正极的电极反应式是_________________________________ 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
pH=4.5时,NO3-的去除率低。其原因是_____________________________ 。

II.铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法:首先检查制氧气装置的气密性,然后按上图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到实验现象为:①硬质玻璃管中干燥的团状细铁丝表面依然光亮,没有发生锈蚀;②硬质玻璃管中潮湿的团状细铁丝表面颜色变得灰暗,发生锈蚀;③烧杯中潮湿的团状细铁丝依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于_______ 。能表示其原理的正极反应式为________________________ 。
(2)大试管中发生的反应方程式为______________________________________ 。
(3)仪器A的名称为_______________ ,其中装的药品可以是_______________ 。
(4)有实验可知,决定铁生锈快慢的一个重要因素是___________________ 。
I.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如下图所示:

①作负极的物质是
②正极的电极反应式是
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 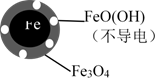 |  |
pH=4.5时,NO3-的去除率低。其原因是

II.铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法:首先检查制氧气装置的气密性,然后按上图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到实验现象为:①硬质玻璃管中干燥的团状细铁丝表面依然光亮,没有发生锈蚀;②硬质玻璃管中潮湿的团状细铁丝表面颜色变得灰暗,发生锈蚀;③烧杯中潮湿的团状细铁丝依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于
(2)大试管中发生的反应方程式为
(3)仪器A的名称为
(4)有实验可知,决定铁生锈快慢的一个重要因素是
您最近一年使用:0次
5 . 锌铜——稀硫酸原电池的装置如图所示,下列叙述错误的是
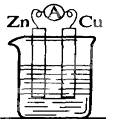

| A.电流从锌片经导线流向铜片 | B.锌是负极,其质量逐渐减小 |
| C.氢离子在铜表面被还原,产生气泡 | D.依据该实验现象可判断锌比铜活泼 |
您最近一年使用:0次
2018-07-04更新
|
114次组卷
|
2卷引用:【全国市级联考】湖北省襄阳市2017-2018学年高一下学期期末调研统一考试化学试题
解题方法
6 .
(1)下图原电池装置中,Zn是______ 极(填电极的名称),Cu表面上有___________________ (现象),外电路电子由________ (填电极的名称)通过导线流向_______ (填电极的名称); 溶液中_______ 离子向Cu极移动,________ 离子向Zn极移动。
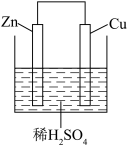
(2)写出电极反应式和总反应方程式:
Zn极:___________________________________________
Cu极:_________________________________________
总反应方程式:___________________________________
(1)下图原电池装置中,Zn是

(2)写出电极反应式和总反应方程式:
Zn极:
Cu极:
总反应方程式:
您最近一年使用:0次
名校
7 . 为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:
① 向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
② 向上述稀硫酸中插入铜片,没有看到有气泡生成;
③ 将锌片与铜片上端用导线连接,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快
④ 在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,不正确 的是
① 向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
② 向上述稀硫酸中插入铜片,没有看到有气泡生成;
③ 将锌片与铜片上端用导线连接,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快
④ 在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,
| A.实验①、②说明锌能与稀硫酸反应产生氢气,而铜不能 |
| B.实验③说明发生原电池反应时会加快化学反应速率 |
| C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
| D.实验④说明该装置可形成原电池 |
您最近一年使用:0次
名校
解题方法
8 . 某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
①通过实验2和3,可得出原电池的形成条件是______________________________ 。
②通过实验1和3,可得出原电池的形成条件是______________________________ 。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________ 。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________ 。
Cu棒:______________________________ 。
(3)实验3的电流是从________ 棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________ g。
(1)请填写有关实验现象并得出相关结论。
| 编号 | 实验装置 | 实验现象 |
| 1 | 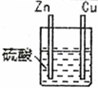 | 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
| 2 | 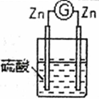 | 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
| 3 | 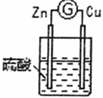 | 铜棒表面的现象是 |
①通过实验2和3,可得出原电池的形成条件是
②通过实验1和3,可得出原电池的形成条件是
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:
Cu棒:
(3)实验3的电流是从
您最近一年使用:0次
2018-07-16更新
|
645次组卷
|
6卷引用:【全国市级联考】河北省唐山市2017-2018学年高一下学期期末考试(A)化学试题
名校
9 . 用如图装置进行实验(A为电流计):
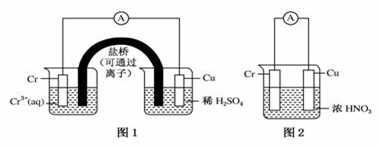
观察到现象:
装置图1:Cu电极上产生大量的无色气泡
装置图2:Cu电极上无气泡产生,而Cr电极上产生大量气泡
则下列说法正确的是

观察到现象:
装置图1:Cu电极上产生大量的无色气泡
装置图2:Cu电极上无气泡产生,而Cr电极上产生大量气泡
则下列说法正确的是
| A.图1是电解池,图2是原电池 |
| B.两个电池中,电子均由Cr电极流向Cu电极 |
| C.图2中Cr电极可能被浓HNO3钝化成惰性电极 |
| D.由实验现象可知金属活动性:Cu>Cr |
您最近一年使用:0次
2018-05-21更新
|
389次组卷
|
4卷引用:河北省唐山一中2017-2018学年高一下学期期中考试化学试题
10 . 工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电板上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是
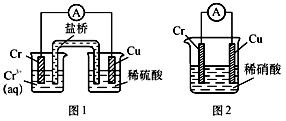

| A.图1为原电池装置,盐桥中的阴离子移向Cu电极的烧杯中 |
| B.由实验现象可知:金属活动性Cu>Cr |
| C.图2装置中Cu电极上发生的电极反应式为:Cu-2e-=Cu2+ |
| D.两个装置中,电子均由Cr电极流向Cu电极 |
您最近一年使用:0次
2018-04-10更新
|
241次组卷
|
2卷引用:重庆市第一中学2017-2018学年高二下学期第一次月考化学试题



