名校
1 . 阅读题目,回答问题:
(1)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为____ ,若将此反应设计成原电池,请写出该原电池负极电极反应为____ ,正极电极反应为____ 。
(2)为探究FeCl3在H2O2制取O2反应中的作用,某兴趣小组进行下列实验:向试管中加入5mL11mol·L-1H2O2溶液,静置几分钟,无明显现象;滴加2滴1mol·L-1FeCl3溶液,立即产生大量气泡。(已知H2O2不与Cl-反应)
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5mol·L-1,则20min内H2O2的平均反应速率为_____ 。
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以实验,可推断出:在H2O2制O2反应中,FeCl3作____ 剂。
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。
填写表中空白内容:II____ ,III____ ,IV____ 。
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

①该电池的正极是电极____ (填“a”或“b”),负极发生反应的方程式为____ 。
②电池工作时,溶液中的K+会向____ 区移动(填“正极”或“负极”),当外电路中转移1mol电子时,消耗的O2在标准状况下体积为____ 。
(1)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为
(2)为探究FeCl3在H2O2制取O2反应中的作用,某兴趣小组进行下列实验:向试管中加入5mL11mol·L-1H2O2溶液,静置几分钟,无明显现象;滴加2滴1mol·L-1FeCl3溶液,立即产生大量气泡。(已知H2O2不与Cl-反应)
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5mol·L-1,则20min内H2O2的平均反应速率为
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以实验,可推断出:在H2O2制O2反应中,FeCl3作
(3)H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。某兴趣小组为探究外界条件对H2O2分解反应速率的影响,设计如表所示实验。
| 试管编号 | 实验目的 | H2O2溶液 | 温度 | 水的体积/mL | FeCl3溶液体积/mL | |
| 质量分数 | 体积/mL | |||||
| I | 为编号II实验的参照 | 12% | 5.0 | 常温 | 0 | 0 |
| II | 温度对反应速率的影响 | —— | 5.0 | 60℃ | 0 | 0 |
| III | 为编号IV实验的参照 | 4.0% | 5.0 | 常温 | —— | 0 |
| IV | —— | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中空白内容:II
(4)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

①该电池的正极是电极
②电池工作时,溶液中的K+会向
您最近一年使用:0次
2 . 利用下列装置和试剂进行实验,能达到实验目的的是
A.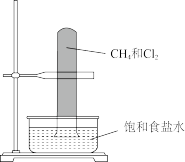 甲烷与氯气暗处发生取代反应 甲烷与氯气暗处发生取代反应 |
B. 比较Zn与Cu的金属性 比较Zn与Cu的金属性 |
C. 蒸干FeCl3溶液,制备无水FeCl3固体 蒸干FeCl3溶液,制备无水FeCl3固体 |
D.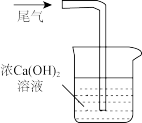 实验室处理尾气SO2 实验室处理尾气SO2 |
您最近一年使用:0次
2022-08-16更新
|
204次组卷
|
2卷引用:重庆市巴蜀中学2023届高三第一次高考适应性月考化学试题
解题方法
3 . 下列实验操作能达到实验目的的是
A.用瓷坩埚高温熔融 固体 固体 |
B.用 气体和NaOH溶液做喷泉实验 气体和NaOH溶液做喷泉实验 |
C.直接加热 固体制备氨气 固体制备氨气 |
| D.用Mg、Al、NaOH溶液设计一个原电池装置,且Mg做电池的负极 |
您最近一年使用:0次
2022-04-21更新
|
151次组卷
|
2卷引用:浙江省A9协作体2021-2022学年高一下学期 期中联考化学试题
解题方法
4 . 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。某课外实验小组欲探究铝和铜的金属性(原子失电子能力)强弱,同学们提出了如下实验方案:
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的反应现象
C.将铝片放入硫酸铜溶液,观察铝片上是否有红色物质
D.将铝片、铜片用导线连接后共同投入氢氧化钠溶液中接入电流计,观察电流方向
(1)上述方案中能达到实验目的的是_______ (填字母)。
(2)上述方案D中负极为_______ ,电极反应为_______ 。
(3)将纯锌片和纯铜片按如图所示方式插入500mL相同浓度的稀硫酸一段时间,两烧杯中均产生气泡,有同学认为产生气泡的位置相同,你赞同吗?请写出理由_______ 。

(4)当甲中产生2.24L(标准状况)气体时,将锌、铜片取出(设反应前后溶液体积不变),再将烧杯中的溶液稀释至1L,测得溶液中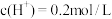 。试确定原稀硫酸的物质的量浓度为
。试确定原稀硫酸的物质的量浓度为_______ mol/L。
(5)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。
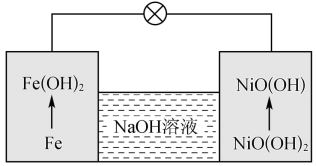
Fe放电生成 后,继续放电时,电极上的
后,继续放电时,电极上的 可转化为
可转化为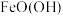 ,写出该过程的电极反应式:
,写出该过程的电极反应式:_______ 。
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的反应现象
C.将铝片放入硫酸铜溶液,观察铝片上是否有红色物质
D.将铝片、铜片用导线连接后共同投入氢氧化钠溶液中接入电流计,观察电流方向
(1)上述方案中能达到实验目的的是
(2)上述方案D中负极为
(3)将纯锌片和纯铜片按如图所示方式插入500mL相同浓度的稀硫酸一段时间,两烧杯中均产生气泡,有同学认为产生气泡的位置相同,你赞同吗?请写出理由

(4)当甲中产生2.24L(标准状况)气体时,将锌、铜片取出(设反应前后溶液体积不变),再将烧杯中的溶液稀释至1L,测得溶液中
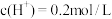 。试确定原稀硫酸的物质的量浓度为
。试确定原稀硫酸的物质的量浓度为(5)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。

Fe放电生成
 后,继续放电时,电极上的
后,继续放电时,电极上的 可转化为
可转化为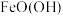 ,写出该过程的电极反应式:
,写出该过程的电极反应式:
您最近一年使用:0次
名校
解题方法
5 . 请回答下列问题:
(1)铅酸蓄电池是一种可充电电池,其总反应式为Pb+PbO2+2H2SO4 2PbSO4+2H2O,原电池负极的电极反应式为
2PbSO4+2H2O,原电池负极的电极反应式为_______ ,正极附近溶液的pH_______ (填“增大”、“不变”或“减小”)。
(2)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是_______ ,写出正极的电极反应式_______ 。若开始时两极质量相等,当导线中通过0.2mol电子时,两个电极的质量差为_______ 。
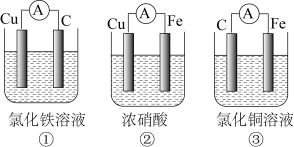
(3)乙醇燃料电池技术方面获得新突破,乙醇(CH3CH2OH)燃料电池的工作原理如图所示。
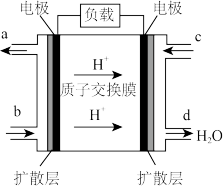
①该电池工作时,c入口处对应的电极为_______ (填“正”或“负”)极,b处入口的物质为_______
②工作一段时间后,当2.3 g乙醇完全反应生成CO2时,外电路中通过的电子数目为_______ 。
(1)铅酸蓄电池是一种可充电电池,其总反应式为Pb+PbO2+2H2SO4
 2PbSO4+2H2O,原电池负极的电极反应式为
2PbSO4+2H2O,原电池负极的电极反应式为(2)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是
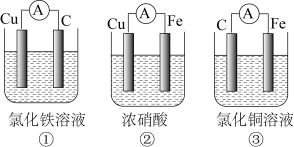
(3)乙醇燃料电池技术方面获得新突破,乙醇(CH3CH2OH)燃料电池的工作原理如图所示。

①该电池工作时,c入口处对应的电极为
②工作一段时间后,当2.3 g乙醇完全反应生成CO2时,外电路中通过的电子数目为
您最近一年使用:0次
2022-11-02更新
|
537次组卷
|
2卷引用:重庆市璧山来凤中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
6 . 化学反应在发生物质变化的同时伴随有能量的变化,是人类获取能量的重要途径,而许多能量的利用与化学反应中的能量变化密切相关。
I.完成下列问题
(1)H2(g) +Cl2(g)=2HCl(g)的反应过程如图所示:
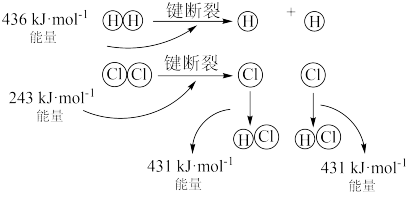
该反应为_______ (填“放热”或“吸热”)反应,其吸收或放出的热量为_______ 。
(2)下列变化中属于吸热反应的是_______ (填序号)。
①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④生石灰与水反应生成熟石灰
⑤CO2 +C 2CO
2CO
⑥Ba(OH)2·8H2O与固体NH4Cl混合
⑦C+ H2O(g)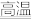 CO+ H2
CO+ H2
⑧Al与盐酸反应
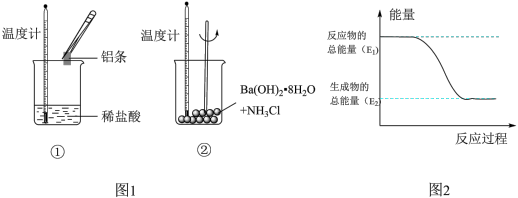
(3)某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。
若E1>E2,则该反应可用图_______ (填“A”或“B")表示。
Ⅱ.回答下列问题
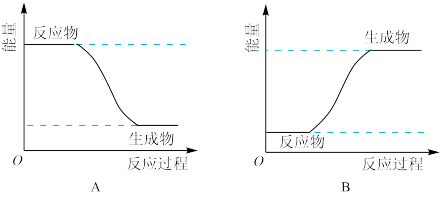
(4)为了验证Fe2+与Cu2+的氧化性强弱,如图装置能达到实验目的的是_______ (填装置序号),其正极的电极反应式为_______ ;若构建该原电池时两个电极的质量相等,当导线中通过0.4mol电子时,两个电极的质量差为_______ g。
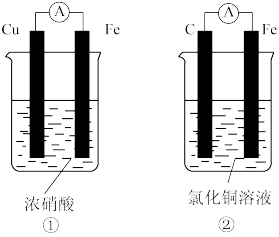
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得OH-定向移向A电极,则_______ (填“A”或“B”)处电极入口通CH4,其电极反应式为_______ 。
I.完成下列问题
(1)H2(g) +Cl2(g)=2HCl(g)的反应过程如图所示:

该反应为
(2)下列变化中属于吸热反应的是
①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④生石灰与水反应生成熟石灰
⑤CO2 +C
 2CO
2CO⑥Ba(OH)2·8H2O与固体NH4Cl混合
⑦C+ H2O(g)
 CO+ H2
CO+ H2⑧Al与盐酸反应
(3)某化学反应中,设反应物的总能量为E1,生成物的总能量为E2。

若E1>E2,则该反应可用图
Ⅱ.回答下列问题
(4)为了验证Fe2+与Cu2+的氧化性强弱,如图装置能达到实验目的的是

将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得OH-定向移向A电极,则

您最近一年使用:0次
名校
解题方法
7 . 下列实验装置和操作能达到实验目的或者对实验装置中的现象描述正确的是
A.+测定化学反应速率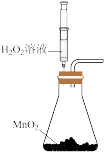 | B.锌被腐蚀、铜片上有气泡产生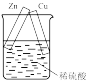 | C.探究不同催化剂对反应速率的影响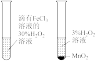 | D.组装原电池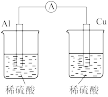 |
您最近一年使用:0次
2018-09-06更新
|
197次组卷
|
2卷引用:广东省深圳市龙华中学2021-2022学年高三下学期(二月第二次)半周测化学试题
8 . 用如图所示装置进行相应实验,能达到实验目的的是
| 选项 | A | B | C | D |
| 装置 | 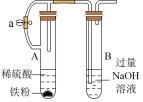 |  | 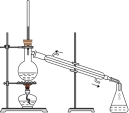 | 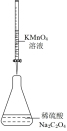 |
| 目的 | 制取 沉淀 沉淀 | 将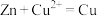 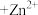 设计成原电池装置 设计成原电池装置 | 分离苯和硝基苯 | 测定 溶液的物质的量浓度 溶液的物质的量浓度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-18更新
|
1279次组卷
|
4卷引用:湖北省2022届高三5月联考化学试题
湖北省2022届高三5月联考化学试题(已下线)专题11 化学实验基础-三年(2020-2022)高考真题分项汇编青海省西宁市城西区青海师范大学附属实验中学2022-2023学年高二上学期12月月考化学试题 吉林省洮南市第一中学2022-2023学年高二上学期期末考试化学试题
解题方法
9 . Ⅰ.某实验小组同学进行如图1实验,以检验化学反应中的能量变化。请回答下列问题:
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是________ 热反应。反应过程________ (填“①”或“②”)的能量变化可用图2表示。
Ⅱ.A、B、C、D四种金属按下表中装置进行实验。
(2)根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向________ 极(填“A”或“B”)。
②装置乙中正极的电极反应式为________ 。
③装置丙中溶液的pH________ (填“变大”“变小”或“不变”)。
④四种金属活动性由强到弱的顺序是________ 。
⑤实验后同学们经过充分讨论,观察原电池反应特点,认真符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是________ 。
A.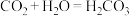 B.
B.
C.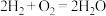 D.
D.

(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是
Ⅱ.A、B、C、D四种金属按下表中装置进行实验。
| 装置 | 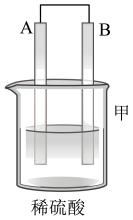 | 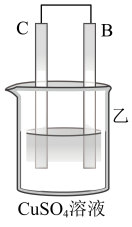 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中溶液中的阴离子移向
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属活动性由强到弱的顺序是
⑤实验后同学们经过充分讨论,观察原电池反应特点,认真符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是
A.
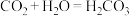 B.
B.
C.
 D.
D.
您最近一年使用:0次
解题方法
10 . 利用所学电化学反应原理,解决以下问题:
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。
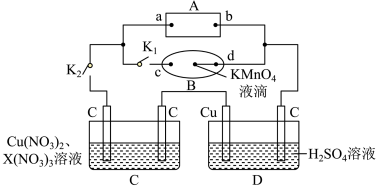
(1)闭合K1,断开K2,通电后,d端显红色,则电源b端为___________ 极,若c、d为惰性电极,检验c端产物的方法为___________ 。滤纸中央KMnO4溶液处发生的现象为___________ 。
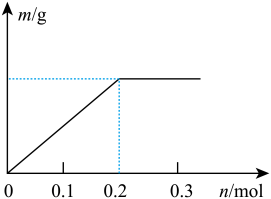
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2, 通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是___________ 。
(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是___________ 。
Ⅱ.电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :
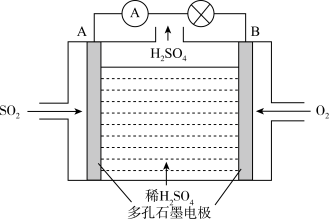
(4)电解质溶液中 离子向
离子向___________ (填“A极”或“B极” )移动。
(5)请写出负极电极反应式___________ 。
(6)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为___________ 。
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。

(1)闭合K1,断开K2,通电后,d端显红色,则电源b端为
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2, 通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是

(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是
Ⅱ.电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :

(4)电解质溶液中
 离子向
离子向(5)请写出负极电极反应式
(6)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为
您最近一年使用:0次
2023-07-25更新
|
89次组卷
|
2卷引用:甘肃省平凉市2022-2023学年高三上学期11月期中化学试题



