名校
解题方法
1 . 二氯化钒(VCl2)有强还原性和吸湿性,熔点为425°C、沸点为900°C,是制备多种医药、催化剂、含钒化合物的中间体。学习小组在实验室制备VCl2并进行相关探究。回答下列问题:
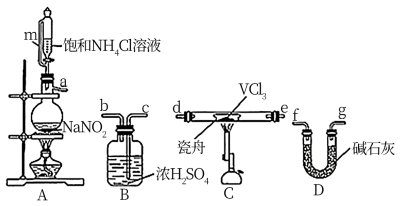
(1)小组同学通过VCl3分解制备VCl2。
①按气流方向,图中装置合理的连接顺序为_______ (用小写字母填空)。
②A中盛放NaNO2的仪器名称为_______ , 其中发生反应的离子方程式为_______ 。
③实验前需通入N2,其作用为_______ 。
(2)测定产品纯度:实验后产品中混有少量VCl3杂质。称量2.795g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.5000mol/LAgNO3标准溶液滴定Cl-,达到滴定终点时消耗标准液体积为100.00mL(Ag2CrO4为砖红色沉淀,杂质不参加反应)。
①滴定终点的现象为_______ 。
②产品中VCl3与VCl2的物质的量之比为_______ 。
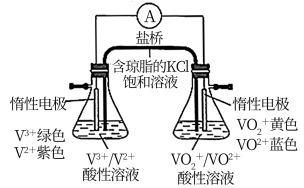
(3)小组同学进一步用如图所示装置比较含钒离子的还原性。接通电路后,观察到右侧锥形瓶中溶液蓝色逐渐变深,发生的电极反应式为_______ ,则VO2+、V2+的还原性较强的是_______ 。

(1)小组同学通过VCl3分解制备VCl2。
①按气流方向,图中装置合理的连接顺序为
②A中盛放NaNO2的仪器名称为
③实验前需通入N2,其作用为
(2)测定产品纯度:实验后产品中混有少量VCl3杂质。称量2.795g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.5000mol/LAgNO3标准溶液滴定Cl-,达到滴定终点时消耗标准液体积为100.00mL(Ag2CrO4为砖红色沉淀,杂质不参加反应)。
①滴定终点的现象为
②产品中VCl3与VCl2的物质的量之比为
(3)小组同学进一步用如图所示装置比较含钒离子的还原性。接通电路后,观察到右侧锥形瓶中溶液蓝色逐渐变深,发生的电极反应式为

您最近一年使用:0次
2021-05-02更新
|
820次组卷
|
2卷引用:2020年全国卷Ⅰ理综化学高考真题变式题
名校
解题方法
2 . 下列实验装置和操作能达到实验目的或者对实验装置中的现象描述正确的是
A.+测定化学反应速率 | B.锌被腐蚀、铜片上有气泡产生 | C.探究不同催化剂对反应速率的影响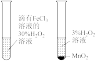 | D.组装原电池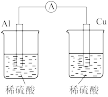 |
您最近一年使用:0次
2018-09-06更新
|
197次组卷
|
2卷引用:2018-2019学年苏教版高中化学必修二:专题综合测评2 化学反应与能量转化
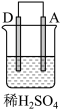
3 . 利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体积已转换为标准状况。下列说法正确的是
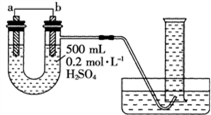

| A.a电极的电极材料是铜 |
| B.如果将稀硫酸换为CuSO4溶液,则不能达到实验目的 |
| C.锌与稀硫酸反应时放出的热量对实验测定不产生影响 |
| D.若量筒中收集到aLH2,则电解质溶液中通过了a/11.2mol电子 |
您最近一年使用:0次
2017-06-13更新
|
305次组卷
|
3卷引用:甘肃省天水市第一中学2016-2017学年高一下学期第二次月考(B卷)化学试题
名校
解题方法
4 . 由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是
| 实验装置与现象 | |||
| 装置 | 甲 | 乙 | 丙 |
 |  |  | |
| 现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
| A.装置甲中的B金属是原电池的负极 | B.装置乙中的C金属是原电池的阳极 |
| C.装置丙中的D金属是原电池的正极 | D.四种金属的活泼性顺序是D>A>B>C |
您最近一年使用:0次
2022-09-16更新
|
99次组卷
|
5卷引用:浙江省2018版考前特训(2017年10月):选考仿真测试卷(一)
名校
解题方法
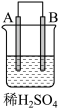
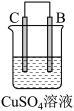
5 . 将质量相等的锌片和铜片用导线相连浸入500 mL硫酸铜溶液中构成如图的装置。
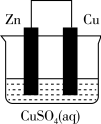
(1)此装置为___________ ,该装置中发生反应总的离子方程式为___________ ,铜片周围溶液会出现___________ 的现象。
(2)Cu电极是___________ (填“正极”或“负极”),写出其电极反应式___________ 。
(3)若2 min后测得锌片质量减少13 g,则导线中流过的电子为___________ mol。

(1)此装置为
(2)Cu电极是
(3)若2 min后测得锌片质量减少13 g,则导线中流过的电子为
您最近一年使用:0次
解题方法
6 . 应用电化学原理,回答下列问题:
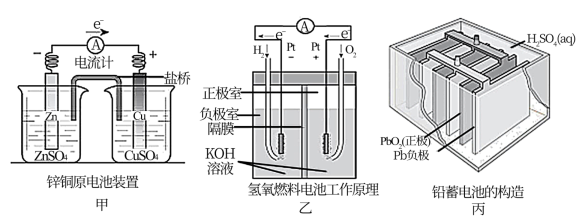
(1)上述三个装置中,负极反应物化学性质上的共同特点是_______ 。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是_______ 。
(3)乙中若将H2换成CH4,则负极反应式为_______ 。
(4)丙中铅蓄电池进行充电时,要将外接电源的负极与铅蓄电池_______ 极相连接。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
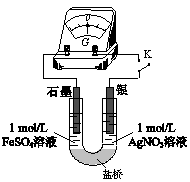
ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U形管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①实验ⅰ中银作_______ 极。
②综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是_______ 。

(1)上述三个装置中,负极反应物化学性质上的共同特点是
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是
(3)乙中若将H2换成CH4,则负极反应式为
(4)丙中铅蓄电池进行充电时,要将外接电源的负极与铅蓄电池
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:

ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U形管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
①实验ⅰ中银作
②综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是
您最近一年使用:0次
名校
解题方法
7 . 电化学原理在探究物质性质和实际生产中应用广泛,据此回答下列问题。
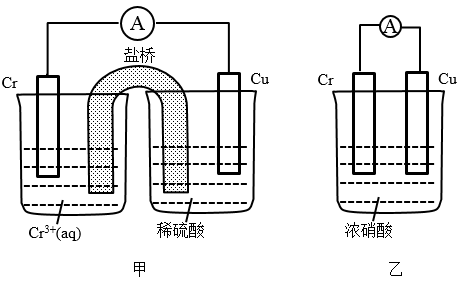
(1)在如图装置中,观察到装置甲铜电极上产生大量的无色气体;而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由装置甲知铬的金属活动性比铜__ (填“强”或“弱”);由装置乙知常温下铬在浓硝酸中出现__ 现象。
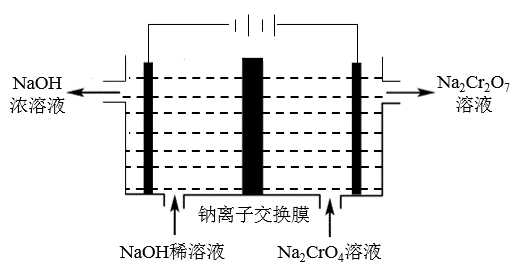
(2)工业上使用如图装置,以石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为__ 。
(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(Ⅵ)转化为Cr(Ⅲ)常见的处理方法是电解法和铁氧磁体法。
①电解法:将含Cr2O 的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl进行电解,使阳极产物和Cr2O
的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl进行电解,使阳极产物和Cr2O 发生反应,则阳极的电极反应式为
发生反应,则阳极的电极反应式为__ 。阴极上Cr2O 、H+、Fe3+都可能放电。若Cr2O
、H+、Fe3+都可能放电。若Cr2O 放电,则阴极的电极反应式为
放电,则阴极的电极反应式为__ ;若H+放电,则阴极区形成Fe(OH)3和Cr(OH)3沉淀。
②铁氧磁体法:在含Cr(Ⅵ)的废水中加入绿矾,在pH<4时发生反应使Cr(Ⅵ)转化为Cr(Ⅲ),调节溶液pH为6~8,使溶液中的Fe(Ⅱ)、Fe(Ⅲ)、Cr(Ⅲ)析出组成相当于Fe(Ⅱ)[Fe(Ⅲ)x•Cr(Ⅲ)2-x]O4(铁氧磁体)的沉淀,则铁氧磁体中x=___ 。
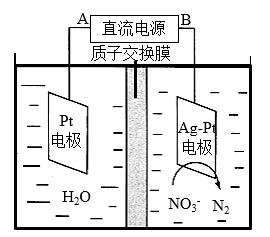
(4)电解法还可用于处理酸性硝酸盐污水,设计如图电解池。若电解过程中转移了0.1mol电子,则质子交换膜两侧电解液的质量变化差(△m左−△m右)为___ g。

(1)在如图装置中,观察到装置甲铜电极上产生大量的无色气体;而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由装置甲知铬的金属活动性比铜
(2)工业上使用如图装置,以石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为

(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(Ⅵ)转化为Cr(Ⅲ)常见的处理方法是电解法和铁氧磁体法。
①电解法:将含Cr2O
 的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl进行电解,使阳极产物和Cr2O
的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl进行电解,使阳极产物和Cr2O 发生反应,则阳极的电极反应式为
发生反应,则阳极的电极反应式为 、H+、Fe3+都可能放电。若Cr2O
、H+、Fe3+都可能放电。若Cr2O 放电,则阴极的电极反应式为
放电,则阴极的电极反应式为②铁氧磁体法:在含Cr(Ⅵ)的废水中加入绿矾,在pH<4时发生反应使Cr(Ⅵ)转化为Cr(Ⅲ),调节溶液pH为6~8,使溶液中的Fe(Ⅱ)、Fe(Ⅲ)、Cr(Ⅲ)析出组成相当于Fe(Ⅱ)[Fe(Ⅲ)x•Cr(Ⅲ)2-x]O4(铁氧磁体)的沉淀,则铁氧磁体中x=
(4)电解法还可用于处理酸性硝酸盐污水,设计如图电解池。若电解过程中转移了0.1mol电子,则质子交换膜两侧电解液的质量变化差(△m左−△m右)为

您最近一年使用:0次
8 . 原电池是将化学能转化为电能的装置,某兴趣小组利用数据采集器和传感器等仪器对原电池进行实验探究。
I.能量变化探究
将上表的现象和结论补充完整
(1)_____________
(2)__________ 、__________
II.原电池电压影响因素的测定
如图所示,在培养皿中进行微型实验,用浸有饱和KNO3溶液的滤纸充当盐桥,在滤纸间隔位置放置金属片,并滴三滴相应溶液,用电压传感器的两个探头分别与不同的金属表面接触形成闭合回路,测定电压。
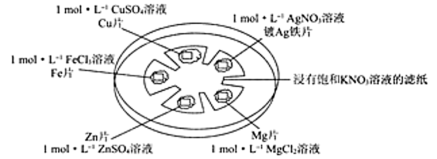
(3)准确配制一定物质的量浓度的溶液时,操作X应在__________ (填字母)之间。
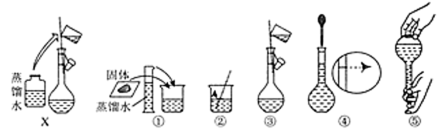
A.②③ B.③④ C.④⑤
(4)以上五种金属的活动性由活泼到不活泼的顺序为_________________ 。
(5)实验条件下,连接不同金属片时所得数据见下表,表中Y极代表__________ (填“正”或“负”)极,预测表中Ag和Zn相连接时,测得电压的数值a可能的范围为____________ ;Fe和Mg相连接时,Z极的电极反应式为__________ ,Y极的电极反应式为____________ 。
I.能量变化探究
| 实验操作 | 数据及图象 | 现象与结论 |
| 将60mL1mol/LCuSO4溶液置于100mL烧杯中,向其中加入1g镁粉 | 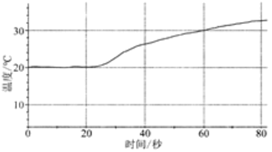 | (1)反应过程中,化学能直接转化为 能; |
| 将60mL1mol/LCuSO4溶液置于100mL烧杯中,平行插入铜片和镁片,与电流传感器形成闭合回路 | 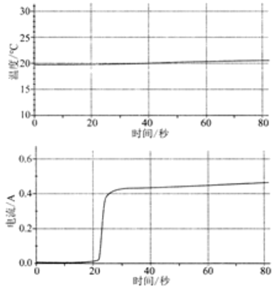 | (2)体系温度变化很小,原因是 ;反应过程中,镁片和铜片的质量变化分别为: ; |
(1)
(2)
II.原电池电压影响因素的测定
如图所示,在培养皿中进行微型实验,用浸有饱和KNO3溶液的滤纸充当盐桥,在滤纸间隔位置放置金属片,并滴三滴相应溶液,用电压传感器的两个探头分别与不同的金属表面接触形成闭合回路,测定电压。

(3)准确配制一定物质的量浓度的溶液时,操作X应在

A.②③ B.③④ C.④⑤
(4)以上五种金属的活动性由活泼到不活泼的顺序为
(5)实验条件下,连接不同金属片时所得数据见下表,表中Y极代表
| Y极 | Z极 | 测得电压/V |
| Ag | Fe | 1.009 |
| Ag | Zn | a |
| Ag | Mg | 2.114 |
| Fe | Zn | 0.473 |
| Fe | Mg | 1.111 |
| Zn | Mg | 0.636 |
您最近一年使用:0次
解题方法
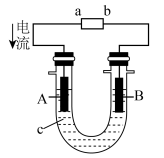
9 . (1)在如图所示的原电池中,___ 是负极,发生___ 反应,正极的现象___ ,电池反应的化学方程式为___ 。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为CH4+2O2+2KOH═K2CO3+3H2O。

①实验测得OH-定向移向B电极,则___ 处电极入口通甲烷(填A或B)。
②当消耗甲烷的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为___ 。
(3)如用电解法精炼粗铜,电解液c选用CuSO4溶液,则:
①A电极的材料是___ ,电极反应式是___ ;
②B电极的材料是__ ,电极反应式是___ 。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为CH4+2O2+2KOH═K2CO3+3H2O。

①实验测得OH-定向移向B电极,则
②当消耗甲烷的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
(3)如用电解法精炼粗铜,电解液c选用CuSO4溶液,则:
①A电极的材料是
②B电极的材料是

您最近一年使用:0次
解题方法
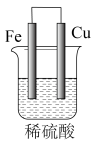
10 . 实验小组的同学们将三种金属按照下表的装置进行实验。回答问题:
(1)装置甲中铁极的电极反应式是____________ ,溶液中H+向_____ 极移动(填“正”或“负”)。
(2)装置乙中铜极发生____________ (填“氧化”或“还原”)反应。
(3)装置丙中M极为______ (填“正极”或“负极”),一段时间后溶液的酸性_____________ (填“增强”“减弱”或“不变”)。
(4)Fe、Cu、M中金属活动性最强的是_____________ 。
| 序号 | 甲 | 乙 | 丙 |
| 装置 |  | 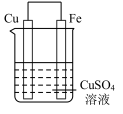 | 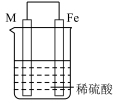 |
| 现象 | 溶液变为浅绿色,Cu极产生大量气泡 | Cu极的质量增加 | M极的质量减少 |
(1)装置甲中铁极的电极反应式是
(2)装置乙中铜极发生
(3)装置丙中M极为
(4)Fe、Cu、M中金属活动性最强的是
您最近一年使用:0次
2020-08-08更新
|
111次组卷
|
3卷引用:青海省西宁市2019-2020学年高一下学期期末调研测试化学试题



