解题方法
1 . 某兴趣小组用下图装置研究原电池的工作原理。
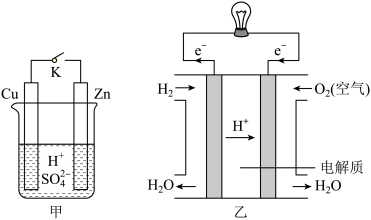
(1)甲中K断开时,装置中发生反应的离子方程式为_________ ;K闭合时,Cu棒上的现象为________ ,外电路电流的方向由_______ (填“Cu到Zn”或“Zn到Cu”)。
(2)乙图为氢氧燃料电池构造示意图,其中通入氧气的电极为电池的____ 极(填“正”或负”),电极反应为________________ 。

(1)甲中K断开时,装置中发生反应的离子方程式为
(2)乙图为氢氧燃料电池构造示意图,其中通入氧气的电极为电池的
您最近一年使用:0次
解题方法
2 . 某兴趣小组用下图装置研究原电池的工作原理。
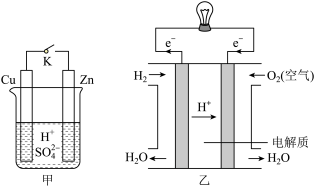
(1)甲中K断开时,装置中发生反应的离子方程式为_______________________ ;K闭合时,Cu棒上的现象为________ ,它为原电池的________ (填“正”或“负”)极。
(2)乙图为氢氧燃料电池构造示意图,其中通入氢气的一极为电池的________ (填“正”或“负”)极,发生________ (填“氧化”或“还原”)反应。
(3)某同学欲把反应Fe+2FeCl3=3FeCl2设计成原电池,请写出负极的电极反应式:_______________________________________________ 。

(1)甲中K断开时,装置中发生反应的离子方程式为
(2)乙图为氢氧燃料电池构造示意图,其中通入氢气的一极为电池的
(3)某同学欲把反应Fe+2FeCl3=3FeCl2设计成原电池,请写出负极的电极反应式:
您最近一年使用:0次
解题方法
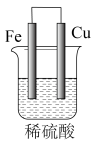
3 . (1)在如图所示的原电池中,___ 是负极,发生___ 反应,正极的现象___ ,电池反应的化学方程式为___ 。
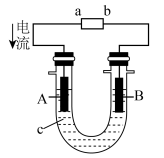
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为CH4+2O2+2KOH═K2CO3+3H2O。

①实验测得OH-定向移向B电极,则___ 处电极入口通甲烷(填A或B)。
②当消耗甲烷的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为___ 。
(3)如用电解法精炼粗铜,电解液c选用CuSO4溶液,则:
①A电极的材料是___ ,电极反应式是___ ;
②B电极的材料是__ ,电极反应式是___ 。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为CH4+2O2+2KOH═K2CO3+3H2O。

①实验测得OH-定向移向B电极,则
②当消耗甲烷的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为
(3)如用电解法精炼粗铜,电解液c选用CuSO4溶液,则:
①A电极的材料是
②B电极的材料是

您最近一年使用:0次
解题方法
4 . 已知可逆反应: 。设计如图所示装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导电作用)。
。设计如图所示装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导电作用)。
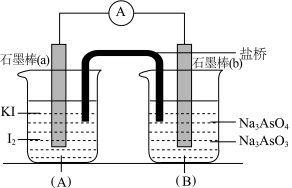
进行如下操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现电流表指针偏转;
(Ⅱ)若改往(B)烧杯中滴加质量分数为40%的NaOH溶液,发现电流表指针向相反方向偏转。
(1)两次操作过程中电流表指针偏转方向为什么会相反?
试用电极反应和化学平衡移动的原理解释此现象:____________________________________ 。
(2)(Ⅰ)操作过程中石墨棒(a)上发生的电极反应为____________________________________ 。
(3)(Ⅱ)操作过程中石墨棒(b)上发生的电极反应为____________________________________ 。
 。设计如图所示装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导电作用)。
。设计如图所示装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导电作用)。
进行如下操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现电流表指针偏转;
(Ⅱ)若改往(B)烧杯中滴加质量分数为40%的NaOH溶液,发现电流表指针向相反方向偏转。
(1)两次操作过程中电流表指针偏转方向为什么会相反?
试用电极反应和化学平衡移动的原理解释此现象:
(2)(Ⅰ)操作过程中石墨棒(a)上发生的电极反应为
(3)(Ⅱ)操作过程中石墨棒(b)上发生的电极反应为
您最近一年使用:0次
5 . (1)合成氨工业是煤化工产业链中非常重要的一步。已知有一组数据:破坏1molN2中的 键需要吸收
键需要吸收 能量;破坏
能量;破坏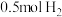 中的
中的 键需要吸收
键需要吸收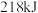 能量;形成
能量;形成 中的
中的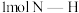 键能释放
键能释放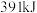 能量。图表示合成氨工业过程中能量的变化,请将图中①②的能量变化的数值填在横线上。
能量。图表示合成氨工业过程中能量的变化,请将图中①②的能量变化的数值填在横线上。
①________________  ,②
,②____________________  。
。

(2)用A、B、C、D四种金属按如表所示的装置进行实验。
根据实验现象回答下列问题:
①装置甲中负极的电极反应式为__________________ 。
②装置乙中正极的电极反应式为________________ 。
③装置丙中溶液的pH________ (填“变大”“变小”或“不变”)。
④四种金属的活动性由强到弱的顺序是________ 。
(3)一定温度下,在体积为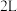 的恒容密闭容器中充入
的恒容密闭容器中充入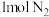 和
和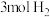 ,发生反应
,发生反应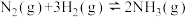 ,测得
,测得 的物质的量随时间的变化如图所示。
的物质的量随时间的变化如图所示。
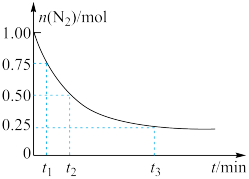
从开始反应到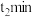 ,用
,用 表示的化学反应速率为
表示的化学反应速率为_________ 。
 键需要吸收
键需要吸收 能量;破坏
能量;破坏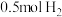 中的
中的 键需要吸收
键需要吸收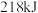 能量;形成
能量;形成 中的
中的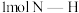 键能释放
键能释放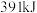 能量。图表示合成氨工业过程中能量的变化,请将图中①②的能量变化的数值填在横线上。
能量。图表示合成氨工业过程中能量的变化,请将图中①②的能量变化的数值填在横线上。①
 ,②
,② 。
。
(2)用A、B、C、D四种金属按如表所示的装置进行实验。
| 装置 |  甲 |  乙 |  丙 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置甲中负极的电极反应式为
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属的活动性由强到弱的顺序是
(3)一定温度下,在体积为
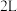 的恒容密闭容器中充入
的恒容密闭容器中充入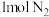 和
和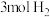 ,发生反应
,发生反应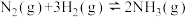 ,测得
,测得 的物质的量随时间的变化如图所示。
的物质的量随时间的变化如图所示。
从开始反应到
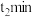 ,用
,用 表示的化学反应速率为
表示的化学反应速率为
您最近一年使用:0次
2020-09-24更新
|
650次组卷
|
3卷引用:鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 章末综合检测卷
解题方法
6 . 实验小组的同学们将三种金属按照下表的装置进行实验。回答问题:
(1)装置甲中铁极的电极反应式是____________ ,溶液中H+向_____ 极移动(填“正”或“负”)。
(2)装置乙中铜极发生____________ (填“氧化”或“还原”)反应。
(3)装置丙中M极为______ (填“正极”或“负极”),一段时间后溶液的酸性_____________ (填“增强”“减弱”或“不变”)。
(4)Fe、Cu、M中金属活动性最强的是_____________ 。
| 序号 | 甲 | 乙 | 丙 |
| 装置 |  | 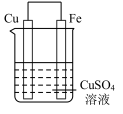 | 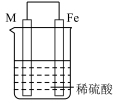 |
| 现象 | 溶液变为浅绿色,Cu极产生大量气泡 | Cu极的质量增加 | M极的质量减少 |
(1)装置甲中铁极的电极反应式是
(2)装置乙中铜极发生
(3)装置丙中M极为
(4)Fe、Cu、M中金属活动性最强的是
您最近一年使用:0次
2020-08-08更新
|
115次组卷
|
3卷引用:青海省西宁市2019-2020学年高一下学期期末调研测试化学试题
解题方法
7 . 如图所示装置:
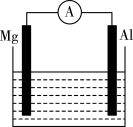
(1)若烧杯中溶液为稀硫酸,则观察到的现象为________ 。两极反应式为:正极________ ;负极________ 。该装置将________ 能转化为________ 能,原电池中的H+向______ (Mg、Al)极移动。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________ ,带_______ (正、负)电;总反应方程式为________ 。

(1)若烧杯中溶液为稀硫酸,则观察到的现象为
(2)若烧杯中溶液为氢氧化钠溶液,则负极为
您最近一年使用:0次
名校
解题方法
8 . 由下列实验操作和现象得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向Co2O3中滴加浓盐酸 | 产生黄绿色气体 | 氧化性:Cl2>Co2O3 |
| B | 在镁、铝为电极,氢氧化钠为电解质的原电池装置 | 镁表面有气泡 | 金属活动性:Al>Mg |
| C | 测定等物质的量浓度的NaCl与Na2CO3溶液的pH | 后者较大 | 非金属性:Cl>C |
| D | 将10 mL 2 mol/L的KI溶液与1 mL 1 mol/L FeCl3溶液混合充分反应后滴加KSCN溶液 | 溶液颜色变红 | KI与FeCl3的反应具有可逆性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 如图设计的串联电池装置,R为变阻器,以调节电路电流。
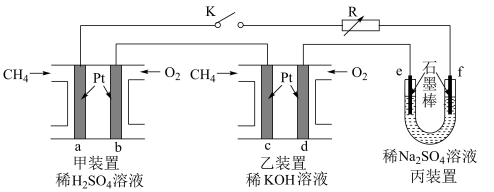
(1)写出b、c电极的电极反应式:b___ ,c___ ;
(2)写出f电极的电极反应式___ ,向此电极区域滴入酚酞的现象为:___ ;该电极区域水的电离平衡被___ (填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH___ (填“变大”、“变小”或“不变”),原因是___ 。
(4)电解一段时间后丙装置析出芒硝(Na2SO4•10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入___ gH2O就可以将析出的沉淀溶解并恢复到原有浓度。
(5)有一硝酸盐晶体,其化学式为M(NO3)x•yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.0100mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.320g。则
①金属M的相对原子质量为___ ;
②电解后,生成气体体积=___ (标准状况下)溶液的pH=___ (电解过程中溶液体积变化忽略不计)。要求写出计算过程。

(1)写出b、c电极的电极反应式:b
(2)写出f电极的电极反应式
(3)闭合K一段时间后,丙装置的电解质溶液pH
(4)电解一段时间后丙装置析出芒硝(Na2SO4•10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入
(5)有一硝酸盐晶体,其化学式为M(NO3)x•yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.0100mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.320g。则
①金属M的相对原子质量为
②电解后,生成气体体积=
您最近一年使用:0次
解题方法
10 . 由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题(用符号A、B、C、D回答下列问题)
(1)装置甲中负极 为___ 。装置丙中负极 为__ 。
(2)装置乙中正极 的电极反应式是___ 。
(3)四种金属活泼性由强到弱 的顺序是___ 。
| 装置 |  甲 甲 |  乙 乙 |  丙 丙 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题(用符号A、B、C、D回答下列问题)
(1)装置甲中
(2)装置乙中
(3)四种金属活泼性
您最近一年使用:0次



