1 . 某科学探究小组为探究电化学原理, 设计了如图所示的装置进行探究实验。下列对实验中观察到的现象或相关结论的叙述错误的是
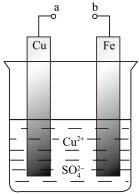

| A.a和b不连接时,铁片上有红色的铜析出 |
| B.a和b用导线连接时, 铜片为负极 |
| C.无论a和b是否连接,反应的本质相同,铁片均会被氧化,溶液中均有Fe2+生成 |
| D.a和b用导线连接时,溶液中的Cu2+应向铜电极移动且能更快地在铜电极上析出铜 |
您最近一年使用:0次
解题方法
2 . 某实验小组为探究CuSO4与Na2SO3反应后的产物,做如下探究实验。
【查阅资料】
①Cu2O为砖红色固体,不溶于水;
②Cu2SO3为黄色固体,不溶于水;
③[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
实验1:①向2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃ 2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol∙L-1的Na2SO3溶液中滴加0.2mol∙L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)S元素在元素周期表中的位置为_______ 。N、O、S三种元素原子的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:_______ 。
(3)经检验,实验2所得溶液中有大量 、
、 生成。该实验中Cu2+表现
生成。该实验中Cu2+表现_______ 性,写出该实验中反应的离子方程式:_______ 。
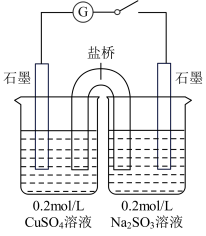
(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做_______ (填“正”或“负”)极,右侧烧杯中发生反应的电极反应式为_______ 。设计实验检验右侧烧杯中生成的阴离子,写出具体操作、现象和结论:_______ 。
【查阅资料】
①Cu2O为砖红色固体,不溶于水;
②Cu2SO3为黄色固体,不溶于水;
③[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
实验1:①向2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃ 2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol∙L-1的Na2SO3溶液中滴加0.2mol∙L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)S元素在元素周期表中的位置为
(2)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:
(3)经检验,实验2所得溶液中有大量
 、
、 生成。该实验中Cu2+表现
生成。该实验中Cu2+表现(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做

您最近一年使用:0次
解题方法
3 . 如图是原电池电解池的组合装置图。
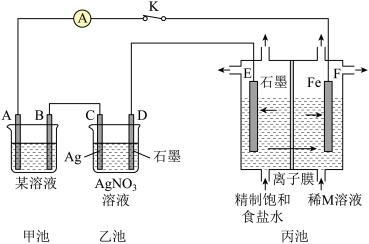
请回答:
(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为Fe,B为碳棒。则:
①甲池为_______ (填“原电池”或“电解池”);B电极上发生的现象为_______ 。
②乙池中的银电极上的电极反应式为_______ 。
③闭合K一段时间后,稀M溶液的浓度会增加,则M溶液中的溶质是_______ (填化学式);丙池中的离子膜为_______ (填“阳离子交换膜”或“阴离子交换膜”)
(2)若将甲池的某溶液改为FeCl3,电极材料A为Cu、B为碳棒,则甲池的总反应的离子方程式为_______ 。

请回答:
(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为Fe,B为碳棒。则:
①甲池为
②乙池中的银电极上的电极反应式为
③闭合K一段时间后,稀M溶液的浓度会增加,则M溶液中的溶质是
(2)若将甲池的某溶液改为FeCl3,电极材料A为Cu、B为碳棒,则甲池的总反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。
Ⅰ.用图甲所示装置进行第一组实验时:
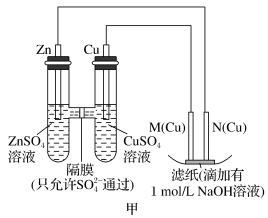
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是_______(填字母)。
(2)实验过程中,
_______ (填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象是_______ 。
Ⅱ.该小组同学用图乙所示装置打算进行二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根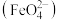 在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
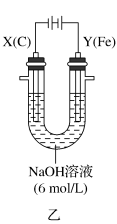
(3)电解过程中,X极处溶液的 浓度
浓度_______ (填“增大”“减小”或“不变)。
(4)电解过程中,Y极发生的电极反应为 和
和_______ 。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电板(铁电极)质量减小0.28g,则在Y极收集到气体为_______ mL(均已折算为标准状况时气体体积)。
(6)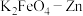 也可以组成碱性电池,
也可以组成碱性电池, 在电池中作为正极材料,其电池反应总反应式为
在电池中作为正极材料,其电池反应总反应式为 ,该电池正极发生的电极反应式为
,该电池正极发生的电极反应式为_______ 。
Ⅰ.用图甲所示装置进行第一组实验时:

(1)在保证电极反应不变的情况下,不能替代Cu作电极的是_______(填字母)。
| A.石墨 | B.镁 | C.银 | D.铂 |

Ⅱ.该小组同学用图乙所示装置打算进行二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根
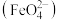 在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极处溶液的
 浓度
浓度(4)电解过程中,Y极发生的电极反应为
 和
和(5)电解进行一段时间后,若在X极收集到672mL气体,Y电板(铁电极)质量减小0.28g,则在Y极收集到气体为
(6)
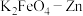 也可以组成碱性电池,
也可以组成碱性电池, 在电池中作为正极材料,其电池反应总反应式为
在电池中作为正极材料,其电池反应总反应式为 ,该电池正极发生的电极反应式为
,该电池正极发生的电极反应式为
您最近一年使用:0次
5 . 回答下列问题
I:
(1) 的燃烧热为
的燃烧热为 ,则表示液态甲醇燃烧热的热化学方程式为
,则表示液态甲醇燃烧热的热化学方程式为___________ 。
II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
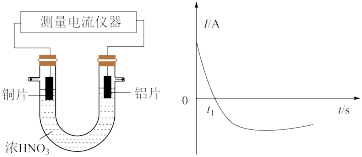
(2)利用反应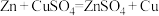 设计成原电池,该原电池的电解质溶液为
设计成原电池,该原电池的电解质溶液为___________ ,若开始时两电极质量相等,当电路中转移0.2mol电子后,两电极的质量差___________ g。
(3)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了下图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中 时刻之前,正极反应式为
时刻之前,正极反应式为___________ , 时刻之后,Cu电极是
时刻之后,Cu电极是___________ (填“正极”或“负极”)。据以上现象,最终得出结论:在原电池中,构成原电池的负极不一定是较活泼的金属材料。
III.现在容积为2L的恒温密闭容器中,充入 和
和 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。
(4)下列说法正确的是___________ 。
A.使用催化剂可以增大反应速率,提高生产效率
B.反应达到平衡后,反应不再进行
C.通过改变反应条件,能改变该反应进行的限度,使 全部转化为
全部转化为
(5)达平衡时, 的转化率为
的转化率为___________ 。
I:
(1)
 的燃烧热为
的燃烧热为 ,则表示液态甲醇燃烧热的热化学方程式为
,则表示液态甲醇燃烧热的热化学方程式为II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

(2)利用反应
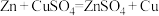 设计成原电池,该原电池的电解质溶液为
设计成原电池,该原电池的电解质溶液为(3)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了下图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中
 时刻之前,正极反应式为
时刻之前,正极反应式为 时刻之后,Cu电极是
时刻之后,Cu电极是III.现在容积为2L的恒温密闭容器中,充入
 和
和 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。| 时间 | 0min | 3min | 6min | 9min | 12min |
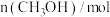 | 0 | 0.50 | 0.65 | 0.75 | 0.75 |
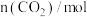 | 1 | 0.50 | 0.35 | A | 0.25 |
A.使用催化剂可以增大反应速率,提高生产效率
B.反应达到平衡后,反应不再进行
C.通过改变反应条件,能改变该反应进行的限度,使
 全部转化为
全部转化为
(5)达平衡时,
 的转化率为
的转化率为
您最近一年使用:0次
解题方法
6 . 我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀。下列说法错误的是
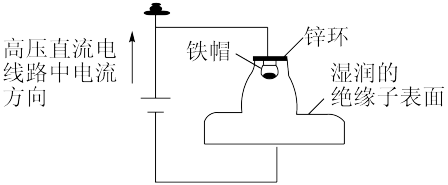

A.断电时,锌环上的电极反应为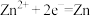 |
| B.断电时,仍能防止铁帽被腐蚀 |
| C.通电时,锌环是阳极,发生氧化反应 |
| D.通电时,该装置为外加电流的阴极保护法 |
您最近一年使用:0次
7 . 下列实验操作、对应的现象及结论均正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向苯酚浊液中滴加Na2CO3溶液,浊液变澄清 | 酸性:苯酚>碳酸 |
| B |  溶液中加入少量 溶液中加入少量 溶液,有砖红色沉淀( 溶液,有砖红色沉淀( )生成 )生成 | 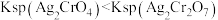 |
| C | 将镁片和铝片用导线连接后插入NaOH溶液中,镁片表面产生气泡 | 该装置构成了原电池,铝片做负极 |
| D | 向某溶液中加入稀NaOH溶液,用湿润的红色石蕊试纸检验,无明显现象 | 溶液中一定无 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 能源是现代文明的原动力,电池与我们的生活和生产密切相关。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_______(填字母)。
(2)下图为原电池装置示意图:
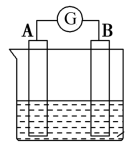
①若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式:_______ ,反应过程中溶液的酸性_______ (填“增强”、“减弱”或“不变”)。一段时间后,当电池中放出1.68 L(标准状况)气体时,电路中有_______ 个电子通过了导线(用NA表示阿伏加德罗常数的值)。
②若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为_______ (填“正极”或“负极”);写出该电极的电极反应式:_______ 。
③燃料电池是一种具有应用前景的绿色电源, 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是_______ (填“正极”或“负极”),若线路中转移2 mol电子,则该燃料电池理论上消耗的 在标准状况下的体积为
在标准状况下的体积为_______ L。

④为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是_______ (填序号)。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_______(填字母)。
A. | B. |
C. | D. |

①若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式:
②若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为
③燃料电池是一种具有应用前景的绿色电源,
 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是 在标准状况下的体积为
在标准状况下的体积为
④为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是
| 方案 | 现象或产物 |
A.将铁片置于 溶液中 溶液中 | 铁片上有亮红色物质析出 |
| B.将铁丝和铜丝分别在氯气燃烧 | 产物分别为 和 和 |
| C.将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| D.将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连 | 铁片溶解,铜片上有气泡产生 |
您最近一年使用:0次
名校
解题方法
9 . 某同学以柠檬为材料自制水果电池,装置如图,下列叙述正确的是
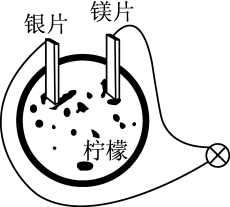

A. 由镁极区移向银极区 由镁极区移向银极区 | B.镁片上有无色气体放出 |
| C.铜片替代镁片,现象相同 | D.银片为负极 |
您最近一年使用:0次
2022-04-04更新
|
369次组卷
|
3卷引用:安徽省合肥市第八中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
10 . 实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
(1)实验1中,电解质溶液为盐酸,铝条做原电池的___________ 极
【实验2】
将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为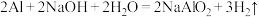 ,据此推测应该出现的实验现象为
,据此推测应该出现的实验现象为___________
实验2实际获得的现象如下:
(3)ⅰ中铝条表面放电的物质足溶解在溶液中的 ,则该电极反应式为
,则该电极反应式为___________
(4)ⅱ中“电流计指针逐渐向零刻度恢复”的原因是___________
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
(5)根据实验3和实验4可获得的正确推论是___________(填字母序号)
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与___________ 等因素有关
【实验1】
| 装置 | 实验现象 |
 | 左侧装置电流计指针向右偏转,灯泡亮 右侧装置电流计指针向右偏转,镁条、铝条表面产生无色气泡 |
【实验2】
将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为
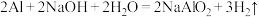 ,据此推测应该出现的实验现象为
,据此推测应该出现的实验现象为实验2实际获得的现象如下:
| 装置 | 实验现象 |
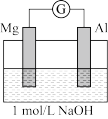 | ⅰ.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡 ⅱ.电流计指针逐渐向零刻度恢复,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出 |
 ,则该电极反应式为
,则该电极反应式为(4)ⅱ中“电流计指针逐渐向零刻度恢复”的原因是
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
| 编号 | 装置 | 实验现象 |
| 实验3 | 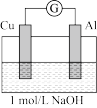 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
| 实验4 | 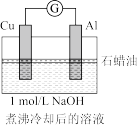 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
A.上述两装置中,开始时铜片表面得电子的物质是 |
| B.铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关 |
C.铜片表面产生的气泡为 |
D.由“铝条表面气泡略有减少”能推测 在铜片表面得电子 在铜片表面得电子 |
您最近一年使用:0次



