名校
解题方法
1 . 根据化学能转化电能的相关知识,回答下列问题:
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是_______ ,发生_______ 反应,电解质溶液是_______ 。
(2)正极上出现的现象是___________________ 。
(3)若导线上转移电子1 mol,则生成银___________________ g。
Ⅱ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
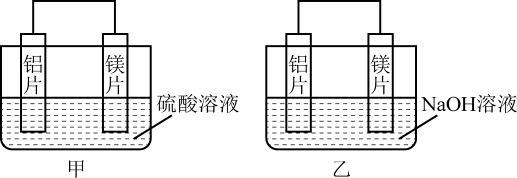
(4)写出甲中正极的电极反应式:___________________ 。
(5)乙中负极为___________________ ,总反应的离子方程式:___________________ 。
(6)如果甲与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验实验得出的下列结论中,正确的有___________________。
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是
(2)正极上出现的现象是
(3)若导线上转移电子1 mol,则生成银
Ⅱ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。

(4)写出甲中正极的电极反应式:
(5)乙中负极为
(6)如果甲与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验实验得出的下列结论中,正确的有___________________。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析 |
您最近一年使用:0次
2022-01-07更新
|
92次组卷
|
3卷引用:湖北省黄石市有色一中2020-2021学年高一下学期期末考试化学试题
名校
解题方法
2 . 科学家最近发明了一种Al-PbO2电池,电解质为K2SO4、H2SO4、KOH,通过x和y两种离子交换膜将电解质溶液隔开,形成M、R、N三个电解质溶液区域(a>b),结构示意图如图所示。下列说法不正确的是


| A.M区域电解质为KOH |
| B.放电时,Al电极反应为:Al-3e-+4OH-=[Al(OH)4]- |
| C.R区域的电解质浓度逐渐减小 |
| D.每消耗0.1molPbO2电路中转移0.2mol电子 |
您最近一年使用:0次
2021-09-05更新
|
294次组卷
|
5卷引用:湖北省阳新高中2021-2022学年高二上学期9月月考化学试题



