1 . 离子液体是指在室温或接近室温下呈现液态的、完全由阴阳离子所组成的盐,也称为低温熔融盐。一种以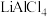 离子液体为电解质溶液的铝—磷酸铁锂二次电池放电时的工作原理如图所示。下列说法正确的是
离子液体为电解质溶液的铝—磷酸铁锂二次电池放电时的工作原理如图所示。下列说法正确的是
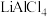 离子液体为电解质溶液的铝—磷酸铁锂二次电池放电时的工作原理如图所示。下列说法正确的是
离子液体为电解质溶液的铝—磷酸铁锂二次电池放电时的工作原理如图所示。下列说法正确的是
A.充电时,阳极的电极反应式为 |
| B.放电时,磷酸铁锂电极中锂元素被氧化 |
C.放电时,铝为负极,其电极反应式为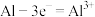 |
| D.充电时,电子由Al电极经离子液体流向磷酸铁锂电极 |
您最近半年使用:0次
名校
解题方法
2 . 碱性银锌二次航空电池为价格昂贵的高能电池。该电池的总反应为: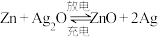 ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下:
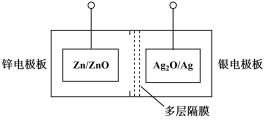
(1)该电池放电时,银电极板为电池的___________ (填“正极”或“负极”)。
(2)以KOH溶液为电解液,放电时锌电极板区域中发生的电极反应可分为两步:
反应ⅰ.锌电极板的溶解:∙∙∙∙∙∙
反应ⅱ.锌电极板上ZnO的析出:
补充反应ⅰ:___________ 。
(3)放电时,析出的ZnO会覆盖在锌电极板表面,影响电池使用效果。用浓KOH溶液可以抑制ZnO的生成,并促进锌电极板的溶解,请结合化学用语,从速率和平衡的角度说明原因:_______ 。
(4)将锌电极板制成蜂窝孔状,如图a所示,能增大锌电极板的表面积,但蜂窝孔的孔径过小,影响 进出蜂窝孔的速率,导致孔径内外
进出蜂窝孔的速率,导致孔径内外 浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
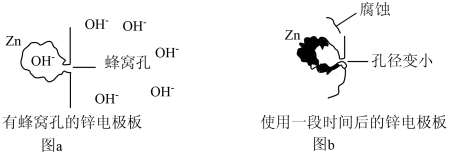
下列说法正确的是___________ (填字母序号)。
a.充电时, 向锌极板方向迁移
向锌极板方向迁移
b.孔内沉积ZnO,导电能力减弱,影响电池使用效果
c.导致该腐蚀变形的主要原因是孔外 浓度高于孔内
浓度高于孔内 浓度
浓度
d.为延长电池使用寿命,提高电池放电效果,应选用孔径恰当的锌极板
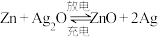 ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下:
(1)该电池放电时,银电极板为电池的
(2)以KOH溶液为电解液,放电时锌电极板区域中发生的电极反应可分为两步:
反应ⅰ.锌电极板的溶解:∙∙∙∙∙∙
反应ⅱ.锌电极板上ZnO的析出:

补充反应ⅰ:
(3)放电时,析出的ZnO会覆盖在锌电极板表面,影响电池使用效果。用浓KOH溶液可以抑制ZnO的生成,并促进锌电极板的溶解,请结合化学用语,从速率和平衡的角度说明原因:
(4)将锌电极板制成蜂窝孔状,如图a所示,能增大锌电极板的表面积,但蜂窝孔的孔径过小,影响
 进出蜂窝孔的速率,导致孔径内外
进出蜂窝孔的速率,导致孔径内外 浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
下列说法正确的是
a.充电时,
 向锌极板方向迁移
向锌极板方向迁移b.孔内沉积ZnO,导电能力减弱,影响电池使用效果
c.导致该腐蚀变形的主要原因是孔外
 浓度高于孔内
浓度高于孔内 浓度
浓度d.为延长电池使用寿命,提高电池放电效果,应选用孔径恰当的锌极板
您最近半年使用:0次
名校
解题方法
3 . Ⅰ.铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。

资料:
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4
iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。
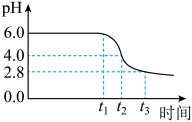
(1)①产生白色沉淀的离子方程式是___________ 。
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)___________ 0.1mol·L−1(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:___________ 。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:___________ 。
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:___________ 。
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,___________ 。
③补充实验证实了②中的分析。
a是___________ ,b是___________ 。
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是___________ ,从原子结构角度说明理由___________ 。
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是___________ 。
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:___________ 。
(6)总结:物质氧化性和还原性变化的一般规律是___________ 。

资料:
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O
 TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。

(1)①产生白色沉淀的离子方程式是
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,
③补充实验证实了②中的分析。
| 实验操作 | 试剂 | 产物 | |
| I | 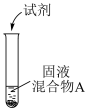 | 较浓H2SO4 | 有氯气 |
| Ⅱ | a | 有氯气 | |
| Ⅲ | a+b | 无氯气 |
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:
(6)总结:物质氧化性和还原性变化的一般规律是
您最近半年使用:0次
4 . 下图是飞船和空间站中利用Sabatier反应再生氧气的大体流程。
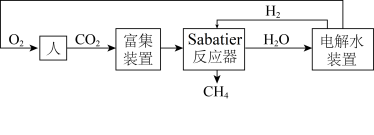
(1)已知:2H2(g)+O2(g) 2H2O(g) ∆H=﹣483.6kJ·mol-1
2H2O(g) ∆H=﹣483.6kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
则Sabatier反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的∆H=
CH4(g)+2H2O(g)的∆H=___________ 。
(2)二氧化碳的富集装置如图所示。
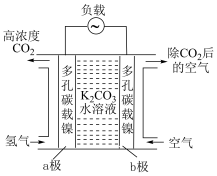
①该富集法采用___________ 原理(填“原电池”或“电解池”)。当a极上消耗1molH2,并保持电解液溶质不变时,b极上除去的CO2在标准状况下的体积为___________ 。
②工作一段时间后,K2CO3溶液的pH___________ (填“变大”“变小”或“不变”)。
(3)一定条件下,进行上述Sabatier反应:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是___________ 。
a.混合气体的密度不再改变 b.混合气体的总质量不再改变
c.混合气体平均摩尔质量不再改变 d.v正(CO2)=2v逆(H2O)
②在Sabatier反应器的前端维持较高温度800K,其目的是___________ 。
③在温度为T、压强为P0的条件下,按n(CO2)∶n(H2)=1∶4投料进行反应,平衡时CO2的转化率为50%,Kp=___________ (用P0表示)。已知Kp是以分压表示的平衡常数,分压=总压×物质的量分数。
(4)在298K时,几种离子的摩尔电导率如下表。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择最适宜的电解质为___________ (填化学式)。

(1)已知:2H2(g)+O2(g)
 2H2O(g) ∆H=﹣483.6kJ·mol-1
2H2O(g) ∆H=﹣483.6kJ·mol-1CH4(g)+2O2(g)
 CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1则Sabatier反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的∆H=
CH4(g)+2H2O(g)的∆H=(2)二氧化碳的富集装置如图所示。

①该富集法采用
②工作一段时间后,K2CO3溶液的pH
(3)一定条件下,进行上述Sabatier反应:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是
a.混合气体的密度不再改变 b.混合气体的总质量不再改变
c.混合气体平均摩尔质量不再改变 d.v正(CO2)=2v逆(H2O)
②在Sabatier反应器的前端维持较高温度800K,其目的是
③在温度为T、压强为P0的条件下,按n(CO2)∶n(H2)=1∶4投料进行反应,平衡时CO2的转化率为50%,Kp=
(4)在298K时,几种离子的摩尔电导率如下表。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择最适宜的电解质为
| 离子种类 | H+ | OH- |  SO SO | Cl- |  CO CO | K+ | Na+ |
| 摩尔电导率×104(S·m2·mol-1) | 349.82 | 198.0 | 79.8 | 76.34 | 72.0 | 73.52 | 50.11 |
您最近半年使用:0次
名校
解题方法
5 . 生物制剂企业等制造业的尾气H2S有多种回收利用方法。其中一种原电池回收法的原理如图所示,产物之一为固体 硫。
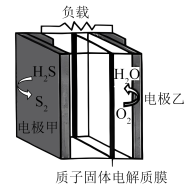
(1)当“负载”为电热丝时,每当处理1molH2S废气,电路中通过电子_______ mol,装置整体放热akJ。请写出上述反应的热化学方程式________ 。
(2)下列说法与事实不符的是________ 。
(3)甲电极生成的S2会填充电极的孔隙,降低电极对气体的吸附作用。下列试剂可用于洗脱S2的是________ 。
另一种处理H2S的工艺是利用反应:CH4(g)+2H2S(g) CS2(g)+4H2(g)。向1L恒容密闭容器中充入0.1molCH4和0.2molH2S,平衡后各物质的量分数与温度关系如图所示:
CS2(g)+4H2(g)。向1L恒容密闭容器中充入0.1molCH4和0.2molH2S,平衡后各物质的量分数与温度关系如图所示:

(4)曲线a表示的物质是_________ 。升高温度,K值________ (选填“增大”、“减小”或“不变”),判断理由是________ 。
(5)下列物理量不能用于判断反应是否达到平衡的是________ 。
(6)800℃(曲线a、c交点)达到平衡时,H2S转化率为_________ 。
(7)该反应经历两步基元反应,则该反应涉及的过渡态有________ 组,中间体有________ 组。

(1)当“负载”为电热丝时,每当处理1molH2S废气,电路中通过电子
(2)下列说法与事实不符的是
| A.电极乙是正极 |
| B.电极甲发生反应:2H2S-4e-=4H++S2 |
| C.体系中H+从电极乙经电解质膜迁移至电极甲 |
| D.该装置可将废气的化学能转化为电能 |
| A.水 | B.四氯乙烯 | C.氢氧化钠溶液 | D.稀硫酸 |
另一种处理H2S的工艺是利用反应:CH4(g)+2H2S(g)
 CS2(g)+4H2(g)。向1L恒容密闭容器中充入0.1molCH4和0.2molH2S,平衡后各物质的量分数与温度关系如图所示:
CS2(g)+4H2(g)。向1L恒容密闭容器中充入0.1molCH4和0.2molH2S,平衡后各物质的量分数与温度关系如图所示:
(4)曲线a表示的物质是
(5)下列物理量不能用于判断反应是否达到平衡的是
| A.混合气密度不变 |
| B.混合气平均摩尔质量不变 |
| C.n(CH4):n(H2S)不变 |
| D.断裂2molH-S键的同时,断裂2molH-H键 |
(7)该反应经历两步基元反应,则该反应涉及的过渡态有
您最近半年使用:0次
名校
解题方法
6 . 某实验小组进行Na2SO3的有关探究活动。
Ⅰ.久置样品纯度的测定
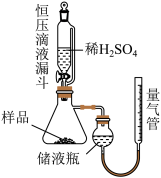
②调节储液瓶与量气管的相对高度,让两边液面在同一水平线上,读数体积为V1mL;
③打开恒压滴液漏斗下端的活塞,加入过量的稀硫酸,比其充分反应:
④调节储液瓶与量气锌的相对高度,让两边液面在同一水平线上,读数体积为V2mL。
(1)进行实验前需进行的操作是_______ ;
(2)使用恒压滴液漏斗添加稀硫酸的优点_______ ;
(3)储液瓶中盛装的液体试剂是_______ ,读数前要调节液面高度是为了消除_______ 对气体体积影响;
(4)若该实验条件为标准状况,则 纯度为
纯度为_______ (用含V1、V2、m的式子表达,已知读数V1>V2)。
Ⅱ.探究CuCl2溶液与 溶液反应
溶液反应
将1 mL0.2 mol/L 溶液与2mL0.2mol/LCuCl2溶液混合,立即生成橙黄色沉淀,3 min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1min沉淀全部变为白色(CuCl)。
溶液与2mL0.2mol/LCuCl2溶液混合,立即生成橙黄色沉淀,3 min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1min沉淀全部变为白色(CuCl)。
查阅资料:i橙黄色沉淀为2CuSO4·Cu2SO3·H2O,转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性;
ii原电池装置中物质氧化性与还原性强弱差异越大,电压越大。
(5)反应物生成白色沉淀的离子方程式为_______ ,橙黄色沉淀与Cl-全部转化为CuCl的离子方程式_______ ;
(6)设计如下图实验装置,验证Cl-能提高Cu2+的氧化性
则X为_______ ,
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
Ⅰ.久置样品纯度的测定
②调节储液瓶与量气管的相对高度,让两边液面在同一水平线上,读数体积为V1mL;
③打开恒压滴液漏斗下端的活塞,加入过量的稀硫酸,比其充分反应:
④调节储液瓶与量气锌的相对高度,让两边液面在同一水平线上,读数体积为V2mL。
(1)进行实验前需进行的操作是
(2)使用恒压滴液漏斗添加稀硫酸的优点
(3)储液瓶中盛装的液体试剂是
(4)若该实验条件为标准状况,则
 纯度为
纯度为Ⅱ.探究CuCl2溶液与
 溶液反应
溶液反应将1 mL0.2 mol/L
 溶液与2mL0.2mol/LCuCl2溶液混合,立即生成橙黄色沉淀,3 min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1min沉淀全部变为白色(CuCl)。
溶液与2mL0.2mol/LCuCl2溶液混合,立即生成橙黄色沉淀,3 min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1min沉淀全部变为白色(CuCl)。查阅资料:i橙黄色沉淀为2CuSO4·Cu2SO3·H2O,转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性;
ii原电池装置中物质氧化性与还原性强弱差异越大,电压越大。
(5)反应物生成白色沉淀的离子方程式为
(6)设计如下图实验装置,验证Cl-能提高Cu2+的氧化性
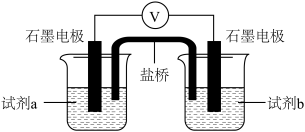
| 试剂a | 试剂b | 电压表读数 |
0.2mol/L 溶液 溶液 | 0.2mol/L 溶液 溶液 | E1 |
0.2mol/L 溶液 溶液 | X | E2 |

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近半年使用:0次
解题方法
7 . 小组同学探究+3价铬元素和+6价铬元素的相互转化。
资料: (绿色)、
(绿色)、 (灰绿色,不溶于水)、
(灰绿色,不溶于水)、 (橙色)、
(橙色)、 (黄色)、
(黄色)、 (砖红色,难溶于水)
(砖红色,难溶于水)
实验Ⅰ:向2mL0.1mol/L 溶液中滴入2mL3%
溶液中滴入2mL3% 溶液,无明显变化,得到溶液a.取少量溶液a,加入
溶液,无明显变化,得到溶液a.取少量溶液a,加入 溶液,未观察到砖红色沉淀。
溶液,未观察到砖红色沉淀。
实验Ⅱ:向溶液a中加入2mL10%NaOH溶液,产生少量气泡,水浴加热,有大量气泡产生,经检验气体为 ,溶液最终变为黄色。取少量黄色溶液,加入稀硫酸调节溶液的pH约为3,再加入
,溶液最终变为黄色。取少量黄色溶液,加入稀硫酸调节溶液的pH约为3,再加入 溶液,有砖红色沉淀生成。
溶液,有砖红色沉淀生成。
(1)实验Ⅱ中加入稀硫酸的目的是___________ 。
(2)甲同学认为实验Ⅱ中溶液变黄生成 的原因是
的原因是 将+3价铬元素氧化为
将+3价铬元素氧化为 ,乙同学认为该说法不严谨。
,乙同学认为该说法不严谨。
①乙的理由是___________ 。
②设计实验否定了乙的猜想,___________ (填操作),溶液未变成黄色。
(3)对比实验I和Ⅱ,小组同学研究碱性环境对+3价铬元素或 性质的影响。
性质的影响。
①提出假设:
假设a:碱性增强, 的氧化性增强
的氧化性增强
假设b:___________ 。
② 参与的电极反应式是
参与的电极反应式是___________ ,据此分析,假设a不成立。
③设计实验证实假设b,画出实验装置图(注明试剂)并写出实验操作和现象___________ 。
实验Ⅲ:向实验Ⅱ中的黄色溶液中加入稀硫酸,溶液变为橙色,再加入3% 溶液,溶液最终变为绿色,有气泡生成。
溶液,溶液最终变为绿色,有气泡生成。
(4)实验Ⅲ中溶液由橙色变为绿色的离子方程式是___________ 。
(5)综上, 在+3价铬元素和+6价铬元素相互转化中的作用是
在+3价铬元素和+6价铬元素相互转化中的作用是___________ 。
资料:
 (绿色)、
(绿色)、 (灰绿色,不溶于水)、
(灰绿色,不溶于水)、 (橙色)、
(橙色)、 (黄色)、
(黄色)、 (砖红色,难溶于水)
(砖红色,难溶于水)实验Ⅰ:向2mL0.1mol/L
 溶液中滴入2mL3%
溶液中滴入2mL3% 溶液,无明显变化,得到溶液a.取少量溶液a,加入
溶液,无明显变化,得到溶液a.取少量溶液a,加入 溶液,未观察到砖红色沉淀。
溶液,未观察到砖红色沉淀。实验Ⅱ:向溶液a中加入2mL10%NaOH溶液,产生少量气泡,水浴加热,有大量气泡产生,经检验气体为
 ,溶液最终变为黄色。取少量黄色溶液,加入稀硫酸调节溶液的pH约为3,再加入
,溶液最终变为黄色。取少量黄色溶液,加入稀硫酸调节溶液的pH约为3,再加入 溶液,有砖红色沉淀生成。
溶液,有砖红色沉淀生成。(1)实验Ⅱ中加入稀硫酸的目的是
(2)甲同学认为实验Ⅱ中溶液变黄生成
 的原因是
的原因是 将+3价铬元素氧化为
将+3价铬元素氧化为 ,乙同学认为该说法不严谨。
,乙同学认为该说法不严谨。①乙的理由是
②设计实验否定了乙的猜想,
(3)对比实验I和Ⅱ,小组同学研究碱性环境对+3价铬元素或
 性质的影响。
性质的影响。①提出假设:
假设a:碱性增强,
 的氧化性增强
的氧化性增强假设b:
②
 参与的电极反应式是
参与的电极反应式是③设计实验证实假设b,画出实验装置图(注明试剂)并写出实验操作和现象
实验Ⅲ:向实验Ⅱ中的黄色溶液中加入稀硫酸,溶液变为橙色,再加入3%
 溶液,溶液最终变为绿色,有气泡生成。
溶液,溶液最终变为绿色,有气泡生成。(4)实验Ⅲ中溶液由橙色变为绿色的离子方程式是
(5)综上,
 在+3价铬元素和+6价铬元素相互转化中的作用是
在+3价铬元素和+6价铬元素相互转化中的作用是
您最近半年使用:0次
解题方法
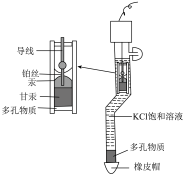
8 . 甘汞电极是用来测定单个电极电势的标准电极,甘汞电极由汞和甘汞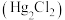 在KCl饱和溶液中接触而成,其装置原理如图。将甘汞电极、Zn片连接后同时插入
在KCl饱和溶液中接触而成,其装置原理如图。将甘汞电极、Zn片连接后同时插入 ,溶液中构成原电池。下列说法错误的是
,溶液中构成原电池。下列说法错误的是
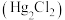 在KCl饱和溶液中接触而成,其装置原理如图。将甘汞电极、Zn片连接后同时插入
在KCl饱和溶液中接触而成,其装置原理如图。将甘汞电极、Zn片连接后同时插入 ,溶液中构成原电池。下列说法错误的是
,溶液中构成原电池。下列说法错误的是
| A.电子从Zn极流出,进入Hg极 |
| B.KCl饱和溶液充当盐桥的作用 |
C.通过测定该电池的电动势可得出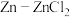 的电动势 的电动势 |
D.正极反应式: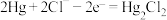 |
您最近半年使用:0次
9 . 科学家近日发明了一种无污染、无需净化高效产氢的可充电电池,电池示意图如下。电极为金属锌和选择性催化材料,实现了阴极析氢和 氧化两个独立的反应,可稳定循环600次。下列说法错误的是
氧化两个独立的反应,可稳定循环600次。下列说法错误的是
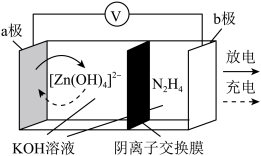
 氧化两个独立的反应,可稳定循环600次。下列说法错误的是
氧化两个独立的反应,可稳定循环600次。下列说法错误的是
A.充电时,阴极区溶液 减小 减小 |
B.放电时, 由b极区向a极区迁移 由b极区向a极区迁移 |
| C.充电时,b极反应式为N2H4-4e-+4OH-=N2+4H2O |
D.产生 ,a极质量增大 ,a极质量增大 |
您最近半年使用:0次
名校
解题方法
10 . 中国科学技术大学科研人员开发了一种高性能的水系锰基锌电池。该装置获得电能的同时可以制得 ,其工作原理如图所示,下列说法正确的是
,其工作原理如图所示,下列说法正确的是

 ,其工作原理如图所示,下列说法正确的是
,其工作原理如图所示,下列说法正确的是
| A.电池放电时,正极区溶液的pH降低 |
| B.a膜为阳离子交换膜,b膜为阴离子交换膜 |
C.X溶液中的溶质只能为 ,Y溶液中溶质只能为KOH ,Y溶液中溶质只能为KOH |
| D.放电时,消耗1mol Zn时,正极区电解质溶液增重87g |
您最近半年使用:0次
2022-12-27更新
|
1024次组卷
|
5卷引用:山东省潍坊市2022年12月高三优生学习质量检测化学试题



