1 . γ-丁内酯为无色油状液体,高温时易分解,是重要的化工原料和医药中间体。工业利用1,4-丁二醇生产γ-丁内酯的主、副反应的化学方程式如下:
主反应: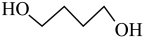 (g)
(g)
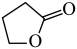 (g)( γ-丁内酯)+2H2(g) △H1=akJ•mol-1
(g)( γ-丁内酯)+2H2(g) △H1=akJ•mol-1
副反应: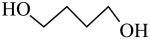 (g)
(g)
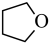
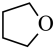 (g)(四氢呋喃)+H2O(g) △H2=bkJ•mol-1
(g)(四氢呋喃)+H2O(g) △H2=bkJ•mol-1
(1)反应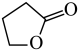 (g)+2H2(g)
(g)+2H2(g)
 (g)+H2O(g)的△H=
(g)+H2O(g)的△H=_______ kJ•mol-1。
(2)由1,4-丁二醇合成γ-丁内酯的一种机理如图所示(“★”表示此微粒吸附在催化剂表面)
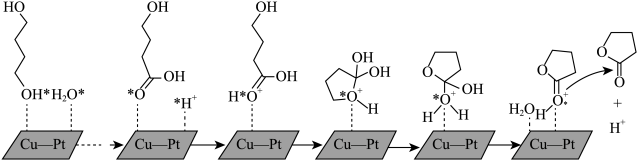
①步骤Ⅱ历程是质子化的过程,H+和氧原子间形成的作用力是______ 。
②H+在上述合成γ-丁内酯过程中的作用是_______ 。
③γ-丁内酯分子中σ键与π键数目之比为_______ 。
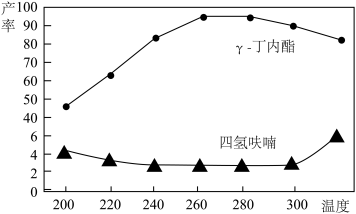
(3)将1,4-丁二醇与H2的混合气体以一定流速通过填充有催化剂的反应器,反应相同时间,测得γ-丁内酯和四氢呋喃的产率如图所示。
已知:1,4-丁二醇的沸点为228℃。
①当温度低于220℃,1,4-丁二醇的转化率较低,可能的原因是_______ 。
②当温度高于260℃,γ-丁内酯的产率下降,可能的原因是_______ 。
(4)铜基催化剂(Cu/Pt)能高效加快由1.4-丁二醇合成γ-丁内酯的合成速率,但因原料中的杂质或发生副反应生成的物质会使催化剂失活。
①1,4-丁二醇中混有少量的1,4-丁二硫醇(HSCH2CH2CH2CH2SH)。合成时加入ZnO可有效避免铜基催化剂失活,其原理用化学反应方程式表示为_______ 。
②将失活的铜基催化剂分为两份,第一份直接在氢气下进行还原,第二份先在空气中高温煅烧后再进行氢气还原,结果只有第二份催化剂活性恢复。说明催化剂失活的另外可能的原因是______ 。
(5)含有1,4-丁二醇的强酸性污水可用“铁碳微电池”法处理,过程中两电极分别产生的Fe2+和活性氢原子(H•)都具有较高的化学活性,在厌氧条件下将1,4-丁二醇转化为甲烷,假设两电极只生成Fe2+和H•,且全部参与该转化过程,写出该过程的离子方程式:_______ 。
主反应:
 (g)
(g)
 (g)( γ-丁内酯)+2H2(g) △H1=akJ•mol-1
(g)( γ-丁内酯)+2H2(g) △H1=akJ•mol-1副反应:
 (g)
(g)
 (g)(四氢呋喃)+H2O(g) △H2=bkJ•mol-1
(g)(四氢呋喃)+H2O(g) △H2=bkJ•mol-1(1)反应
 (g)+2H2(g)
(g)+2H2(g)
 (g)+H2O(g)的△H=
(g)+H2O(g)的△H=(2)由1,4-丁二醇合成γ-丁内酯的一种机理如图所示(“★”表示此微粒吸附在催化剂表面)

①步骤Ⅱ历程是质子化的过程,H+和氧原子间形成的作用力是
②H+在上述合成γ-丁内酯过程中的作用是
③γ-丁内酯分子中σ键与π键数目之比为
(3)将1,4-丁二醇与H2的混合气体以一定流速通过填充有催化剂的反应器,反应相同时间,测得γ-丁内酯和四氢呋喃的产率如图所示。
已知:1,4-丁二醇的沸点为228℃。
①当温度低于220℃,1,4-丁二醇的转化率较低,可能的原因是
②当温度高于260℃,γ-丁内酯的产率下降,可能的原因是

(4)铜基催化剂(Cu/Pt)能高效加快由1.4-丁二醇合成γ-丁内酯的合成速率,但因原料中的杂质或发生副反应生成的物质会使催化剂失活。
①1,4-丁二醇中混有少量的1,4-丁二硫醇(HSCH2CH2CH2CH2SH)。合成时加入ZnO可有效避免铜基催化剂失活,其原理用化学反应方程式表示为
②将失活的铜基催化剂分为两份,第一份直接在氢气下进行还原,第二份先在空气中高温煅烧后再进行氢气还原,结果只有第二份催化剂活性恢复。说明催化剂失活的另外可能的原因是
(5)含有1,4-丁二醇的强酸性污水可用“铁碳微电池”法处理,过程中两电极分别产生的Fe2+和活性氢原子(H•)都具有较高的化学活性,在厌氧条件下将1,4-丁二醇转化为甲烷,假设两电极只生成Fe2+和H•,且全部参与该转化过程,写出该过程的离子方程式:
您最近一年使用:0次
解题方法
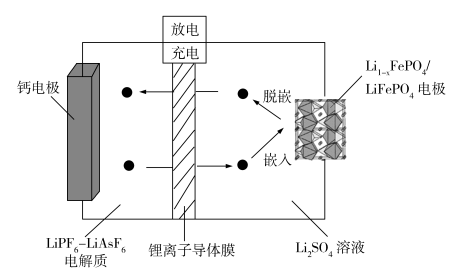
2 . 一款新型的Ca-LiFePO4可充电电池的工作示意图如图,锂离子导体膜只允许Li+通过。该电池总反应式为:xCa2++2LiFePO4 xCa+2Li1-xFePO4+2xLi+。下列说法
xCa+2Li1-xFePO4+2xLi+。下列说法不正确 的是
 xCa+2Li1-xFePO4+2xLi+。下列说法
xCa+2Li1-xFePO4+2xLi+。下列说法
| A.充电时,钙电极与直流电源的负极相连 |
| B.充电时,每转移0.2mol电子左室中电解质的质量减轻4.0g |
| C.Li1-xFePO4/LiFePO4电极充电时发生Li+脱嵌,放电时发生Li+嵌入 |
| D.放电时,正极反应为:Li1-xFePO4+xe-+xLi+=LiFePO4 |
您最近一年使用:0次
3 . 2023年1月31日常州氢湾在“两湖”创新区核心区正式启动,有百利科技等生产氢燃料电池零部件的8家高科技企业落户氢湾。某生物燃料电池以 和
和 为原料可在一定温度下制取
为原料可在一定温度下制取 ,电池中含有固氮酶和氢化酶两种蛋白酶,工作原理如图。下列说法正确的是
,电池中含有固氮酶和氢化酶两种蛋白酶,工作原理如图。下列说法正确的是

 和
和 为原料可在一定温度下制取
为原料可在一定温度下制取 ,电池中含有固氮酶和氢化酶两种蛋白酶,工作原理如图。下列说法正确的是
,电池中含有固氮酶和氢化酶两种蛋白酶,工作原理如图。下列说法正确的是
| A.a电极是燃料电池的正极 |
B.电极b的电极反应式为: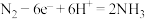 |
| C.该电池适宜在高温下使用 |
| D.电池工作时氢离子通过交换膜由a极区向b极区移动 |
您最近一年使用:0次
解题方法
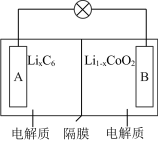
4 . 钴酸锂( )电池放电时的反应为
)电池放电时的反应为 ,其工作原理如图所示。下列说法正确的是
,其工作原理如图所示。下列说法正确的是
 )电池放电时的反应为
)电池放电时的反应为 ,其工作原理如图所示。下列说法正确的是
,其工作原理如图所示。下列说法正确的是
| A.放电时,电能主要转化为化学能 |
B.放电时, 由A极脱出,通过隔膜后嵌入B极 由A极脱出,通过隔膜后嵌入B极 |
C.充电时,B极的电极反应式为 |
D.充电时,理论上若转移 ,A极将增重 ,A极将增重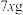 |
您最近一年使用:0次
解题方法
5 . 含氮、磷、砷化合物的转化和处理是环境保护的重要课题。
(1)研究团队采用NaClO氧化法去除水中氨氮( 、
、 )。已知:HClO的氧化性比NaClO强;
)。已知:HClO的氧化性比NaClO强; 比
比 更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为___________ 。
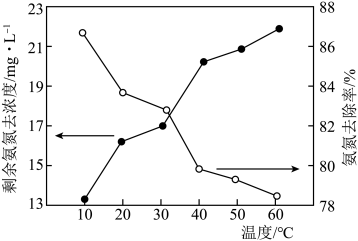
(2)十八面体结构的 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
①向银氨溶液中加入 溶液,离心分离、洗涤干燥后可得到
溶液,离心分离、洗涤干燥后可得到 高效光催化剂,写出反应的离子方程式为
高效光催化剂,写出反应的离子方程式为___________ 。
② 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因是
固体光催化性能极差。从速率角度解释其原因是___________ 。
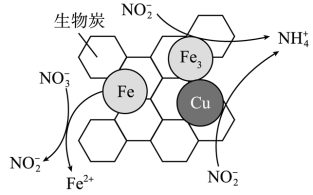
(3)将一定量纳米零价铁和少量铜粉附着在生物炭上,也可用于去除水体中 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 的效率更高,其主要原因是
的效率更高,其主要原因是___________ ; 转化为
转化为 的反应机理可描述为
的反应机理可描述为___________ 。
(1)研究团队采用NaClO氧化法去除水中氨氮(
 、
、 )。已知:HClO的氧化性比NaClO强;
)。已知:HClO的氧化性比NaClO强; 比
比 更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
(2)十八面体结构的
 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。①向银氨溶液中加入
 溶液,离心分离、洗涤干燥后可得到
溶液,离心分离、洗涤干燥后可得到 高效光催化剂,写出反应的离子方程式为
高效光催化剂,写出反应的离子方程式为②
 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因是
固体光催化性能极差。从速率角度解释其原因是(3)将一定量纳米零价铁和少量铜粉附着在生物炭上,也可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 的效率更高,其主要原因是
的效率更高,其主要原因是 转化为
转化为 的反应机理可描述为
的反应机理可描述为
您最近一年使用:0次
6 . 金属及其化合物在生产生活中应用广泛。2011年云南的“乌铜走银”制作技艺列入国家级非物质文化遗产名录。制作中的走银工序是将氧化变黑的银丝嵌入铜器表面已錾刻好的花纹内,再经揉黑工序,用手边焐边搓揉铜器,直到铜器表面变成乌黑、银丝变得光亮。近期中国科学院在含银化合物运用于超离子导体方面取得突破性进展,制得的αAgI晶体在室温下的电导率比普通多晶的AgI提高了近5个数量级。下列有关“乌铜走银”的说法不正确的是
| A.走银工序中金属键没有断裂 | B.揉黑工序中发生了原电池反应 |
| C.用铝丝代替银丝,铜器也会变黑 | D.银丝可以长时间保持光亮 |
您最近一年使用:0次
解题方法
7 . 氮及化合物的性质与应用是科学研究的热点。
(1) 分子呈正四面体结构,如图所示。已知断裂1molN—N键吸收190kJ能量,断裂
分子呈正四面体结构,如图所示。已知断裂1molN—N键吸收190kJ能量,断裂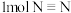 键吸收940kJ能量,则
键吸收940kJ能量,则 气体转化为
气体转化为 时要
时要_______ (填“吸收”或“放出”)能量_______ kJ。

(2)利用 和
和 生成
生成 的反应设计成原电池,装置如图所示。电极B是
的反应设计成原电池,装置如图所示。电极B是_______ 极(填“正”或“负”), 通过离子交换膜向
通过离子交换膜向_______ (填“A”或“B”)极移动,写出电极A的电极反应式:_______ 。

(3)水体中 的污染可用纳米铁粉消除,反应的离子方程式为
的污染可用纳米铁粉消除,反应的离子方程式为 。研究发现,若pH偏低将会导致
。研究发现,若pH偏低将会导致 的去除率下降,其原因是
的去除率下降,其原因是_______ 。相同条件下,纳米铁粉去除不同水样中 的速率有较大差异如图,产生该差异的可能原因是
的速率有较大差异如图,产生该差异的可能原因是_______ 。

I.含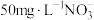 的水样
的水样
II.含 的水样
的水样
(1)
 分子呈正四面体结构,如图所示。已知断裂1molN—N键吸收190kJ能量,断裂
分子呈正四面体结构,如图所示。已知断裂1molN—N键吸收190kJ能量,断裂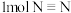 键吸收940kJ能量,则
键吸收940kJ能量,则 气体转化为
气体转化为 时要
时要
(2)利用
 和
和 生成
生成 的反应设计成原电池,装置如图所示。电极B是
的反应设计成原电池,装置如图所示。电极B是 通过离子交换膜向
通过离子交换膜向
(3)水体中
 的污染可用纳米铁粉消除,反应的离子方程式为
的污染可用纳米铁粉消除,反应的离子方程式为 。研究发现,若pH偏低将会导致
。研究发现,若pH偏低将会导致 的去除率下降,其原因是
的去除率下降,其原因是 的速率有较大差异如图,产生该差异的可能原因是
的速率有较大差异如图,产生该差异的可能原因是
I.含
 的水样
的水样II.含
 的水样
的水样
您最近一年使用:0次
名校
解题方法
8 . 水体中的六价铬[Cr(Ⅵ)]对生态环境和人体健康威胁很大。工业废水中[Cr(Ⅵ)]常用还原沉淀法、微生物法等进行处理。
(1)“还原沉淀法”常用Na2SO3、FeSO4等处理Cr(Ⅵ)得到Cr(Ⅲ)。已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、Cr2O 和CrO
和CrO )的物质的量分数随pH的关系如图所示。
)的物质的量分数随pH的关系如图所示。
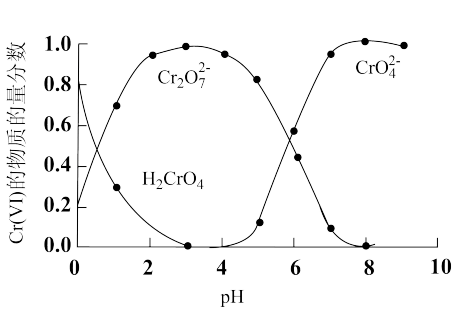
①某含Cr(Ⅵ)废水的pH约为8,写出用Na2SO3处理该废水的主要离子方程式:_______ 。[已知pH=3时,Cr(Ⅲ)以Cr3+形式存在,pH=7.5时,Cr(Ⅲ)开始沉淀]。
②其他条件相同,用Na2SO3处理不同pH含Cr(Ⅵ)的废水,反应相同时间,Cr(Ⅵ)的去除率与pH的关系如图所示。已知酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低的原因是_______ 。
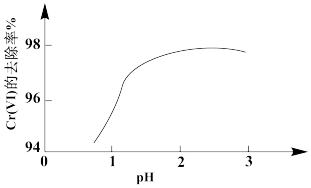
③研究发现,用FeSO4处理pH=3的含Cr(Ⅵ)废水,Cr(Ⅵ)的去除率大于其被FeSO4还原的理论值。Cr(Ⅵ)的去除率大于理论值的原因是_______ 。
(2)“微生物法”处理含Cr(Ⅵ)废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水。
①硫酸盐还原菌能将水中的SO 转化为S2-,S2-与CrO
转化为S2-,S2-与CrO 可反应生成Cr2S3和S两种沉淀。写出S2-与CrO
可反应生成Cr2S3和S两种沉淀。写出S2-与CrO 反应的离子方程式:
反应的离子方程式:_______ 。
②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(Ⅵ)的去除率低的原因是_______ 。
③硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的S2-会完全转化为FeS,则Fe腐蚀后生成Fe(OH)2和FeS的物质的量之比为_______ 。

(1)“还原沉淀法”常用Na2SO3、FeSO4等处理Cr(Ⅵ)得到Cr(Ⅲ)。已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、Cr2O
 和CrO
和CrO )的物质的量分数随pH的关系如图所示。
)的物质的量分数随pH的关系如图所示。
①某含Cr(Ⅵ)废水的pH约为8,写出用Na2SO3处理该废水的主要离子方程式:
②其他条件相同,用Na2SO3处理不同pH含Cr(Ⅵ)的废水,反应相同时间,Cr(Ⅵ)的去除率与pH的关系如图所示。已知酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低的原因是

③研究发现,用FeSO4处理pH=3的含Cr(Ⅵ)废水,Cr(Ⅵ)的去除率大于其被FeSO4还原的理论值。Cr(Ⅵ)的去除率大于理论值的原因是
(2)“微生物法”处理含Cr(Ⅵ)废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水。
①硫酸盐还原菌能将水中的SO
 转化为S2-,S2-与CrO
转化为S2-,S2-与CrO 可反应生成Cr2S3和S两种沉淀。写出S2-与CrO
可反应生成Cr2S3和S两种沉淀。写出S2-与CrO 反应的离子方程式:
反应的离子方程式:②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(Ⅵ)的去除率低的原因是
③硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的S2-会完全转化为FeS,则Fe腐蚀后生成Fe(OH)2和FeS的物质的量之比为

您最近一年使用:0次
2022-04-19更新
|
372次组卷
|
5卷引用:江苏省镇江市五校2021-2022学年高二下学期期末考试化学试题
名校
解题方法
9 . 有机物电极材料具有来源丰富、可降解等优点,一种负极材料为固态聚酰亚胺-水系二次电池的结构如图所示。下列说法正确的是
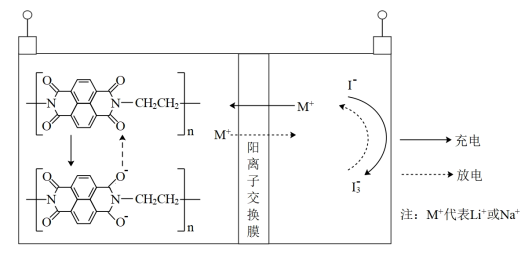

| A.充电时有机电极发生了氧化反应 |
B.充电时每转移 ,右室离子数目减少 ,右室离子数目减少 |
C.放电时负极电极反应为: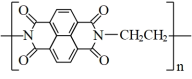 -2e-= -2e-=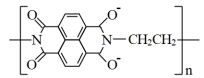 |
D.将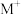 由 由 换成 换成 ,电池的比能量会下降 ,电池的比能量会下降 |
您最近一年使用:0次
2022-04-14更新
|
2566次组卷
|
18卷引用:江苏省常州市第一中学2022-2023学年高二上学期期末考试化学试题
江苏省常州市第一中学2022-2023学年高二上学期期末考试化学试题(已下线)押江苏卷第12题 电化学及其应用 -备战2022年高考化学临考题号押题(江苏卷)湖南省湘东九校2021-2022学年高二下学期期末联考化学试题辽宁省葫芦岛市第一高级中学2022-2023学年高三上学期期末线上教学阶段检测化学试题广东省佛山市普通高中2022届高三教学质量检测(二)化学试题广东省佛山市2022届高三下学期4月第二次教学质量监测(二模)化学试题(已下线)必刷卷04-2022年高考化学考前信息必刷卷(全国乙卷)福建省龙岩第一中学2022届高三毕业班模拟训练(二)化学试题(已下线)【直抵名校】04-备战2022年高考化学名校进阶模拟卷(通用版)湖南省常德市澧县一中2021-2022学年高三下学期期中考试化学试题湖南省岳阳县第一中学2022届高三下学期5月月考化学试题湖南省常德市澧县第一中学2021-2022学年高三下学期期中考试化学试题(已下线)化学(辽宁A卷)-学易金卷:2023年高考第一次模拟考试卷湖南省株洲市九方中学2022-2023学年高三上学期第四次月考化学试题湖南省株洲市第二中学2023届高三第七次月考化学试题(已下线)T10-电化学原理福建省厦门第一中学2022-2023学年高三上学期11月期中考试化学试题山东省滕州市2023-2024学年高三上学期期中考试化学试题
名校
10 . 科学家近年发明了一种新型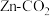 水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体
水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体 被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法不正确的是
被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法不正确的是
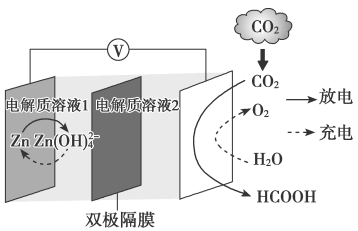
 水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体
水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体 被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法不正确的是
被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列说法不正确的是
A.放电时,负极反应为 |
| B.电解质溶液1为碱性,电解质溶液2为酸性 |
C.充电时,阳极溶液中 浓度升高 浓度升高 |
D.充电时,电池总反应为: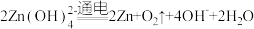 |
您最近一年使用:0次
2022-03-11更新
|
952次组卷
|
5卷引用:江苏省盐城市2021-2022学年高二下学期期末联考模拟考试化学试题
江苏省盐城市2021-2022学年高二下学期期末联考模拟考试化学试题江苏省苏州市张家港市2021-2022学年高三下学期开学考试化学试题(已下线)押江苏卷第12题 电化学及其应用 -备战2022年高考化学临考题号押题(江苏卷)四川省绵阳南山中学2021-2022学年高二下学期3月月考理综化学试题广东省广州市第十六中学2021-2022学年高二下学期期中测试化学试题



