名校
解题方法
1 . 某实验小组进行Na2SO3的有关探究活动。
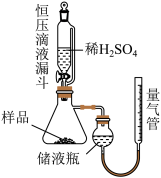
Ⅰ.久置样品纯度的测定
②调节储液瓶与量气管的相对高度,让两边液面在同一水平线上,读数体积为V1mL;
③打开恒压滴液漏斗下端的活塞,加入过量的稀硫酸,比其充分反应:
④调节储液瓶与量气锌的相对高度,让两边液面在同一水平线上,读数体积为V2mL。
(1)进行实验前需进行的操作是_______ ;
(2)使用恒压滴液漏斗添加稀硫酸的优点_______ ;
(3)储液瓶中盛装的液体试剂是_______ ,读数前要调节液面高度是为了消除_______ 对气体体积影响;
(4)若该实验条件为标准状况,则 纯度为
纯度为_______ (用含V1、V2、m的式子表达,已知读数V1>V2)。
Ⅱ.探究CuCl2溶液与 溶液反应
溶液反应
将1 mL0.2 mol/L 溶液与2mL0.2mol/LCuCl2溶液混合,立即生成橙黄色沉淀,3 min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1min沉淀全部变为白色(CuCl)。
溶液与2mL0.2mol/LCuCl2溶液混合,立即生成橙黄色沉淀,3 min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1min沉淀全部变为白色(CuCl)。
查阅资料:i橙黄色沉淀为2CuSO4·Cu2SO3·H2O,转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性;
ii原电池装置中物质氧化性与还原性强弱差异越大,电压越大。
(5)反应物生成白色沉淀的离子方程式为_______ ,橙黄色沉淀与Cl-全部转化为CuCl的离子方程式_______ ;
(6)设计如下图实验装置,验证Cl-能提高Cu2+的氧化性
则X为_______ ,
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
Ⅰ.久置样品纯度的测定
②调节储液瓶与量气管的相对高度,让两边液面在同一水平线上,读数体积为V1mL;
③打开恒压滴液漏斗下端的活塞,加入过量的稀硫酸,比其充分反应:
④调节储液瓶与量气锌的相对高度,让两边液面在同一水平线上,读数体积为V2mL。
(1)进行实验前需进行的操作是
(2)使用恒压滴液漏斗添加稀硫酸的优点
(3)储液瓶中盛装的液体试剂是
(4)若该实验条件为标准状况,则
 纯度为
纯度为Ⅱ.探究CuCl2溶液与
 溶液反应
溶液反应将1 mL0.2 mol/L
 溶液与2mL0.2mol/LCuCl2溶液混合,立即生成橙黄色沉淀,3 min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1min沉淀全部变为白色(CuCl)。
溶液与2mL0.2mol/LCuCl2溶液混合,立即生成橙黄色沉淀,3 min后沉淀颜色变浅并伴有少量白色沉淀产生,振荡1min沉淀全部变为白色(CuCl)。查阅资料:i橙黄色沉淀为2CuSO4·Cu2SO3·H2O,转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性;
ii原电池装置中物质氧化性与还原性强弱差异越大,电压越大。
(5)反应物生成白色沉淀的离子方程式为
(6)设计如下图实验装置,验证Cl-能提高Cu2+的氧化性
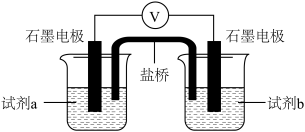
| 试剂a | 试剂b | 电压表读数 |
0.2mol/L 溶液 溶液 | 0.2mol/L 溶液 溶液 | E1 |
0.2mol/L 溶液 溶液 | X | E2 |

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
名校
2 . 实验室用浓硫酸、铜与NaOH溶液为原料制取少量 并探究其性质。
并探究其性质。
I.制备 (装置如图所示)。
(装置如图所示)。
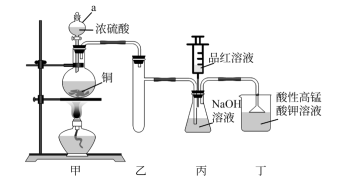
(1)仪器a的名称是___________ 。
(2)装置丁的作用有①吸收尾气,防止环境污染;②___________ ;③___________ 。
(3)证明丙中NaOH已完全转化为 的操作和现象是
的操作和现象是___________ 。
II.探究 与
与 的反应,设计实验如下:向2mL1mol/L
的反应,设计实验如下:向2mL1mol/L 溶液中加入2mL1mol/L
溶液中加入2mL1mol/L 溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份,进行实验Ⅰ和Ⅱ。
溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份,进行实验Ⅰ和Ⅱ。
(4)推测实验Ⅱ产生的无色气体为 ,实验证实推测正确:用滴有碘水的淀粉试纸接近试管口,观察到
,实验证实推测正确:用滴有碘水的淀粉试纸接近试管口,观察到___________ ,反应的离子方程式为___________ 。
(5)对实验Ⅱ产生 的原因进行分析,提出两种假设:
的原因进行分析,提出两种假设:
假设1: 水解使溶液中
水解使溶液中 增大。
增大。
假设2: 存在时,
存在时, 与
与 反应生成CuCl白色沉淀,溶液中
反应生成CuCl白色沉淀,溶液中 增大。
增大。
①假设1不合理,实验证据是___________ 。
②实验证实假设2合理,实验Ⅱ中发生反应的离子方程式有______ ,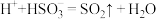 。
。
(6)通过上述分析可知, 增强了
增强了 的氧化性。某同学设计原电池实验证明该实验结果。
的氧化性。某同学设计原电池实验证明该实验结果。
①补全乙实验的现象___________ 。
②已知E为电池电动势[电池电动势即电池的理论电压,是两个电极电位之差,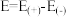 ],
], 为电池反应的自由能变,则甲电池与乙电池相比较,
为电池反应的自由能变,则甲电池与乙电池相比较,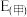
___________ 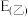 ,
,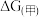
___________ 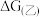 (填“>”或“<”)。
(填“>”或“<”)。
 并探究其性质。
并探究其性质。I.制备
 (装置如图所示)。
(装置如图所示)。
(1)仪器a的名称是
(2)装置丁的作用有①吸收尾气,防止环境污染;②
(3)证明丙中NaOH已完全转化为
 的操作和现象是
的操作和现象是II.探究
 与
与 的反应,设计实验如下:向2mL1mol/L
的反应,设计实验如下:向2mL1mol/L 溶液中加入2mL1mol/L
溶液中加入2mL1mol/L 溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份,进行实验Ⅰ和Ⅱ。
溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份,进行实验Ⅰ和Ⅱ。| 实验 | 操作及现象 |
| Ⅰ | 加入适量 固体,瞬间无明显变化,30s时也无明显变化。 固体,瞬间无明显变化,30s时也无明显变化。 |
| Ⅱ | 加入适量NaCl固体,瞬间无明显变化,30s时有无色气体和白色沉淀,上层溶液颜色变浅。 |
 ,实验证实推测正确:用滴有碘水的淀粉试纸接近试管口,观察到
,实验证实推测正确:用滴有碘水的淀粉试纸接近试管口,观察到(5)对实验Ⅱ产生
 的原因进行分析,提出两种假设:
的原因进行分析,提出两种假设:假设1:
 水解使溶液中
水解使溶液中 增大。
增大。假设2:
 存在时,
存在时, 与
与 反应生成CuCl白色沉淀,溶液中
反应生成CuCl白色沉淀,溶液中 增大。
增大。①假设1不合理,实验证据是
②实验证实假设2合理,实验Ⅱ中发生反应的离子方程式有
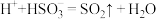 。
。(6)通过上述分析可知,
 增强了
增强了 的氧化性。某同学设计原电池实验证明该实验结果。
的氧化性。某同学设计原电池实验证明该实验结果。①补全乙实验的现象
| 编号 | 甲 | 乙 |
| 实验 | 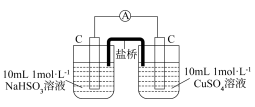 | 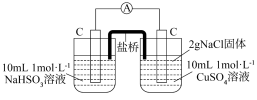 |
| 现象 | 电流计指针发生微小偏转 |
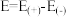 ],
], 为电池反应的自由能变,则甲电池与乙电池相比较,
为电池反应的自由能变,则甲电池与乙电池相比较,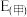
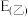 ,
,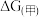
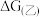 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
名校
3 . 锂—空气电池的理论能量密度高,是未来提高电动汽车续航里程的关键。
(1)锂在元素周期表中的位置是___________ ,属于比较活泼的金属。
(2)锂—空气电池的反应原理可表示为: 。其放电时的工作原理如下图所示:
。其放电时的工作原理如下图所示:
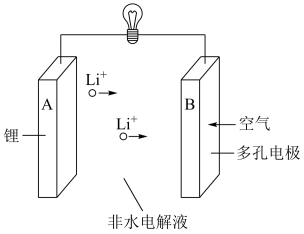
电池工作时,发生氧化反应的是___________ (填“ ”或“
”或“ ”)极。
”)极。
(3)空气中的 、
、 影响电池放电。探究
影响电池放电。探究 对放电的影响:向非水电解液中加入少量水,放电后检测
对放电的影响:向非水电解液中加入少量水,放电后检测 、
、 电极上的固体物质。
电极上的固体物质。
 极:
极:
 极:
极: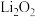 、
、
① 、
、 电极产生
电极产生 的化学方程式分别是
的化学方程式分别是___________ 、___________ 。
② 降低锂—空气电池放电、充电循环性能。
降低锂—空气电池放电、充电循环性能。
(4)探究 对放电的影响:使电池在三种不同气体(物质的量相等)中放电,测量外电路转移的电子与消耗
对放电的影响:使电池在三种不同气体(物质的量相等)中放电,测量外电路转移的电子与消耗 的比值[
的比值[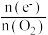 ]。
]。
①放电时,实验i中 极的电极反应式为
极的电极反应式为___________ 。
②下列分析正确的是___________ 。
a. 放电时,i、iii中通过外电路的电子数相等
b. iii中 极所发生的电极反应的产物主要为
极所发生的电极反应的产物主要为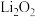
c. iii中 ,说明
,说明 未与
未与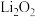 反应
反应
③i、iii中电池放电完毕后充电,iii中产生 的量少于i,推测原因:一是iii中
的量少于i,推测原因:一是iii中 的量比i少,生成
的量比i少,生成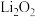 的量较i少;二是
的量较i少;二是___________ 。
(1)锂在元素周期表中的位置是
(2)锂—空气电池的反应原理可表示为:
 。其放电时的工作原理如下图所示:
。其放电时的工作原理如下图所示:
电池工作时,发生氧化反应的是
 ”或“
”或“ ”)极。
”)极。(3)空气中的
 、
、 影响电池放电。探究
影响电池放电。探究 对放电的影响:向非水电解液中加入少量水,放电后检测
对放电的影响:向非水电解液中加入少量水,放电后检测 、
、 电极上的固体物质。
电极上的固体物质。 极:
极:
 极:
极: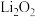 、
、
①
 、
、 电极产生
电极产生 的化学方程式分别是
的化学方程式分别是②
 降低锂—空气电池放电、充电循环性能。
降低锂—空气电池放电、充电循环性能。(4)探究
 对放电的影响:使电池在三种不同气体(物质的量相等)中放电,测量外电路转移的电子与消耗
对放电的影响:使电池在三种不同气体(物质的量相等)中放电,测量外电路转移的电子与消耗 的比值[
的比值[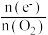 ]。
]。| 实验 | i | ii | iii |
| 气体 |  |  |  |
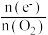 | 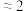 | 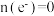 | 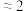 |
 极的电极反应式为
极的电极反应式为②下列分析正确的是
a. 放电时,i、iii中通过外电路的电子数相等
b. iii中
 极所发生的电极反应的产物主要为
极所发生的电极反应的产物主要为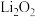
c. iii中
 ,说明
,说明 未与
未与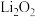 反应
反应③i、iii中电池放电完毕后充电,iii中产生
 的量少于i,推测原因:一是iii中
的量少于i,推测原因:一是iii中 的量比i少,生成
的量比i少,生成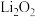 的量较i少;二是
的量较i少;二是
您最近一年使用:0次
2021-11-08更新
|
727次组卷
|
3卷引用:重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题
重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题北京市朝阳区2021-2022学年高三上学期期中考试化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)
名校
解题方法
4 . 氮及其化合物在生产生活中有广泛应用,请回答下列问题。

(1)N4气态分子结构如图1所示,已知断裂1molN—N吸收l67kJ的热量,生成lmol N N放出942kJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式
N放出942kJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式______________ 。
(2)盐N2H6Cl2是离子化合物,性质与NH4Cl类似,其水溶液呈弱酸性。写出足量金属镁加入N2H6Cl2溶液中所发生反应的化学方程式________________ 。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN)且生成N2。若有8.4 g N2生成,则转移电子数为_______ 。
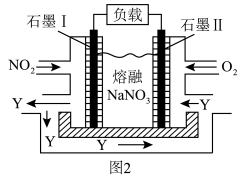
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为_____________ ;若最终得到1mol Y产品,则理论上需要消耗标准状况下O2的体积为__________ L。


(1)N4气态分子结构如图1所示,已知断裂1molN—N吸收l67kJ的热量,生成lmol N
 N放出942kJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式
N放出942kJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式(2)盐N2H6Cl2是离子化合物,性质与NH4Cl类似,其水溶液呈弱酸性。写出足量金属镁加入N2H6Cl2溶液中所发生反应的化学方程式
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN)且生成N2。若有8.4 g N2生成,则转移电子数为
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为
您最近一年使用:0次
名校
解题方法
5 . (1)磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示:

(图中的ΔH表示生成1mol产物的数据)。
①P和Cl2反应生成PCl3的热化学方程式是___ 。
②PCl5分解成PCl3和Cl2的热化学方程式是___ 。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700oC的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g) ΔH=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为
Si3N4(s)+6CO(g) ΔH=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为___ kJ。
(3)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是:___ 。
②由MgO制成的Mg可构成“镁—次氯酸盐”电池,其装置示意图如图,该电池的正极反应式为___ 。


(图中的ΔH表示生成1mol产物的数据)。
①P和Cl2反应生成PCl3的热化学方程式是
②PCl5分解成PCl3和Cl2的热化学方程式是
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700oC的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)
 Si3N4(s)+6CO(g) ΔH=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为
Si3N4(s)+6CO(g) ΔH=-1591.2kJ/mol,则该反应每转移1mole-,可放出的热量为(3)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是:
②由MgO制成的Mg可构成“镁—次氯酸盐”电池,其装置示意图如图,该电池的正极反应式为

您最近一年使用:0次
2020-09-16更新
|
89次组卷
|
2卷引用:重庆市乌江新高考协作体2022-2023学年高一下学期7月期末考试化学试题
解题方法
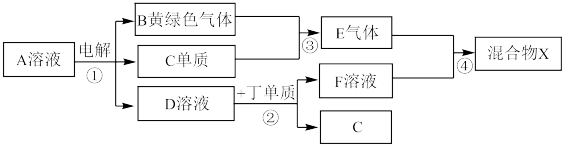
6 . 有甲、乙、丙、丁、戊五种短周期元素,原子序数依次增大,其常见化合价依次为+1、-2、+1、+3、-1。它们形成的物质间的转化关系如下图所示。常温下用惰性电极电解(有阳离子交换膜)1L l mol/L的A溶液。
请按要求回答下列问题:
(1)己元素与丙元素同主族,比丙原子多2个电子层,则己的原子序数为______ ;推测相同条件下丙、己单质分别与水反应剧烈程度的依据是_________ 。
(2)甲、乙、戊按原子个数比1:1:1形成的化合物Y具有漂白性,其电子式为______ 。
(3)上图转化关系中不属于氧化还原反应的有(填编号)______ 。
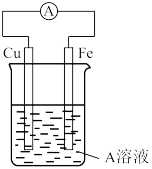
(4)接通如图电路片刻后,向烧杯中滴加一种试剂即可检验铁电极被腐蚀,此反应的离子方程式为___________ 。
(5)写出反应③的化学方程式_________ ;反应②的离子方程式为___________ 。
(6)若上图中各步反应均为恰好完全转化,则混合物X中含有的物质(除水外)有___________ 。

请按要求回答下列问题:
(1)己元素与丙元素同主族,比丙原子多2个电子层,则己的原子序数为
(2)甲、乙、戊按原子个数比1:1:1形成的化合物Y具有漂白性,其电子式为
(3)上图转化关系中不属于氧化还原反应的有(填编号)
(4)接通如图电路片刻后,向烧杯中滴加一种试剂即可检验铁电极被腐蚀,此反应的离子方程式为

(5)写出反应③的化学方程式
(6)若上图中各步反应均为恰好完全转化,则混合物X中含有的物质(除水外)有
您最近一年使用:0次
7 . 氨、尿素[CO(NH2)2]都是氮的重要化合物,在工农业生产中应用广泛。
(1)已知:N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ·mol-1
2NH3(g)ΔH=-92kJ·mol-1
①取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___ 92.2kJ(填“>”、“=”或“<”),原因是_______________ 。
②使用催化剂,该反应△H_____ (填“变大”“变小”或“不变”)。
③已知:分别破坏1molN≡N键、1molH-H键需要吸收的能量为:946kJ、436kJ,则破坏1molN-H键需要吸收的能量为_____ kJ.
(2)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
Ⅰ.2NH3(g)+CO2(g)==NH2CO2NH4(s)△H=﹣159.5kJ/mol
Ⅱ.NH2CO2NH4(s)==CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
Ⅲ.H2O(l)==H2O(g)△H=+44.0kJ/mol
①写出CO2与NH3合成尿素和液态水的热化学反应方程式_______________________ 。
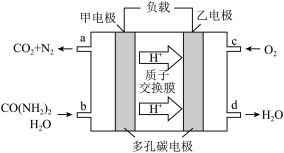
②化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示:
回答下列问题:
电池中的负极为_____ (填“甲”或“乙”),甲的电极反应式为_____________ ,
电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为_____ L。
(1)已知:N2(g)+3H2(g)
 2NH3(g)ΔH=-92kJ·mol-1
2NH3(g)ΔH=-92kJ·mol-1①取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量
②使用催化剂,该反应△H
③已知:分别破坏1molN≡N键、1molH-H键需要吸收的能量为:946kJ、436kJ,则破坏1molN-H键需要吸收的能量为
(2)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
Ⅰ.2NH3(g)+CO2(g)==NH2CO2NH4(s)△H=﹣159.5kJ/mol
Ⅱ.NH2CO2NH4(s)==CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
Ⅲ.H2O(l)==H2O(g)△H=+44.0kJ/mol
①写出CO2与NH3合成尿素和液态水的热化学反应方程式
②化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示:

回答下列问题:
电池中的负极为
电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为
您最近一年使用:0次



