1 . 大多数化学反应都是可逆反应,某小组利用0.1 mol/L KI溶液和0.1 mol/LFeCl3溶液通过实验验证2I-+2Fe3+ 2Fe2++I2为可逆反应。回答下列问题:
2Fe2++I2为可逆反应。回答下列问题:
(1)配制100 mL 0.1000 mol/L KI溶液,需称量固体KI_______ g (精确到0.01)。
(2)实验验证:取1.0 mL 0.1 mol/LKI溶液和1.0 mL 0.1 mol/L FeCl3溶液于试中,充分反应后,滴加几滴KSCN溶液,观察到_______ 证明该反应为可逆反应。
(3)实验探究:向盛有6 mL 0.1 mol/LKI溶液的试管中加入1 mL 0.1 mol/LFeCl3溶液反应后溶液呈黄色;取出2.0 mL反应后混合液,加入2.0 mLCCl4,振荡、静置,液体分层,下层溶液呈紫红色,上层溶液呈淡黄色。
①若要检验萃取后的上层淡黄色溶液中是否含碘单质,可以进行的实验操作是_______ 。
②实验中KI溶液过量的目的是_______ 。
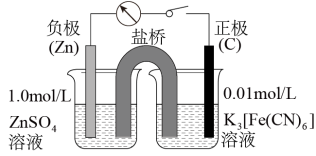
(4)有小组同学采用电化学装置(如图所示)从平衡移动的角度进行了验证。

①向烧杯中分别加入相同体积的0.1 mol/LKI溶液、0.1 mol/L FeCl3溶液,观察到灵敏电流计指针向右偏转(电流方向为从左至右),则乙烧杯中加入的溶液是_______ 。
②随着反应的进行,灵敏电流计指针偏转幅度不断减小,一段时间后示数为0,此时向甲烧杯中加入一定量固体_______ (填标号),可观察到灵敏电流计指针向左偏转。
A. FeCl2 B. FeCl3 C. I2
(5)写出氯化铁在生活中的一种用途:_______ 。
 2Fe2++I2为可逆反应。回答下列问题:
2Fe2++I2为可逆反应。回答下列问题:(1)配制100 mL 0.1000 mol/L KI溶液,需称量固体KI
(2)实验验证:取1.0 mL 0.1 mol/LKI溶液和1.0 mL 0.1 mol/L FeCl3溶液于试中,充分反应后,滴加几滴KSCN溶液,观察到
(3)实验探究:向盛有6 mL 0.1 mol/LKI溶液的试管中加入1 mL 0.1 mol/LFeCl3溶液反应后溶液呈黄色;取出2.0 mL反应后混合液,加入2.0 mLCCl4,振荡、静置,液体分层,下层溶液呈紫红色,上层溶液呈淡黄色。
①若要检验萃取后的上层淡黄色溶液中是否含碘单质,可以进行的实验操作是
②实验中KI溶液过量的目的是
(4)有小组同学采用电化学装置(如图所示)从平衡移动的角度进行了验证。

①向烧杯中分别加入相同体积的0.1 mol/LKI溶液、0.1 mol/L FeCl3溶液,观察到灵敏电流计指针向右偏转(电流方向为从左至右),则乙烧杯中加入的溶液是
②随着反应的进行,灵敏电流计指针偏转幅度不断减小,一段时间后示数为0,此时向甲烧杯中加入一定量固体
A. FeCl2 B. FeCl3 C. I2
(5)写出氯化铁在生活中的一种用途:
您最近一年使用:0次
22-23高一下·浙江·期中
解题方法
2 . 化学反应原理在生产、生活中用途广泛。
(1)汽车尾气中 生成过程的能量变化如图所示。
生成过程的能量变化如图所示。 和
和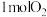 完全反应生成
完全反应生成 会
会_______ (填“吸收”或“放出”)_______  能量。
能量。
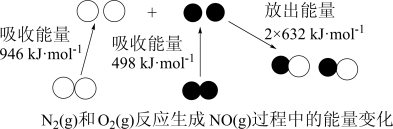
(2)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①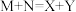 ;②
;② 。反应体系中组分M、Z的浓度随时间变化情况如图所示。则
。反应体系中组分M、Z的浓度随时间变化情况如图所示。则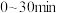 时间段内,Y的平均反应速率为
时间段内,Y的平均反应速率为_______ 。

(3)实验室模拟热气循环法合成尿素, 时,将一定量
时,将一定量 与
与 在容积固定的恒温密闭容器中发生反应:
在容积固定的恒温密闭容器中发生反应: ,反应放热。下列情况中,能说明该反应达到平衡的是
,反应放热。下列情况中,能说明该反应达到平衡的是_______ 。
A.反应体系中气体分子的平均摩尔质量保持不变
B.反应体系中气体的密度保持不变
C.反应消耗 同时生成
同时生成
D. ,
, ,
, 三种气体的物质的量比为2∶1∶1
三种气体的物质的量比为2∶1∶1
E.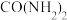 的质量保持不变
的质量保持不变
(4)在硫酸工业中,通过下列反应将 氧化成
氧化成 :
: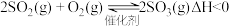 。已知催化剂是
。已知催化剂是 ,在
,在 左右时催化效果最好。下表为不同温度和压强下
左右时催化效果最好。下表为不同温度和压强下 的平衡转化率:
的平衡转化率:
结合表中信息,实际情况下最合理的生产条件为:_______。
(5)锂-氧气电池因其比能量非常高,具有广阔应用前景。下图是一种锂-氧气( )电池的工作示意图,
)电池的工作示意图,
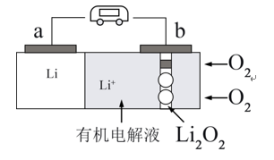
①电池放电时,b为_______ 极(填“正”或“负”),电极反应式为:_______ 。
②若采用空气作为氧气源,则会发生副反应导致电池性能下降,请写出一个可能的副反应的化学方程式:_______ 。
(1)汽车尾气中
 生成过程的能量变化如图所示。
生成过程的能量变化如图所示。 和
和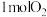 完全反应生成
完全反应生成 会
会 能量。
能量。
(2)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①
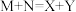 ;②
;② 。反应体系中组分M、Z的浓度随时间变化情况如图所示。则
。反应体系中组分M、Z的浓度随时间变化情况如图所示。则 时间段内,Y的平均反应速率为
时间段内,Y的平均反应速率为
(3)实验室模拟热气循环法合成尿素,
 时,将一定量
时,将一定量 与
与 在容积固定的恒温密闭容器中发生反应:
在容积固定的恒温密闭容器中发生反应: ,反应放热。下列情况中,能说明该反应达到平衡的是
,反应放热。下列情况中,能说明该反应达到平衡的是A.反应体系中气体分子的平均摩尔质量保持不变
B.反应体系中气体的密度保持不变
C.反应消耗
 同时生成
同时生成
D.
 ,
, ,
, 三种气体的物质的量比为2∶1∶1
三种气体的物质的量比为2∶1∶1E.
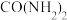 的质量保持不变
的质量保持不变(4)在硫酸工业中,通过下列反应将
 氧化成
氧化成 :
: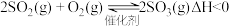 。已知催化剂是
。已知催化剂是 ,在
,在 左右时催化效果最好。下表为不同温度和压强下
左右时催化效果最好。下表为不同温度和压强下 的平衡转化率:
的平衡转化率:| 压强 |  | 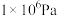 | 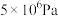 | 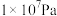 |
 时 时 的平衡转化率 的平衡转化率 | 97.5% | 99.2% | 99.6% | 99.7% |
 时 时 的平衡转化率 的平衡转化率 | 85.6% | 94.9% | 97.7% | 98.3% |
A. , ,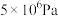 | B. , ,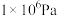 |
C. , , | D. , ,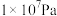 |
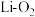 )电池的工作示意图,
)电池的工作示意图,
①电池放电时,b为
②若采用空气作为氧气源,则会发生副反应导致电池性能下降,请写出一个可能的副反应的化学方程式:
您最近一年使用:0次
解题方法
3 . 硅是太阳能电池的重要材料。方法1是目前工业冶炼纯硅的一种原理:
粗硅冶炼:
①
精炼硅:
②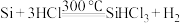
③
反应①过程中的能量变化如图所示,回答下列问题:
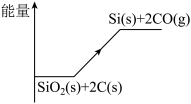
(1)①是________ 反应(填“吸热”或“放热”),结合图中信息说明判断依据__________ 。
(2)下列关于物质的性质与用途的说法均正确的是____________ 。(填字母)
A.石墨烯电阻率高,可用于制备动力电池
B.碳化硅硬度很大,用作砂纸和砂轮的磨料
C.硅单质是应用最广泛的半导体材料,其导电性介于导体和绝缘体之间
(3)工业上也曾用方法2来提纯单晶硅: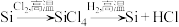 ,与方法1相比,方法2的缺点是
,与方法1相比,方法2的缺点是__________________________ 。
(4)某同学在用稀硫酸与锌制取氢气的实验中,意外地发现滴加几滴 溶液后反应速率加快了,原因可能是
溶液后反应速率加快了,原因可能是____________ 。(填字母)
a. 是催化剂 b.Zn、
是催化剂 b.Zn、 、
、 构成原电池
构成原电池
c.Zn、Cu、 构成原电池 d.上述分析均不正确
构成原电池 d.上述分析均不正确
粗硅冶炼:
①

精炼硅:
②
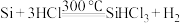
③

反应①过程中的能量变化如图所示,回答下列问题:

(1)①是
(2)下列关于物质的性质与用途的说法均正确的是
A.石墨烯电阻率高,可用于制备动力电池
B.碳化硅硬度很大,用作砂纸和砂轮的磨料
C.硅单质是应用最广泛的半导体材料,其导电性介于导体和绝缘体之间
(3)工业上也曾用方法2来提纯单晶硅:
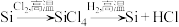 ,与方法1相比,方法2的缺点是
,与方法1相比,方法2的缺点是(4)某同学在用稀硫酸与锌制取氢气的实验中,意外地发现滴加几滴
 溶液后反应速率加快了,原因可能是
溶液后反应速率加快了,原因可能是a.
 是催化剂 b.Zn、
是催化剂 b.Zn、 、
、 构成原电池
构成原电池c.Zn、Cu、
 构成原电池 d.上述分析均不正确
构成原电池 d.上述分析均不正确
您最近一年使用:0次
名校
4 . K4[Fe(CN)6](亚铁氯化钾)俗称黄血盐,是国内外广泛使用的食盐抗结剂,可以防止食盐受潮结块,其在化学实验、电镀、食品添加剂及医学上有广泛用途。用含NaCN废水合成黄血盐的主要工艺流程如图:
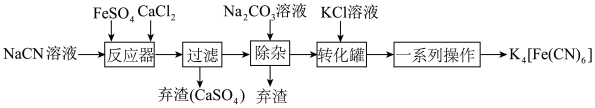
回答下列问题:
(1)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至400℃时能分解产生氰化钾(KCN)。据此判断,烹饪食品时,使用含黄血盐的食盐应注意的问题为____ 。
(2)HCN是一种极弱的酸。实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液再用蒸馏水稀释,用平衡移动原理(离子方程式及文字)解释其原因____ 。
(3)流程中加入碳酸钠溶液的主要目的是____ ,用碳酸钾代替纯碱进行脱钙反应,可以直接得到亚铁氰化钾,沉淀和产物容易彻底分离,但是成本高。有人认为也可以用硫酸钾,实际上不妥,其原因是____ 。
(4)流程中的一系列操作包括结晶、过滤、洗涤、干燥等步骤。为了得到较大颗粒的亚铁氰化钾,结晶速率应该是____ (填“快速”或“慢速”)。
(5)在25℃下,将amol·L-1的KCN溶液与0.01mol·L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a____ 0.01mol·L-1(填“>”、“<”或“=”),用含a的代数式表示HCN的电离常数K=____ 。
(6)亚铁氰化钾易被氧化为铁氰化钾,检验是否变质的方法是____ ,借助下列装置可以将铁氰化钾转化为亚铁氰化钾,其正极的电极反应式为____ 。

回答下列问题:
(1)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至400℃时能分解产生氰化钾(KCN)。据此判断,烹饪食品时,使用含黄血盐的食盐应注意的问题为
(2)HCN是一种极弱的酸。实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液再用蒸馏水稀释,用平衡移动原理(离子方程式及文字)解释其原因
(3)流程中加入碳酸钠溶液的主要目的是
(4)流程中的一系列操作包括结晶、过滤、洗涤、干燥等步骤。为了得到较大颗粒的亚铁氰化钾,结晶速率应该是
(5)在25℃下,将amol·L-1的KCN溶液与0.01mol·L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a
(6)亚铁氰化钾易被氧化为铁氰化钾,检验是否变质的方法是

您最近一年使用:0次
2022-05-07更新
|
347次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2022届高三第三次模拟考试化学试题



