名校
1 . 下列实验装置符合实验目的的是
| 目的 | 粗铜的精炼 | 验证含酚酞的饱和氯化钠溶液电解产物 | 铁制品上镀铜 | 将铁和氯化铁溶液反应设计成原电池 |
| 装置 |  |  |  |  |
| 选项 | A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-27更新
|
431次组卷
|
3卷引用:天津市静海区第一中学2020-2021学年高二上学期期末考试化学试题
20-21高二上·全国·课后作业
名校
解题方法
2 . 如图为直流电源电解Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊试液。下列实验现象中正确的是
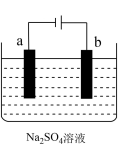

| A.逸出气体的体积,a电极的小于b电极的 |
| B.一电极逸出无味气体,另一电极逸出刺激性气味气体 |
| C.a电极附近呈红色,b电极附近呈蓝色 |
| D.a电极附近呈蓝色,b电极附近呈红色 |
您最近一年使用:0次
2020-12-13更新
|
1058次组卷
|
16卷引用:天津市天津中学2022-2023学年高二上学期线上期末考试化学试题
天津市天津中学2022-2023学年高二上学期线上期末考试化学试题西藏自治区拉萨那曲高级中学2020-2021学年高二下学期期末考试化学试题山西省阳泉市2022-2023学年高二上学期期末化学试题上海市上海中学2022-2023学年高一下学期期末考试化学试题(已下线)4.2.1 电解原理(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)云南省玉溪市华宁二中2020-2021学年高二下学期期中考试化学试题陕西省榆林市第十二中学2021-2022学年高二上学期教学质量摸底评估化学试题(已下线)4.2.1 电解原理(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第4章 电化学基础(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)广东省揭阳市惠来县第一中学2021-2022学年高二上学期第二次阶段考试化学试题(已下线)第四章 化学反应与电能(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)(已下线)4.2.1 电解池原理-同步学习必备知识云南省玉龙纳西族自治县田家炳民族中学2021-2022学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2022-2023学年高二下学期开学考试化学试题(已下线)电解池 金属的腐蚀与防护新疆喀什市第五中学2023-2024学年高三上学期12月大联考化学预测卷
名校
解题方法
3 . 钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法不正确的是
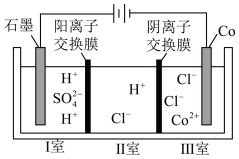

| A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大 |
B.电解总反应:2Co2++2H2O 2Co+O2↑+4H+ 2Co+O2↑+4H+ |
| C.移除两交换膜后,石墨电极上发生的反应会发生变化 |
| D.生成2molCo,Ⅰ室溶液质量理论上减少36g |
您最近一年使用:0次
名校
解题方法
4 . 化学反应是人类获得能量的重要途径。请结合所学知识解决以下问题。
I.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
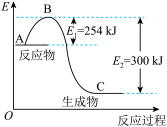
(1)如图是 和
和 反应生成
反应生成 的过程中能量变化示意图,请写出
的过程中能量变化示意图,请写出 和
和 反应的热化学方程式
反应的热化学方程式_______ 。
(2)用 催化还原NO,还可以消除氮氧化物的污染。已知:
催化还原NO,还可以消除氮氧化物的污染。已知:
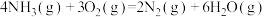
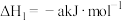 ①
①
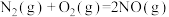
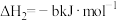 ②
②
若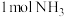 还原NO至
还原NO至 ,则该反应过程中的反应热
,则该反应过程中的反应热
____ kJ/mol(用含a、b的式子表示)。
II.某科研单位利用电化学原理用来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
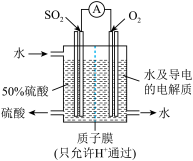
(3)通入 的电极为
的电极为_______ 极,其电极反应式为_______ 。
(4)电解质溶液中的 通过质子膜
通过质子膜_______ 移动(填“向左”、“向右”或“不”)。
III.用石墨棒作电极,在 、
、 、
、 、
、 等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(5)当阴极放出 ,阳极放出
,阳极放出 时,电解质是
时,电解质是_______ (写化学式,下同)。
(6)当阴极放出 ,阳极放出
,阳极放出 时,电解质是
时,电解质是_______ 。
(7)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质是_______ 。
I.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是
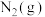 和
和 反应生成
反应生成 的过程中能量变化示意图,请写出
的过程中能量变化示意图,请写出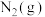 和
和 反应的热化学方程式
反应的热化学方程式
(2)用
 催化还原NO,还可以消除氮氧化物的污染。已知:
催化还原NO,还可以消除氮氧化物的污染。已知: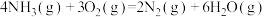
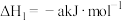 ①
①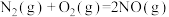
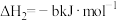 ②
②若
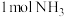 还原NO至
还原NO至 ,则该反应过程中的反应热
,则该反应过程中的反应热
II.某科研单位利用电化学原理用来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。

(3)通入
 的电极为
的电极为(4)电解质溶液中的
 通过质子膜
通过质子膜III.用石墨棒作电极,在
 、
、 、
、 、
、 等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:(5)当阴极放出
 ,阳极放出
,阳极放出 时,电解质是
时,电解质是(6)当阴极放出
 ,阳极放出
,阳极放出 时,电解质是
时,电解质是(7)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质是
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题
(1)下列事实中,与电化学腐蚀无关的是_______
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
(2)以石墨为电极,电解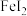 溶液,阳极电极反应式为
溶液,阳极电极反应式为_______ 。
(3)利用反应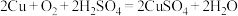 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应式为
,若将该反应设计为原电池,其正极电极反应式为_______ 。
(4)利用人工光合作用可将 转化为甲酸,反应原理为
转化为甲酸,反应原理为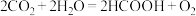 ,装置如图所示:
,装置如图所示:
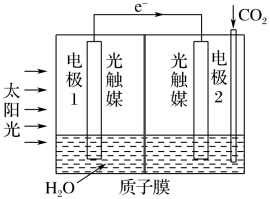
电极2的电极反应式是_______ ;
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、 和
和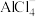 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的_______ 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______ 。
(6)已知 是可逆反应,设计如图装置(
是可逆反应,设计如图装置(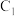 、
、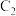 均为石墨电极)开始时:
均为石墨电极)开始时: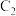 棒电极反应式
棒电极反应式_______ ,当电流表_______ 时,反应达到化学平衡状态。
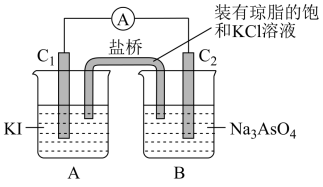
(1)下列事实中,与电化学腐蚀无关的是
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.金属钠置于空气中表面变暗
C.镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
E.生铁比软铁芯(几乎是纯铁)容易生锈
F.铁制器件附有铜制配件,在接触处易生铁锈
(2)以石墨为电极,电解
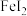 溶液,阳极电极反应式为
溶液,阳极电极反应式为(3)利用反应
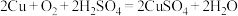 可制备
可制备 ,若将该反应设计为原电池,其正极电极反应式为
,若将该反应设计为原电池,其正极电极反应式为(4)利用人工光合作用可将
 转化为甲酸,反应原理为
转化为甲酸,反应原理为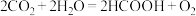 ,装置如图所示:
,装置如图所示:
电极2的电极反应式是
(5)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、
 和
和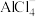 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的(6)已知
 是可逆反应,设计如图装置(
是可逆反应,设计如图装置(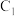 、
、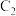 均为石墨电极)开始时:
均为石墨电极)开始时: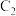 棒电极反应式
棒电极反应式
您最近一年使用:0次
解题方法
6 . 物质的化学能可以在不同的条件下转化为热能、电能被人类利用。按要求回答下列问题。
(1)微生物电池是指在微生物作用下将化学能转化为电能的装置。其工作原理如下图所示。
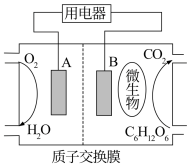
①A为生物燃料电池的_______ (填“正”或“负”)极。
②负极的电极反应式为_______ 。
③放电过程中, 由
由_______ 极区向_______ 极区迁移(填“正”或“负”)。
(2)用阴离子交换膜控制电解液中 的浓度制备纳米
的浓度制备纳米 。反应为
。反应为 ,装置如图。
,装置如图。
①电解时_______ 通过阴离子交换膜向_______ 极移动。
②阳极电极反应式为_______ 。
③阴极电极反应式为_______ 。
(3)我国科研人员研制出的可充电“ ”电池,以钠箔和多壁碳纳米管(
”电池,以钠箔和多壁碳纳米管(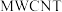 )为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为
)为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为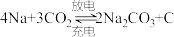 。放电时该电池“吸入”
。放电时该电池“吸入” 。
。
①放电时,正极的电极反应式为_______ 。
②可选用高氯酸钠-四甘醇二甲醚作电解液的理由是_______ 。
(1)微生物电池是指在微生物作用下将化学能转化为电能的装置。其工作原理如下图所示。

①A为生物燃料电池的
②负极的电极反应式为
③放电过程中,
 由
由(2)用阴离子交换膜控制电解液中
 的浓度制备纳米
的浓度制备纳米 。反应为
。反应为 ,装置如图。
,装置如图。
①电解时
②阳极电极反应式为
③阴极电极反应式为
(3)我国科研人员研制出的可充电“
 ”电池,以钠箔和多壁碳纳米管(
”电池,以钠箔和多壁碳纳米管(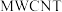 )为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为
)为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为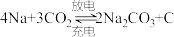 。放电时该电池“吸入”
。放电时该电池“吸入” 。
。①放电时,正极的电极反应式为
②可选用高氯酸钠-四甘醇二甲醚作电解液的理由是
您最近一年使用:0次
2022高三·全国·专题练习
7 . 一种采用 和
和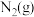 为原料制备
为原料制备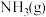 的装置示意图如下。
的装置示意图如下。
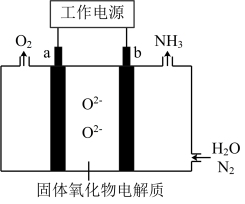
下列有关说法正确的是
 和
和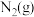 为原料制备
为原料制备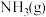 的装置示意图如下。
的装置示意图如下。
下列有关说法正确的是
A.在b电极上, 被还原 被还原 |
| B.金属Ag可作为a电极的材料 |
| C.改变工作电源电压,反应速率不变 |
D.电解过程中,固体氧化物电解质中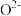 不断减少 不断减少 |
您最近一年使用:0次
2022-07-04更新
|
12207次组卷
|
33卷引用:天津市宝坻区第一中学2022-2023学年高三上学期线上期末训练化学试题
天津市宝坻区第一中学2022-2023学年高三上学期线上期末训练化学试题吉林省长春外国语学校2021-2022学年高二下学期期末考试化学试题黑龙江省大庆铁人中学2022-2023学年高一下学期期末化学试题(已下线)专题08 电化学及其应用-2022年高考真题模拟题分项汇编2022年海南省高考真题化学试题(已下线)2022年海南省高考真题变式题1-14(已下线)第19讲 电解池 金属的电化学腐蚀与防护(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第16讲 原电池 新型电源 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点19 电化学基础-备战2023年高考化学考试易错题广东省惠州市2022-2023学年高三上学期第二次调研考试 化学试题(已下线)专题05 化学能与电能的转化(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题十一 化学能与电能-实战高考·二轮复习核心突破重庆市西南大学附属中学校2022-2023学年高二上学期开学定时训练化学试题(广延班)(已下线)专题16 新型电化学装置分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题11 新型电池和电解原理的应用(已下线)专题三 新型电池(练习)(已下线)专题四 电解池的工作原理及其应用(练习)(已下线)回归教材重难点07 重温“两池”原理-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题九 电化学装置图(练)(已下线)题型17 燃料电池的应用广东省惠州市2022-2023学年高三上学期第二次调研考试化学试题(已下线)专题12 电化学的综合应用(已下线)专题12 电化学的综合应用(已下线)第17练 电解原理及其应用 金属腐蚀与防护 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题07 电化学及其应用-2023年高考化学真题题源解密(新高考专用)(已下线)专题10 电化学及其应用-2023年高考化学真题题源解密(全国通用)作业(二十四) 电解原理(已下线)考点19 电解池(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第4讲 电解池 金属的电化学腐蚀与防护(已下线)考点2 原电池 新型电源(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点3 电解池 金属的腐蚀与防护(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)黑龙江省哈尔滨市德强高级中学2023-2024学年高三上学期期中考试化学试题河北省石家庄市辛集市育才中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
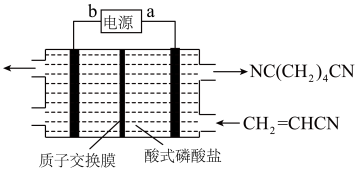
8 . 制造尼龙-66的原料己二腈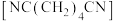 用量很大,现代工业常用电合成丙烯腈法制备,总反应是
用量很大,现代工业常用电合成丙烯腈法制备,总反应是 ,装置如图:下列说法正确的是
,装置如图:下列说法正确的是
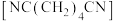 用量很大,现代工业常用电合成丙烯腈法制备,总反应是
用量很大,现代工业常用电合成丙烯腈法制备,总反应是 ,装置如图:下列说法正确的是
,装置如图:下列说法正确的是
| A.电子从电源a极流出,经溶液流回b极 |
B. 中C原子的杂化方式均为 中C原子的杂化方式均为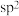 |
C.阴极电极反应为: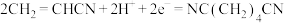 |
D.当生成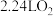 时,电路中通过 时,电路中通过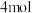 电子 电子 |
您最近一年使用:0次
2022-05-30更新
|
273次组卷
|
2卷引用:天津市第十四中学2022-2023学年高三上学期期末考试化学试题
9 . 电化学在工业有着广泛的应用
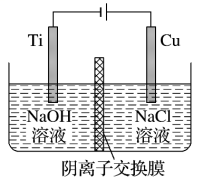
(1)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图1所示。

①该电解槽的阴极反应式是___ 。
②除去杂质后的氢氧化钾溶液从液体___ 出口(填写“A”或“B”)导出。
(2)甲醇(CH3OH)燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。图2所示为酸性介质甲醇燃料电池。
①通入a的电极是电池的___ (填“正”或“负”)极,其电极反应式___ 。
②甲醇燃料电池(酸性介质)可用于测量阿伏加德罗常数。当电池平稳工作5min后测得电池正极端消耗标准状况下氧气vmL,电流稳定为xA,假设能量转化率100%,计算测得阿伏加德罗常数NA为___ mol-1(用x、v表示,已知电子电量e=1.60×10-19C)。
(3)采用如图3所示的简易装置(A、B电极均为惰性电极)电解饱和食盐水可以制备84消毒液。A为___ 极,制备84消毒液的总反应的化学方程式为___ 。
(1)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图1所示。

①该电解槽的阴极反应式是
②除去杂质后的氢氧化钾溶液从液体
(2)甲醇(CH3OH)燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。图2所示为酸性介质甲醇燃料电池。
①通入a的电极是电池的
②甲醇燃料电池(酸性介质)可用于测量阿伏加德罗常数。当电池平稳工作5min后测得电池正极端消耗标准状况下氧气vmL,电流稳定为xA,假设能量转化率100%,计算测得阿伏加德罗常数NA为
(3)采用如图3所示的简易装置(A、B电极均为惰性电极)电解饱和食盐水可以制备84消毒液。A为
您最近一年使用:0次
2017高二·全国·课时练习
名校
解题方法
10 . 示意图甲为锌铜原电池装置,乙为电解熔融氯化钠制备金属钠的装置。 下列说法正确的是
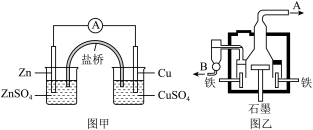

| A.甲装置中锌为负极,发生还原反应;铜为正极,发生氧化反应 |
| B.甲装置盐桥可以使反应过程中溶液保持电中性 |
| C.乙装置中铁极的电极反应式为:2Na-2e- = 2Na+ |
| D.乙装置中 B 是氯气出口,A 是钠出口 |
您最近一年使用:0次
2020-03-27更新
|
415次组卷
|
10卷引用:天津市六校联考2020-2021学年度高二上学期期末考试化学试题
天津市六校联考2020-2021学年度高二上学期期末考试化学试题山东省泰安市2019-2020学年高二上学期期末考试化学试题安徽省蚌埠市2020-2021学年高二上学期期末统考化学试题(已下线)4.3.2 电解原理的应用高中化学人教版 选修四 第四章 电化学基础 第三节 电解池 电解池第二课时(电解原理的应用)湖南省临武一中、嘉禾一中2017-2018学年高二12月联考化学试题2018-2019学年鲁科版高中化学选修四:模块综合检测题(二)安徽省阜阳市第三中学2018-2019学年高二下学期开学考试化学试题安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题内蒙古呼和浩特市第二中学20222-2023学年高二上学期期中化学试题



