名校
解题方法
1 . 《自然》杂志报道,科学家们设计出了利用合成气合成液态烃和甲醇,模拟制备合成气的装置如图所示。下列说法不正确的是


| A.交换膜是阳离子交换膜 |
| B.a极是正极,发生还原反应 |
C.由 合成 合成 的电极反应式为 的电极反应式为 |
D.当装置中产生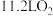 (标准状态)时,理论上迁移的离子为 (标准状态)时,理论上迁移的离子为 |
您最近一年使用:0次
解题方法
2 . 最近我国科学家以 与己二胺为原料实现了甲酸盐和己二腈的高选择性合成,该合成的原理如下图所示。
与己二胺为原料实现了甲酸盐和己二腈的高选择性合成,该合成的原理如下图所示。
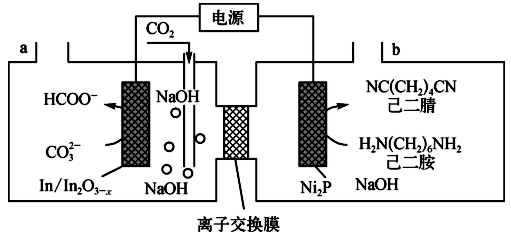
下列说法正确的是
 与己二胺为原料实现了甲酸盐和己二腈的高选择性合成,该合成的原理如下图所示。
与己二胺为原料实现了甲酸盐和己二腈的高选择性合成,该合成的原理如下图所示。
下列说法正确的是
A. 电极与电源负极相连 电极与电源负极相连 |
| B.当离子交换膜为阳离子选择性交换膜时,b中氢氧化钠的物质的量不变 |
C.在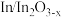 电极上发生的反应为: 电极上发生的反应为: |
D.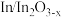 电极上可能有副产物 电极上可能有副产物 生成 生成 |
您最近一年使用:0次
2022-01-29更新
|
89次组卷
|
4卷引用:湖南省湖湘名校联盟2021-2022学年高二上学期期末考试化学试题
湖南省湖湘名校联盟2021-2022学年高二上学期期末考试化学试题湖南省湘潭县2021-2022学年高二上学期期末考试化学试题(已下线)黄金卷6-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)押江苏卷第12题 电化学及其应用 -备战2022年高考化学临考题号押题(江苏卷)
3 . 研究氨的制备、应用及氨氮的去除有重要意义。
(1)电解法制氨。
如图所示的电解池电解 溶液可制得氨。工作时,
溶液可制得氨。工作时, 在双极膜(由阴、阳离子膜复合而成)界面处解离成
在双极膜(由阴、阳离子膜复合而成)界面处解离成 和
和 ,分别通过阴、阳离子膜分别进入两侧极室。
,分别通过阴、阳离子膜分别进入两侧极室。

①进入a极室的离子是___________ (填“ ”或“
”或“ ”)。
”)。
②产生 的电极反应式为
的电极反应式为___________ 。
③电解池工作时,在电极b可得到副产品___________ 。
(2)氨的应用。以 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:
Ⅰ. 和
和 生成
生成 ;
;
Ⅱ. 分解生成
分解生成 。
。
反应过程中能量变化如图所示。

①总反应的速率取决于第___________ 步。
② 反应的
反应的
___________ (用图中能量数据表示)。
(3)氨氮的去除。
用 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。
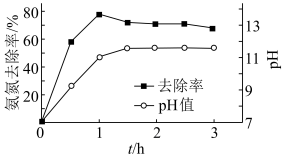
①电解时两极反应式分别为: ,
,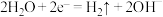 。写出废水中生成
。写出废水中生成 沉淀的离子方程式:
沉淀的离子方程式:___________ 。
②反应 以后,氨氮去除率随时间的延长反而下降的原因是
以后,氨氮去除率随时间的延长反而下降的原因是___________ 。
(1)电解法制氨。
如图所示的电解池电解
 溶液可制得氨。工作时,
溶液可制得氨。工作时, 在双极膜(由阴、阳离子膜复合而成)界面处解离成
在双极膜(由阴、阳离子膜复合而成)界面处解离成 和
和 ,分别通过阴、阳离子膜分别进入两侧极室。
,分别通过阴、阳离子膜分别进入两侧极室。
①进入a极室的离子是
 ”或“
”或“ ”)。
”)。②产生
 的电极反应式为
的电极反应式为③电解池工作时,在电极b可得到副产品
(2)氨的应用。以
 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:Ⅰ.
 和
和 生成
生成 ;
;Ⅱ.
 分解生成
分解生成 。
。反应过程中能量变化如图所示。

①总反应的速率取决于第
②
 反应的
反应的
(3)氨氮的去除。
用
 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。
①电解时两极反应式分别为:
 ,
,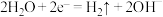 。写出废水中生成
。写出废水中生成 沉淀的离子方程式:
沉淀的离子方程式:②反应
 以后,氨氮去除率随时间的延长反而下降的原因是
以后,氨氮去除率随时间的延长反而下降的原因是
您最近一年使用:0次
2024-02-04更新
|
98次组卷
|
2卷引用:江苏省苏州市2023-2024学年高二上学期期末学业质量阳光指标调研化学试卷
解题方法
4 . 我国科技工作者设计了如图所示的电化学装置(隔膜a只允许OH-通过),实现了两电极体系中二氧化碳和辛胺【CH3(CH2)7NH2】制备甲酸和辛腈【 】的高选择性合成。下列说法正确的是
】的高选择性合成。下列说法正确的是

 】的高选择性合成。下列说法正确的是
】的高选择性合成。下列说法正确的是
A.理论上有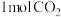 参与反应,会有2mol辛腈生成 参与反应,会有2mol辛腈生成 |
B.电解过程中,In/In2O3-x电极区的反应为 |
C.电解过程中,溶液中的 从右边移向左边 从右边移向左边 |
| D.每消耗xmol的CO2理论上通过隔膜a的OH-也为2xmol |
您最近一年使用:0次
名校
5 . 过渡元素的金属及其氧化物常用作反应的催化剂。
(1) 和
和 催化合成
催化合成 的反应如下:
的反应如下: (未配平)
(未配平)
①该反应的催化历程可简化为两步:第Ⅰ步: ;第Ⅱ步的方程式为
;第Ⅱ步的方程式为___________ 。第Ⅰ步反应决定了总反应达到平衡的时间,两步反应的活化能EI___________ EⅡ。(填“>”、“=”或“<”)
②加入Ga可以增大催化剂的表面积。Ga的基态原子核外电子排布式为___________ 。
(2)我国科学家以 和
和 为原料,熔融
为原料,熔融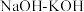 为离子导体,通过催化电解法制备
为离子导体,通过催化电解法制备 ,装置如图1所示,其中在电极B上的反应过程如图2所示。
,装置如图1所示,其中在电极B上的反应过程如图2所示。

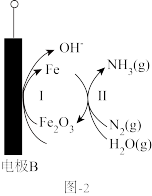
①参与电极B上反应的催化剂是___________ ,
②描述在电极B上催化生成 的过程
的过程___________ 。
(3)富氧条件下, 和NO在钒基催化作用下发生脱硝反应,方程式可表示为
和NO在钒基催化作用下发生脱硝反应,方程式可表示为
主反应: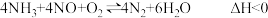
副反应:Ⅰ.
Ⅱ.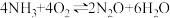
…… ……
不同氨氮比[ ]下,NO的转化率和
]下,NO的转化率和 的生成量随温度的变化曲线如图3和图4所示,测得300℃后,
的生成量随温度的变化曲线如图3和图4所示,测得300℃后, 转化率基本不变。
转化率基本不变。
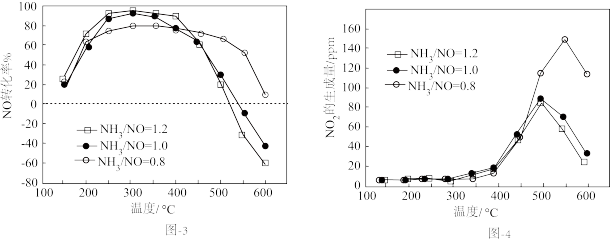
①上述脱硝的主反应中,分别被NO和 氧化的
氧化的 的质量之比为
的质量之比为___________ ,
②超过400℃:温度升高,NO转化率下降,可能原因是___________ ;氨氮比越大,NO转化率越小,可能原因是___________ 。
(1)
 和
和 催化合成
催化合成 的反应如下:
的反应如下: (未配平)
(未配平)①该反应的催化历程可简化为两步:第Ⅰ步:
 ;第Ⅱ步的方程式为
;第Ⅱ步的方程式为②加入Ga可以增大催化剂的表面积。Ga的基态原子核外电子排布式为
(2)我国科学家以
 和
和 为原料,熔融
为原料,熔融 为离子导体,通过催化电解法制备
为离子导体,通过催化电解法制备 ,装置如图1所示,其中在电极B上的反应过程如图2所示。
,装置如图1所示,其中在电极B上的反应过程如图2所示。

①参与电极B上反应的催化剂是
②描述在电极B上催化生成
 的过程
的过程(3)富氧条件下,
 和NO在钒基催化作用下发生脱硝反应,方程式可表示为
和NO在钒基催化作用下发生脱硝反应,方程式可表示为主反应:
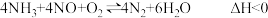
副反应:Ⅰ.

Ⅱ.
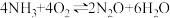
…… ……
不同氨氮比[
 ]下,NO的转化率和
]下,NO的转化率和 的生成量随温度的变化曲线如图3和图4所示,测得300℃后,
的生成量随温度的变化曲线如图3和图4所示,测得300℃后, 转化率基本不变。
转化率基本不变。
①上述脱硝的主反应中,分别被NO和
 氧化的
氧化的 的质量之比为
的质量之比为②超过400℃:温度升高,NO转化率下降,可能原因是
您最近一年使用:0次
2022-01-23更新
|
370次组卷
|
2卷引用:江苏省泰州市2021-2022学年高二上学期期末考试化学试卷
名校
解题方法
6 . -芳硒基酮作为重要的中间体在有机合成方面具有重要应用, 电化学氧化-碘促进法采用丙酮和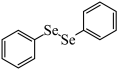 为原料,最终得到硒基丙酮化合物(
为原料,最终得到硒基丙酮化合物( ),其工作原理如图所示(A、B均为惰性电极)。下列说法正确的是
),其工作原理如图所示(A、B均为惰性电极)。下列说法正确的是

 为原料,最终得到硒基丙酮化合物(
为原料,最终得到硒基丙酮化合物( ),其工作原理如图所示(A、B均为惰性电极)。下列说法正确的是
),其工作原理如图所示(A、B均为惰性电极)。下列说法正确的是
A.该装置发生的总反应方程式为:2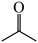 + +  2 2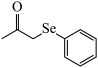 +H2↑ +H2↑ |
| B.该装置将电能转化为化学能,C为电源的负极 |
| C.阴极发生的电极反应为:I2+2e-=2I- |
| D.装置工作时,阴离子移向B电极 |
您最近一年使用:0次
2021-08-04更新
|
309次组卷
|
2卷引用:重庆南开中学2020-2021学年高二下学期期末考试化学试题
解题方法
7 . (1)二氧化碳是主要的温室气体,对二氧化碳的研究和利用在生产和生活中有重要意义。
(1)二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。
①在恒温恒容的密闭容器中通入一定量的CO2和H2发生反应,生成乙烯和水蒸气,下列能说明该反应达到平衡状态的是__ 。
A.容器内的压强不发生变化
B.生成的乙烯和水蒸气物质的量比为1∶4
C.断裂3molH—H键的同时断裂4molH—O键
D.v(CO2)正=3v(H2)逆
当反应达到平衡时,若在容器中通入氩气以增大压强,则n(C2H4)__ (填“变大”、“变小”或“不变”)。
②理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1Mpa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图1所示。

图1中,表示C2H4、CO2变化的曲线分别是___ 、___ 。CO2催化加氢合成C2H4反应的△H___ 0(填“大于”或“小于”)。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图见图2。
①写出阴极CO2还原为HCOO-的电极反应式:___ 。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是:___ 。
(1)二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。
①在恒温恒容的密闭容器中通入一定量的CO2和H2发生反应,生成乙烯和水蒸气,下列能说明该反应达到平衡状态的是
A.容器内的压强不发生变化
B.生成的乙烯和水蒸气物质的量比为1∶4
C.断裂3molH—H键的同时断裂4molH—O键
D.v(CO2)正=3v(H2)逆
当反应达到平衡时,若在容器中通入氩气以增大压强,则n(C2H4)
②理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1Mpa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图1所示。

图1中,表示C2H4、CO2变化的曲线分别是
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图见图2。
①写出阴极CO2还原为HCOO-的电极反应式:
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是:
您最近一年使用:0次
名校
解题方法
8 . 氢气在工业合成中广泛应用。
(1)通过下列反应可以制备甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH=-90.8kJ/mol,
CH3OH(g) ΔH=-90.8kJ/mol,
CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.3kJ/mol
CO(g)+H2O(g) ΔH=+41.3kJ/mol
请写出由CO2和H2制取甲醇的热化学方程式______________ 。
(2)已知合成氨的反应为:N2+3H2 2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
①图中代表反应在恒容绝热容器中进行的曲线是________ (用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=_____________ 。
③b容器中M点,v(正)________ v(逆)(填“大于”、“小于”或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为________ ;标准状况下,当阴极收集到11.2LN2时,理论上消耗NH3的体积为_____________ 。
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中c(NH4+)____ c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O NH3•H2O+H2CO3的平衡常数K=
NH3•H2O+H2CO3的平衡常数K=_______ 。
(已知常温下NH3•H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7, K2=4×10-11)
(1)通过下列反应可以制备甲醇:
CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.8kJ/mol,
CH3OH(g) ΔH=-90.8kJ/mol,CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.3kJ/mol
CO(g)+H2O(g) ΔH=+41.3kJ/mol请写出由CO2和H2制取甲醇的热化学方程式
(2)已知合成氨的反应为:N2+3H2
 2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题: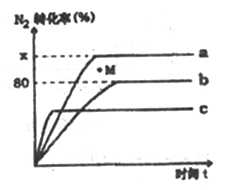
①图中代表反应在恒容绝热容器中进行的曲线是
②曲线a条件下该反应的平衡常数K=
③b容器中M点,v(正)
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中c(NH4+)
 NH3•H2O+H2CO3的平衡常数K=
NH3•H2O+H2CO3的平衡常数K=(已知常温下NH3•H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7, K2=4×10-11)
您最近一年使用:0次
2017-04-23更新
|
593次组卷
|
2卷引用:陕西省西北工业大学附属中学2022-2023学年高二上学期1月期末考试化学试题



