1 . 按图所示装置进行实验(C1、C2为石墨棒),并回答下列问题:
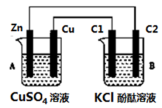
(1)判断装置的名称:A池为___________ ,B池为___________ 。
(2)锌极为___________ 极,电极反应式为___________ ;石墨棒C1为___________ 极,电极反应式为___________ ;
(3)当C2极析出标况下224 mL气体时,锌的质量变化值为___________ 克。

(1)判断装置的名称:A池为
(2)锌极为
(3)当C2极析出标况下224 mL气体时,锌的质量变化值为
您最近一年使用:0次
名校
解题方法
2 . 某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。
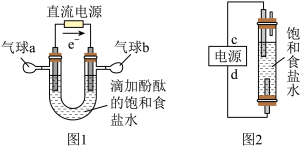
(1)图 1 中,电解一段时间后,气球 b 中的气体是___ (填化学式),U 形管___ (填“左”或“右”)边的溶液变红。
(2)利用图 2 制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则 c 为电源的_____ 极;该发生器中反应的总离子方程式为_____ 。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能 30%以上。该工艺的相关物质运输与转化关系如图 3 所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
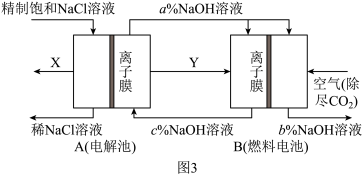
燃料电池 B 中的电极反应式分别为负极_____ , 正极____ 。

(1)图 1 中,电解一段时间后,气球 b 中的气体是
(2)利用图 2 制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则 c 为电源的
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能 30%以上。该工艺的相关物质运输与转化关系如图 3 所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

燃料电池 B 中的电极反应式分别为负极
您最近一年使用:0次
2021-03-26更新
|
218次组卷
|
4卷引用:浙江省湖州市德清县第三中学2020-2021学年高二下学期返校考试化学试题
浙江省湖州市德清县第三中学2020-2021学年高二下学期返校考试化学试题黑龙江省齐齐哈尔市第八中学2020-2021学年高二上学期期中考试化学试题(已下线)练习9 电解池-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)黑龙江省友谊县高级中学2022-2023学年高二上学期期末考试(新教材)化学试题
解题方法
3 . 电化学降解治理水中硝酸盐的污染,在酸性条件下,电解的原理如图所示
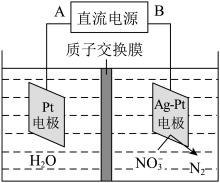
(1)A极为________ 极;
(2)阴极电极反应式为_________________ 。

(1)A极为
(2)阴极电极反应式为
您最近一年使用:0次
名校
4 . 知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。

(1)图1中,电解一段时间后,气球b中的气体是__________ (填化学式),U形管________ (填“左”或“右”)边的溶液变红。
(2)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则c为电源的________ 极;该发生器中反应的总离子方程式为_______________________________ 。
(3)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。下图是目前已开发出用电解法制取ClO2的新工艺。
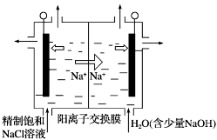
①阳极产生ClO2的电极反应式:__________________________________________________ 。
②当阴极产生标准状况下112 mL气体时,通过阳离子交换膜的离子物质的量为________ 。

(1)图1中,电解一段时间后,气球b中的气体是
(2)利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则c为电源的
(3)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。下图是目前已开发出用电解法制取ClO2的新工艺。

①阳极产生ClO2的电极反应式:
②当阴极产生标准状况下112 mL气体时,通过阳离子交换膜的离子物质的量为
您最近一年使用:0次
2018-11-04更新
|
713次组卷
|
10卷引用:浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题
浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题吉林省舒兰市第一高级中学2018-2019学年高二上学期期中考试化学试题吉林省舒兰市一中2018-2019学年高二上学期期中考试化学试题黑龙江省哈尔滨市第一中学校2021届高三上学期开学测试化学试题(已下线)第21讲 电解池 金属的电化学腐蚀与防护 (精练)-2021年高考化学一轮复习讲练测新疆伊犁奎屯市第一高级中学2020-2021学年高二上学期期末考试化学试题(已下线)第四章 化学反应与电能(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)黑龙江省哈尔滨市第六中学2020-2021学年高二下学期开学考试化学试题【石家庄新东方】2021-2022石家庄23中高二10月月考化学试题江苏省盐城市伍佑中学2021-2022学年高二下学期第一次阶段考试化学试题
名校
解题方法
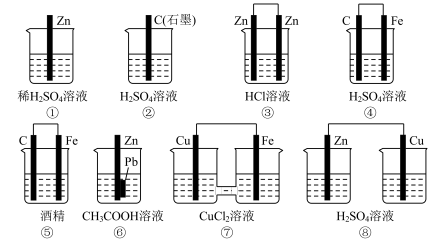
5 . (1)在下图的8个装置中,属于原电池的是____________ 。
(2)依据氧化还原反应:2Ag+(aq)+Zn(s)===Zn2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
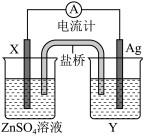
①电极X的材料是______ ;电解质溶液Y是________ ;
②银电极为电池的______ 极,发生的电极反应为__________________ ;
(3)航天飞机常采用燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能。如图是甲烷燃料电池原理示意图,回答下列问题:
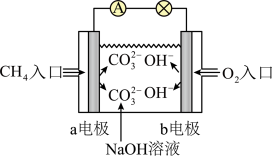
①电池的负极是____ (填“a”或“b”),该极的电极反应是____________ 。
②消耗标准状况下5.6 L O2时,有____ mol电子发生转移。
③开始放电时,正极附近溶液的pH__________ (填“增大”“减小”或“不变”)
④以铜为电极,用此电池作电源,电解以下溶液,开始阶段发生反应Cu+2H2O===Cu(OH)2+H2↑的有______________ 。
A.稀H2SO4 B.NaOH溶液 C.Na2SO4溶液
D.CuSO4溶液 E.NaCl溶液

(2)依据氧化还原反应:2Ag+(aq)+Zn(s)===Zn2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

①电极X的材料是
②银电极为电池的
(3)航天飞机常采用燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能。如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是
②消耗标准状况下5.6 L O2时,有
③开始放电时,正极附近溶液的pH
④以铜为电极,用此电池作电源,电解以下溶液,开始阶段发生反应Cu+2H2O===Cu(OH)2+H2↑的有
A.稀H2SO4 B.NaOH溶液 C.Na2SO4溶液
D.CuSO4溶液 E.NaCl溶液
您最近一年使用:0次
2018-06-26更新
|
224次组卷
|
2卷引用:浙江省诸暨市牌头中学2017-2018学年高一下学期期中考试(A)化学试题
10-11高二下·浙江杭州·期中
名校
6 . (1)已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是____________________________________ 。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%〜30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式是_________________________ ;
负极的电极反应式是_________________________ 。
(3)右图是一个电解过程示意图。
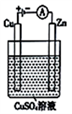
①锌片上发生的电极反应式是______________________ 。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________ L(假设空气中氧气体积分数为20%)。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%〜30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式是
负极的电极反应式是
(3)右图是一个电解过程示意图。

①锌片上发生的电极反应式是
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气
您最近一年使用:0次
2017-09-02更新
|
173次组卷
|
9卷引用:2010—2011学年浙江省杭州外国语学校高二年级下学期期中考试化学试卷
(已下线)2010—2011学年浙江省杭州外国语学校高二年级下学期期中考试化学试卷浙江省温州市求知中学2018-2019学年高二上学期期中考试(选考)化学试题(已下线)2012届山东省实验中学髙三第一次诊断性考试化学试卷山东省寿光现代中学2017-2018学年高二上学期开学考试化学试题陕西省渭南市尚德中学2017-2018学年高二第一次教学质量检测化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高二上学期期末考试化学试题(已下线)第四章 检测-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)福建省永安市第一中学2020-2021学年高二上学期第一次月考化学试题福建省三明市尤溪县第五中学2021-2022学年高二上学期第一次月考化学试题
填空题
|
适中(0.65)
|
名校
7 . 氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_______________ 。
(2)氨是制备氮肥、硝酸等的重要原料②③
①已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g) 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g) 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式________________ 。
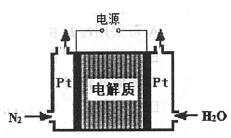
②某电解法制氨的装置如右图所示,电解质只允许质子通过,试写出阴极的电极反应式__________ 。
(3)反应:2NO(g)+O2(g) 2NO2(g)△H<0是制备硝酸过程中的一个反应。
2NO2(g)△H<0是制备硝酸过程中的一个反应。
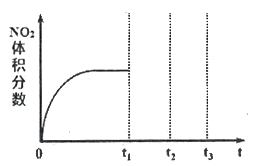
①将NO和O2按物质的量之比为2:1置于恒温恒容密闭容器中进行上述反应,得到NO2体积分数与时间的关系如下图所示。保持其它条件不变,t1时再向容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2时再次达到平衡,请画出tl-t3时间范围内NO2体积分数随时间的变化曲线:____________ 。
②在研究此反应速率与温度的关系时发现,NO转化成NO2的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I 2NO(g) N2O2(g) △H<0
N2O2(g) △H<0
II N2O2(g)+O2(g) 2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO转化成NO2的速率减慢的可能原因________ 。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下0.lmol/L的CH3COONH4溶液中,(CH3COO-):c(NH3·H2O)=________________ 。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式
(2)氨是制备氮肥、硝酸等的重要原料②③
①已知:N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/molN2(g)+O2(g)
 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol2H2(g)+O2(g)
 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol试写出表示氨的标准燃烧热的热化学方程式
②某电解法制氨的装置如右图所示,电解质只允许质子通过,试写出阴极的电极反应式
(3)反应:2NO(g)+O2(g)
 2NO2(g)△H<0是制备硝酸过程中的一个反应。
2NO2(g)△H<0是制备硝酸过程中的一个反应。①将NO和O2按物质的量之比为2:1置于恒温恒容密闭容器中进行上述反应,得到NO2体积分数与时间的关系如下图所示。保持其它条件不变,t1时再向容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2时再次达到平衡,请画出tl-t3时间范围内NO2体积分数随时间的变化曲线:
②在研究此反应速率与温度的关系时发现,NO转化成NO2的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I 2NO(g)
 N2O2(g) △H<0
N2O2(g) △H<0II N2O2(g)+O2(g)
 2NO2(g) △H<0
2NO2(g) △H<0已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO转化成NO2的速率减慢的可能原因
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下0.lmol/L的CH3COONH4溶液中,(CH3COO-):c(NH3·H2O)=
您最近一年使用:0次
2017-03-11更新
|
965次组卷
|
3卷引用:2017届浙江省稽阳联谊学校高三3月选考化学试卷
15-16高三·江苏·阶段练习
名校
解题方法
8 . 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。

(1)若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式:__________________________________ 。
②若在标准状况下有2.24 L NO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为__ mol。
(2)某小组在右室装有10 L 0.2 mol·L−1硝酸溶液,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。
①实验前,配制10 L 0.2 mol·L−1硝酸溶液需量取____ mL、密度为1.4 g·mL−1、质量分数为63%的浓硝酸。
②电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 mol HNO3、0.1 mol HNO2,同时左室收集到标准状况下28 L H2。计算原气体中NO和NO2的体积比___ (假设尾气不含氮氧化物,写出计算过程)。

(1)若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式:
②若在标准状况下有2.24 L NO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为
(2)某小组在右室装有10 L 0.2 mol·L−1硝酸溶液,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。
①实验前,配制10 L 0.2 mol·L−1硝酸溶液需量取
②电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 mol HNO3、0.1 mol HNO2,同时左室收集到标准状况下28 L H2。计算原气体中NO和NO2的体积比
您最近一年使用:0次
2016-12-09更新
|
352次组卷
|
6卷引用:考点10 电解原理 金属的腐蚀与防护——备战2019年浙江新高考化学考点
(已下线)考点10 电解原理 金属的腐蚀与防护——备战2019年浙江新高考化学考点2016届江苏省苏中三市高三第二次调研测试化学试卷2015-2016学年江苏省扬州中学高二下期中化学试卷2016届江苏省南通市高三下学期第三次教学调研化学试卷2015-2016学年河北省定州中学高二下期中化学试卷辽宁省 丹东市第二中学、大石桥第三高级中学2023-2024学年高二上学期期末化学模拟试卷
10-11高二下·浙江杭州·期中
9 . 如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色。试回答以下问题:
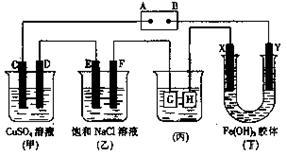
(1)电源A极的名称是__________ 。
(2)甲装置中电解反应的总化学方程式是____________ 。
(3)如果收集乙装置中产生的气体,两种气体的体积比是___________ 。
(4)欲用丙装置给铜镀银,G应该是_______ ,电镀液的主要成分是_________ (填化学式)。

(1)电源A极的名称是
(2)甲装置中电解反应的总化学方程式是
(3)如果收集乙装置中产生的气体,两种气体的体积比是
(4)欲用丙装置给铜镀银,G应该是
您最近一年使用:0次
10-11高二下·浙江杭州·期中
10 . 工业上采用Fe、C为电极电解K2MnO4溶液制KMnO4.
(1)电解时,应以_________ 作阴极,电解过程中阴极附近溶液pH将会__________
(2)阳极反应式为_________________ (3)总电解反应式为_______________
(1)电解时,应以
(2)阳极反应式为
您最近一年使用:0次



