10-11高二上·福建·阶段练习
名校
1 . 图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )
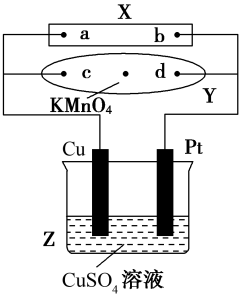

| A.滤纸上c点附近会变红色 |
| B.Cu电极质量减小,Pt电极质量增大 |
| C.Z中溶液的pH先减小,后增大 |
| D.溶液中的SO42-向Cu电极定向移动 |
您最近一年使用:0次
2020-03-19更新
|
478次组卷
|
19卷引用:吉林省通化市辉南县第六中学2023-2024学年高二上学期11月半月考化学试卷
吉林省通化市辉南县第六中学2023-2024学年高二上学期11月半月考化学试卷 (已下线)2010年福建省四地六校联考高二上学期第三次月考化学试卷(已下线)2014高考化学二轮复习限时集训 专题9电化学原理练习卷B(已下线)2014年化学高考总复习课时演练9-2电解池金属电化学腐蚀与防护练习卷(已下线)2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(已下线)2014届广西南宁二中玉林高中高三9月理科综合化学试卷2017届山东省枣庄三中高三上10月学情调查化学试卷河北省邯郸市成安县第一中学2017-2018学年高二9月月考化学试题山东省济南市第一中学2017-2018学年高二10月阶段测试化学试题(已下线)解密09 电化学(教师版)——备战2018年高考化学之高频考点解密山西省应县第一中学2018-2019学年高二上学期第四次月考化学试题浙江省诸暨中学2019-2020学年高二上学期10月阶段性考试化学试题贵州省长顺县二中2019-2020学年高二上学期期末考试化学试题福建省安溪一中2020年高一实验班线上阶段测试化学试题云南省云天化中学2019-2020学年高二下学期开学考试化学试题(已下线)专题4.3.1 电解原理-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)第四章 电化学基础(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)4.3.1 电解原理(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)江苏省苏州市相城区陆慕高级中学2021-2022学年高二上学期第一次月考化学试题
名校
解题方法
2 . 已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO( CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是
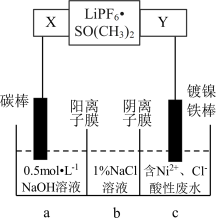

| A.电极Y应为Li |
| B.电解过程中,b中NaCl溶液的物质的量浓度将不断减小 |
| C.X极反应式为FeS+2Li++2e-=Fe+Li2S |
| D.若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变 |
您最近一年使用:0次
2020-01-15更新
|
557次组卷
|
17卷引用:吉林省辽源市第五中学2016-2017学年高二下学期第二次月考化学试题
吉林省辽源市第五中学2016-2017学年高二下学期第二次月考化学试题山西省山西大学附属中学2017届高三下学期3月模块诊断理科综合化学试题【全国百强校】湖北省沙市中学2018届高三高考冲刺考试理综化学试题【全国百强校】山东省济南外国语学校2019届高三上学期高考模拟(二)理科综合化学试题【全国百强校】广东省深圳市高级中学2019届高三上学期12月模拟考试化学试题西藏自治区林芝二高2019届高三上学期第四次月考化学试题【全国百强校】山东省山东师范大学附属中学2019届高三上学期第五次模拟考试化学试题【全国百强校】河南省南阳市第一中学2019届高三第九次考试理综化学试题【市级联考】湖北省宜昌市2019届高三上学期元月调考理科综合化学试题【市级联考】湖南省长沙市长望刘宁四区县2019届高三模拟考试(3月)理综化学试题【全国百强校】山东省济南外国语学校2019届高三下学期第一次模拟考试化学试题天津市南开中学2019届高三下学期模拟考试理科综合化学试题2020届人教版高三化学二轮复习选择题专攻练——电化学江西省新余市2020届高三上学期第四次月考理综化学试题四川省成都龙泉第二中学2021届高三上学期九月月考化学试题河南省南阳市第一中学校2022届高三上学期第一次月考化学试题重庆市凤鸣山中学2022-2023学年高三上学期半期检测化学试题
名校
3 . 某充电宝锂离子电池的总反应为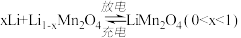 。某手机镍氢电池总反应为
。某手机镍氢电池总反应为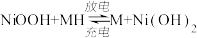 (M为储氢金属或合金),有关上述两种电池的说法错误的是
(M为储氢金属或合金),有关上述两种电池的说法错误的是
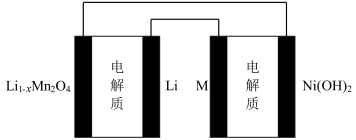
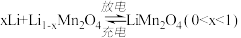 。某手机镍氢电池总反应为
。某手机镍氢电池总反应为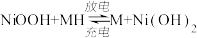 (M为储氢金属或合金),有关上述两种电池的说法错误的是
(M为储氢金属或合金),有关上述两种电池的说法错误的是
| A.锂离子电池放电时,Li+移向正极 |
| B.如图表示用锂离子电池给镍氢电池充电 |
C.锂离子电池充电时,阴极的电极反应式: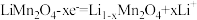 |
D.镍氢电池放电时,正极的电极反应式: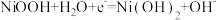 |
您最近一年使用:0次
2019-12-23更新
|
213次组卷
|
11卷引用:吉林省白城市第一中学2018-2019学年高二上学期第一次月考化学试题
吉林省白城市第一中学2018-2019学年高二上学期第一次月考化学试题2015届浙江省温州市高三一模理综化学试卷2016届河南省信阳市高三上学期期末质检化学试卷【全国省级联考】辽宁省部分重点高中2019届高三9月联考化学试题【全国百强校】河南省新乡市三校联考2019届高三上学期第二次月考化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高一下学期第二次考试化学试题河南省实验中学2019-2020学年高二10月月考化学试题步步为赢 高二化学寒假作业:作业十二 原电池原理及其应用山东省实验中学2020届高三上学期第二次诊断考试化学试题(已下线)1.2.3 电解池的工作原理及应用(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)福建省福州市第十一中学2020-2021学年高二上学期期中质量检测化学试题
名校
解题方法
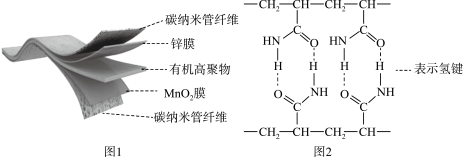
4 . 某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:MnO2+ Zn+(1+
Zn+(1+ ) H2O+
) H2O+ ZnSO4
ZnSO4 MnOOH+
MnOOH+ ZnSO4[Zn(OH)2]3·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]3·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。
下列说法中,不正确 的是
 Zn+(1+
Zn+(1+ ) H2O+
) H2O+ ZnSO4
ZnSO4 MnOOH+
MnOOH+ ZnSO4[Zn(OH)2]3·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]3·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。
下列说法中,
| A.碳纳米管具有导电性,可用作电极材料 |
B.合成有机高聚物的单体是: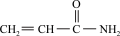 |
| C.充电时,Zn2+移向Zn膜 |
| D.放电时,电池的正极反应为:MnO2 + e− + H+ = MnOOH |
您最近一年使用:0次
2019-12-20更新
|
294次组卷
|
4卷引用:吉林省大安一中2019-2020学年高三上学期第四次月考化学试题
吉林省大安一中2019-2020学年高三上学期第四次月考化学试题【区级联考】北京市市昌平区2019届高三下学期二模考试化学试题北京市海淀区中关村中学2020届高三三模化学试题(已下线)第六章 化学反应与能量 第36练 新型化学电源
14-15高二上·黑龙江哈尔滨·阶段练习
名校
解题方法
5 . 有关甲、乙、丙、丁四个图示的叙述正确的是( )
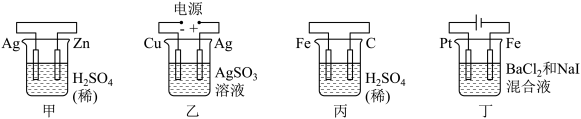

| A.甲中负极反应式为2H++2e-=H2↑ |
| B.乙中阳极反应式为Ag++e-=Ag |
| C.丙中H+向碳棒方向移动 |
| D.丁中电解开始时阳极产生黄绿色气体 |
您最近一年使用:0次
2019-11-29更新
|
573次组卷
|
16卷引用:吉林省白城市第一中学2019-2020学年高二上学期期中考试化学试题
吉林省白城市第一中学2019-2020学年高二上学期期中考试化学试题(已下线)2014-2015学年黑龙江省哈尔滨市第六中学高二10月月考化学试卷2015-2016学年河北省沧州一中高一下期末化学试卷河北省迁西县第一中学2019-2020学年高二10月月考化学试题福建省平和一中、南靖一中等五校2019-2020学年高二年上学期期中联考化学试题福建省漳州市第八中学2019-2020学年高二上学期期中考试化学试题(已下线)考点10 电解原理及应用——《备战2020年高考精选考点专项突破题集》(已下线)考点11 电化学综合——《备战2020年高考精选考点专项突破题集》甘肃省西北师范大学附属中学2019-2020学年高二上学期期中考试化学试题新疆哈密市第八中学2020-2021学年高二上学期期末考试化学试题陕西省榆林市第十二中学2021-2022学年高二上学期教学质量摸底评估化学试题甘肃省张掖市2021-2022学年高二上学期期末学业水平质量检测化学试题山东师范大学附属中学2022-2023学年高二上学期第一次月考化学试题山东省2022-2023学年高二上学期学业水平测试化学试题黑龙江省哈尔滨市阿城区第一中学校2022-2023学年高二11月阶段性检测化学试题北京市第五十中学2023-2024学年高二上学期期中考试化学试题
名校
6 . 某同学设计一个电池(如图所示),探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

(1)通入氢气的电极为________ (填正极或负极),该电极反应式为________ 。
(2)石墨电极为________ (填阳极或阴极),乙中总反应离子方程式为________ ;如果把铁电极和石墨电极交换,乙溶液左侧出现的现象是__________________________________ 。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________ (填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01mol O2,丙中精铜增重_________ 克。

(1)通入氢气的电极为
(2)石墨电极为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若甲中消耗0.01mol O2,丙中精铜增重
您最近一年使用:0次
2019-11-21更新
|
1092次组卷
|
5卷引用:吉林省长春市实验中学2019-2020学年高二上学期期中考试化学试题
吉林省长春市实验中学2019-2020学年高二上学期期中考试化学试题湖南省长郡中学2019-2020学年高二上学期第三次月考化学试题广东省湛江市2019-2020学年高二上学期期末考试化学试题(已下线)第04章 电化学基础(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)陕西省延安市第一中学2021-2022学年高一下学期第二次月考化学试题
9-10高一下·浙江·期中
名校
7 . 下图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
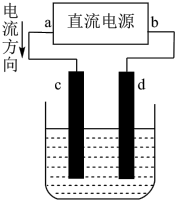

| A.a为负极,b为正极 | B.a为阳极,b为阴极 |
| C.电解过程中,d电极质量增加 | D.电解过程中,氯离子浓度不变 |
您最近一年使用:0次
2019-11-17更新
|
1863次组卷
|
101卷引用:2012届吉林省长春市高三第一次调研测试化学试卷
(已下线)2012届吉林省长春市高三第一次调研测试化学试卷【全国百强校】吉林省长春市外国语学校2018-2019学年高二上学期期末考试化学试题吉林省长春市第二实验中学2021-2022学年高二上学期10月月考化学试题吉林省洮南市第一中学2022-2023学年高二上学期期末考试化学试题(已下线)2010年浙江省浙东北三校高一第二学期期中联考化学试题(已下线)2010年江苏省盐城中学高一下学期期末考试化学试题(已下线)2010年江苏省南洋中学高一下学期期末考试化学试题(已下线)2010年江苏省文峰中学高一下学期期末考试化学试题(已下线)2010—2011学年河北省保北十二县市高一下学期期中联考化学试卷(已下线)2010—2011浙江省嘉兴一中高一下学期期中考试化学试卷(已下线)2010-2011学年河南省驻马店市文成中学十校联合体高一下学期期中联考化学试卷(已下线)2010-2011学年河北省邯郸市高一下学期期末考试化学试卷(已下线)2010—2011学年上海交通大学附属中学高一第二学期期末化学试卷(已下线)2011-2012学年河北省唐山一中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年山东省郓城一中高二上学期模块考试化学试卷(已下线)2011-2012学年山东省鄄城县第一中学高二上学期期中考试化学试卷(已下线)2011-2012学年山东省日照一中高二上学期期中考试化学(理)试卷(已下线)2011-2012年浙江永嘉县普高联合体高一下学期期中联考化学试卷(已下线)2011-2012年浙江温州龙湾中学高一期中考试文科化学试卷(已下线)2011-2012学年河北省保定三中高一下学期期中考试化学试卷(已下线)2011-2012年江苏淮安市范集中学高二下学期期中考试化学试卷(已下线)2011-2012学年浙江省温州四中高一下学期期中考试化学试卷(已下线)2012年苏教版高中化学必修2 2.3化学能与电能的转化练习卷(已下线)2012年苏教版高中化学选修4 1.2化学能与电能的转化(已下线)2012-2013学年江苏省宿迁青华中学高二下学期期中考化学普通班试卷(已下线)2012-2013学年福建省福州文博中学高一下学期期末考试化学试卷(已下线)2013-2014学年浙江省温州市十校联合体高二上学期期中联考化学试卷(已下线)2013-2014学年河南省洛阳市高二上学期期末检测化学试卷(A)(已下线)2013-2014学年江苏省沭阳县高一下学期期中调研测试化学试卷(已下线)2013-2014河北省保定市第二学期期中考试高一化学试卷(已下线)2014届山东省济南一中高二上学期期末考试化学试卷 2014-2015学年福建省清流一中高二上学期月考化学理试卷2015-2016学年陕西省西安中学高二上诊断检测化学试卷2015-2016学年安徽省阜阳市太和八中高二上学期期末理化学试卷2015-2016学年甘肃省永昌一中高二上学期期末化学试卷2015-2016学年黑龙江省海林林业局一中高二上期末考试化学试卷2015-2016学年浙江省安吉县上墅私立高中高一下期中化学试卷2015-2016学年陕西省黄陵中学高一下学期期末化学试卷2015-2016学年青海省平安一中高二下期末化学试卷2015-2016学年河北省唐山市开滦一中高一下期末文科化学试卷2015-2016学年福建省福州市文博中学高二上期中化学试卷2015-2016学年陕西省延安市黄陵中学高二下期末化学试卷2016-2017学年山东省德州市陵城一中高二上10月月考化学试卷2016-2017学年黑龙江哈尔滨三中高二上期中理化学试卷2016-2017学年江苏省沭阳县高二下学期期中调研测试化学试卷河北省馆陶县第一中学2016-2017学年高一下学期期中考试化学试题福建省师范大学附属中学2016-2017学年高一(美术班)下学期期末考试化学试题辽宁省庄河市高级中学2017-2018学年高二上学期开学考试化学试题山东省枣庄市第八中学南校区高二10月份月考化学试题福建省东山第二中学2017-2018学年高二上学期期中考试化学试题福建省诗山县2017-2018学年高二上学期期中化学试题上海市金山区2018届高三一模化学试题高中化学人教版 选修四 第四章 电化学基础 第三节 电解池 电解池第一课时(电解原理)河南省信阳市2017-2018学年高二上学期期末测试化学试题浙江省杭州市西湖高级中学2017-2018学年高二12月月考化学试题浙江省温州市求知中学2018-2019学年高二上学期期中考试(选考)化学试题【全国百强校】四川省棠湖中学2018-2019学年高二下学期开学考试化学试题【区级联考】上海市黄浦区2019届高三第一学期期末(一模)学科质量检测化学试题海南省海口第四中学2018-2019学年高二下学期第一次月考化学试题【校级联考】江苏省常州“教学研究合作联盟”2018-2019学年高二下学期期中考试化学试题甘肃省临夏中学2018-2019学年高二下学期期中考试化学试题上海市金山区2018届高三上学期期末质量监控化学试题河北省唐山市第十一中学2019-2020学年高二上学期期中考试化学(理)试题河北省石家庄市六校2019-2020学年高二上学期期中考试化学试题(已下线)2019年11月29日《每日一题》人教版(选修4)—— 电解原理福建省厦门市湖滨中学2019-2020学年高二上学期期中考试化学(合格考)试题山东省德州市夏津县双语中学2019-2020学年高二上学期第二次月考化学试题甘肃省白银市会宁县第四中学2019-2020学年高二上学期期末期末考试化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题辽宁省丹东市2019-2020学年高二上学期期末质量监测化学试题上海市闵行区向明世博中学2018-2019学年高二上学期期中考试化学试题上海市位育中学2017-2018学年高三上学期期中考试化学试题河北省易县中学2019-2020学年高一4月线上考试(A部)化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第3节 电能转化为化学能——电解云南省保山市第九中学2020-2021学年高二上学期质量检测化学试题上海市行知中学2019-2020学年高三上学期期中考化学试题人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第二节 电解池 教材帮鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第3节 电能转化为化学能——电解 高效手册人教版(2019)高二化学选择性必修1第四章 化学反应与电能 第二节 电解池 课时1 电解原理安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题青海省北外附属西宁新华联国际学校2020-2021学年高二上学期期末考试化学试题高中化学苏教2019版必修第二册-专题6 第三单元 第2课时 化学电源海南省三亚华侨学校(南新校区)2020-2021学年高二下学期开学考试化学试题青海省西宁市普通高中五校2020-2021学年高二上学期期末联考化学试题江苏省宿迁市沭阳县潼阳中学2020-2021学年高二下学期第一次月考化学试题广西岑溪市2020-2021学年高一下学期期末考试化学(理)试题选择性必修1(SJ)专题1第二单元课时3 电解池的工作原理西藏自治区拉萨市那曲第二高级中学2018-2019学年高二下学期期中考试化学试题西藏林芝市第一中学2020-2021学年高二上学期期末考试化学试题上海市宝山区2021-2022学年高三年级下学期等级考测化学试题上海市宝山区2022届高三年级下学期二模考试化学试题江苏省淮安市涟水县第一中学2021-2022学年高二下学期第一次阶段检测化学试题福建省南安市柳城中学2021-2022学年高二上学期期中考试化学试题四川省凉山州宁南中学2022-2023学年高二上学期期末考试化学试题陕西省西安市第八十九中学2022-2023学年高二上学期期末考试化学试题上海市青浦区2022-2023学年高三上学期一模练习卷化学试题1.2.3电解池的工作原理和应用 课中第1课时 电解原理第1课时 电解的原理贵州省龙里中学2022-2023学年高二上学期11月期中考试化学试题上海市洋泾中学2023-2024学年高三上学期开学考化学试题
名校
解题方法
8 . (1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式___ 。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。

①b点时,平衡体系中C、N原子个数之比接近___ ;
②a、b、c三点CO的转化率从大到小的顺序为___ ;a、c、d三点的平衡常数从大到小的顺序为___ 。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为__ 。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为____ (填化学式);A电极的电极反应式为____ ;一段时间后,若乙中需加0.2molCu(OH)2使溶液复原,则转移的电子数为___ 。
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为____ ,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液呈___ (填“酸性”“碱性”或“中性”)。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
2019-10-31更新
|
229次组卷
|
2卷引用:吉林省吉林市2020届高三第三次调研测试(4月) 理综化学试题
2016高二·全国·课后作业
名校
9 . 某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应式如下,以下说法不正确的是( )
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
| A.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 |
| B.放电时正极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH- |
| C.放电时负极反应式为Zn-2e-+2OH-=Zn(OH)2 |
| D.充电时阳极附近的溶液的碱性减弱 |
您最近一年使用:0次
2019-10-20更新
|
138次组卷
|
9卷引用:吉林省长春市博硕学校(原北京师范大学长春附属学校)2022-2023学年高二上学期期中化学试题
吉林省长春市博硕学校(原北京师范大学长春附属学校)2022-2023学年高二上学期期中化学试题(已下线)同步君 选修4 第4章 第2节 化学电源山东省枣庄市第三中学2017-2018学年高二10月质量检测化学试题高中化学人教版 选修四 第四章 电化学基础 第二节 化学电源 化学电源福建省厦门市湖滨中学2017-2018学年高二下学期第一次月考化学试题山东省泰安市宁阳县第一中学2019-2020学年高二上学期第一次段考化学试题四川省新津中学2019-2020学年高二下学期4月月考(入学)化学试题(已下线)课时32 可充电电池装置-2022年高考化学一轮复习小题多维练(全国通用)云南省大理白族自治州实验中学2021-2022学年高二上学期10月月考化学试题
名校
10 . 《Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是


| A.b为电源的正极 |
| B.电子流向:c→a→b→d |
| C.c极电极反应式为2C2O52――4e-=4CO2+O2 |
| D.转移0.4mol电子可捕获CO2 2.24L |
您最近一年使用:0次
2019-09-06更新
|
145次组卷
|
2卷引用:辽源市第五中学2019-2020学年高一下学期第二次月考化学试题



