名校
解题方法
1 . 下图是一套模拟工业生产的电化学装置。丙装置中两电极均为惰性电极,电解质溶液为KCl溶液,不考虑气体溶解,且钾离子交换膜只允许钾离子通过。下列说法正确的是
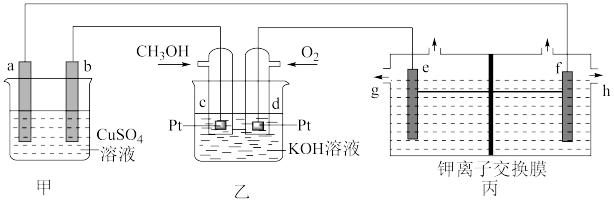

| A.若甲装置中a、b均为惰性电极,一段时间后,两极均有气体产生,则加入CuO一定能使溶液复原 |
| B.若甲装置中b为精铜,a为镀件,则可实现a上镀铜 |
| C.丙装置可以制取KOH溶液,制得的KOH可以通过g口排出 |
| D.当d电极消耗标准状况下1.12LO2时,丙装置中阳极室溶液质量减少14.9g |
您最近一年使用:0次
2021-07-20更新
|
1166次组卷
|
5卷引用:黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题
黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题重庆西南大学附属中学校2020-2021学年高二下学期期末考试化学试题(已下线)1.2.3 电解池的工作原理及应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)山东省烟台市福山区第一中学2021-2022学年高三上学期9月月考化学试题.四川省泸州市泸县第五中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
2 . 为了探究原电池和电解池的工作原理,某研究性学习小组分别用如图所示的装置进行实验,回答下列问题。
Ⅰ.用甲装置进行第一组实验:
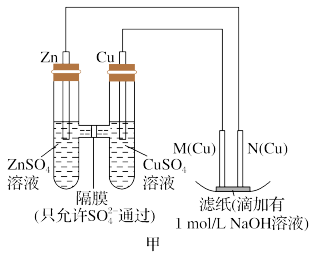
(1)在保证电极反应不变的情况下,下列材料不能代替插入硫酸铜溶液中的Cu电极的是___________ (填序号)。
A.石墨 B.镁 C.银 D.铂
(2)实验过程中,SO (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有
(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有___________ 。
Ⅱ.该小组同学用乙装置进行第二组实验时发现,两极均有气体产生,Y极溶液逐渐变成紫红色,停止实验后观察到铁电极明显变细,电解液仍澄清。查阅资料知,高铁酸根离子(FeO )在溶液中呈紫红色。请根据实验现象及所查信息,填写下列空白:
)在溶液中呈紫红色。请根据实验现象及所查信息,填写下列空白:
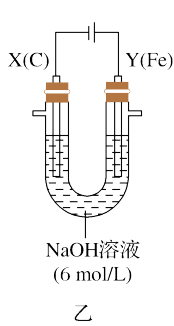
(3)电解过程中,X极溶液的pH___________ (填“增大”、“减小”或者“不变”)。
(4)电解过程中,Y极发生的电极反应为___________ 和___________ 。
(5)另一小组同学将乙装置中6 mol/L NaOH溶液换成1 mol/L NaCl溶液,发现铁电极附近逐渐变成浅绿色,该小组同学认为铁电极附近溶液中生成了Fe2+,为了验证这一猜测,应使用___________ (填试剂名称)来检验,现象为___________ ,则证明该小组同学猜想正确。
(6)下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。
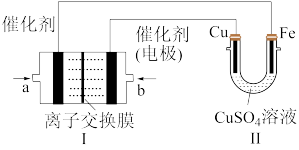
①该同学想在Ⅱ中实现铁上镀铜,a处电极上发生的电极反应为___________ 。
②Ⅱ中电解前CuSO4溶液的浓度为3 mol/L,若维持电流强度为1 A,电池工作十分钟,理论上消耗Ⅰ中的CH4___________ g(计算结果保留两位有效数字,已知F=96500 C·mol-1),此时电解池中CuSO4溶液的浓度为___________ 。
Ⅰ.用甲装置进行第一组实验:

(1)在保证电极反应不变的情况下,下列材料不能代替插入硫酸铜溶液中的Cu电极的是
A.石墨 B.镁 C.银 D.铂
(2)实验过程中,SO
 (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有
(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有Ⅱ.该小组同学用乙装置进行第二组实验时发现,两极均有气体产生,Y极溶液逐渐变成紫红色,停止实验后观察到铁电极明显变细,电解液仍澄清。查阅资料知,高铁酸根离子(FeO
 )在溶液中呈紫红色。请根据实验现象及所查信息,填写下列空白:
)在溶液中呈紫红色。请根据实验现象及所查信息,填写下列空白:
(3)电解过程中,X极溶液的pH
(4)电解过程中,Y极发生的电极反应为
(5)另一小组同学将乙装置中6 mol/L NaOH溶液换成1 mol/L NaCl溶液,发现铁电极附近逐渐变成浅绿色,该小组同学认为铁电极附近溶液中生成了Fe2+,为了验证这一猜测,应使用
(6)下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。

①该同学想在Ⅱ中实现铁上镀铜,a处电极上发生的电极反应为
②Ⅱ中电解前CuSO4溶液的浓度为3 mol/L,若维持电流强度为1 A,电池工作十分钟,理论上消耗Ⅰ中的CH4
您最近一年使用:0次
名校
解题方法
3 . 某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)乙池为___________ (填“原电池”“电解池”“电镀池”),A电极的电极反应式为:___________ 。
(2)丙池中F电极为___________ (填“正极”、“负极”、“阴极”或“阳极”),写出电解时总反应的离子方程式___________ 。
(3)当乙池中C极质量变化10.8 g时,甲池中B电极理论上消耗O2的体积为___________ mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是___________ (填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
(5)若丙池通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和PH(不考虑CO2的溶解),则电解过程中转移的电子___________ mol, 若电解后溶液的体积为400ml,则所得溶液中氢离子的浓度___________ 。

请回答下列问题:
(1)乙池为
(2)丙池中F电极为
(3)当乙池中C极质量变化10.8 g时,甲池中B电极理论上消耗O2的体积为
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
(5)若丙池通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和PH(不考虑CO2的溶解),则电解过程中转移的电子
您最近一年使用:0次
2021-06-17更新
|
407次组卷
|
3卷引用:黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题
4 . Ⅰ. 燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示:
燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示:
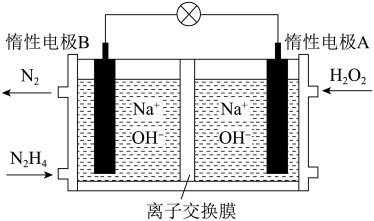
电池工作时,A极区 NaOH浓度不变,则离子交换膜为___________ (填"阳离子交换膜"或"阴离子交换膜");电极 B的电极反应式为___________ ;电池工作时参加反应的 =
=___________ (整数比)。
Ⅱ.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如图所示。
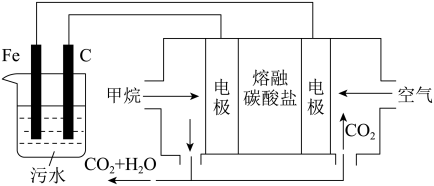
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的___________ (填选项字母)。
a.H2SO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e-=O2↑+4H+,则另一个电极反应式为___________ 。
(3)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,惰性材料为电极,正极的电极反应式为___________ 。
(4)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗标准状况下的CH4体积___________ L。
 燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示:
燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示:
电池工作时,A极区 NaOH浓度不变,则离子交换膜为
 =
=Ⅱ.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如图所示。

(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的
a.H2SO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e-=O2↑+4H+,则另一个电极反应式为
(3)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,惰性材料为电极,正极的电极反应式为
(4)实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗标准状况下的CH4体积
您最近一年使用:0次
2021-06-17更新
|
175次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2020-2021学年高一6月月考化学试题
名校
解题方法
5 . 镍镉(Ni-Cd)可充电电池在现代生活中有广应用,已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2,则下列说法正确的是
Cd(OH)2+2Ni(OH)2,则下列说法正确的是
 Cd(OH)2+2Ni(OH)2,则下列说法正确的是
Cd(OH)2+2Ni(OH)2,则下列说法正确的是| A.放电时,负极板上发生了还原反应 |
| B.放电时,正极的电极反应式为:Cd-2e-+2OH-=Cd(OH)2 |
| C.充电时,镍镉电池的正极发生了还原反应 |
| D.充电时,阳极反应的电极反应式为:Ni(OH)2+OH--e-=NiOOH+H2O |
您最近一年使用:0次
2021-05-27更新
|
252次组卷
|
2卷引用:黑龙江省大庆市铁人中学2020-2021学年高一下学期期中考试化学试题
名校
解题方法
6 . 以Na3Ti2(PO4)3为负极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是
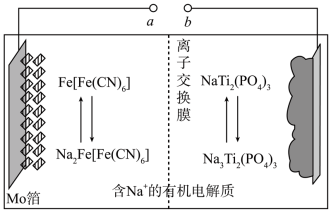

| A.放电时,正极反应式为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6] |
| B.充电时,a端接电源正极 |
| C.充电时,每生成1molFe[Fe(CN)6]消耗2molNaTi2(PO4)3 |
| D.充电时,Na+通过离子交换膜从左室移向右室 |
您最近一年使用:0次
2021-05-25更新
|
381次组卷
|
2卷引用:黑龙江省哈尔滨市第九中学2021-2022学年高三上学期期末考试理科综合化学试题
名校
解题方法
7 . 用Mg-NaClO燃料电池作电源模拟消除工业酸性废水中的 (
( 还原为Cr3+),装置如图所示,下列说法正确的是
还原为Cr3+),装置如图所示,下列说法正确的是
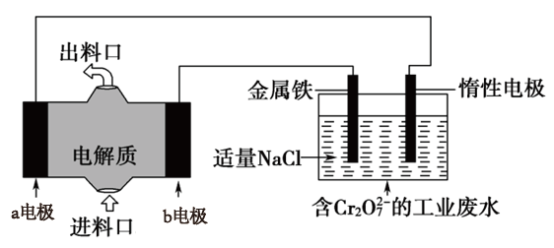
 (
( 还原为Cr3+),装置如图所示,下列说法正确的是
还原为Cr3+),装置如图所示,下列说法正确的是
| A.b电极材料为Mg,发生氧化反应 |
| B.金属铁电极反应为:Fe-3e-=Fe3+ |
| C.处理后的废水比原工业废水的pH大 |
D.装置工作过程中消耗7.2gMg,理论上消除0.lmol |
您最近一年使用:0次
2021-05-12更新
|
294次组卷
|
2卷引用:黑龙江省大庆市铁人中学2020-2021学年高一下学期期末考试化学试题
名校
解题方法
8 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
I.汽车尾气中的 NO(g)和 CO(g)在一定条件下可发生反应生成无毒的N2和 CO2:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H =-746.5 kJ/mol ①
N2(g)+2CO2(g) △H =-746.5 kJ/mol ①
(1)某研究小组在三个容积为 5 L 的恒容密闭容器中,分别充入 0.4mol NO 和 0.4 mol CO,发生反应① 。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图1所示:
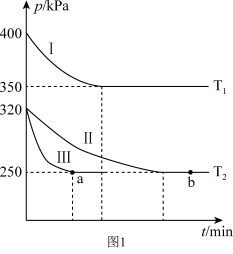
①温度:T1___________ T2(填“<”“=”或“>”)。
②CO 的平衡转化率:Ⅰ___________ Ⅱ___________ Ⅲ(填“<”“=”或“>”)。
③反应速率:a 点的 v(逆)___________ b 点的 v(正) (填“<”“=”或“>”)。
④T2时的平衡常数 Kp=___________ 。(Kp表示用平衡分压表示的平衡常数,各物质的分压=总压×各物质在混合气体中所占的物质的量分数)
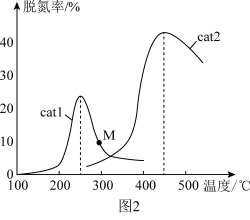
(2)将 NO和 CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即 NO的转化率)如图2所示。M 点___________ (填“是”或“不是”)对应温度下的平衡脱氮率, 说明理由___________ 。
II.将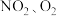 和熔融
和熔融 制成燃料电池,模拟工业电解法精炼银,装置如图3所示。
制成燃料电池,模拟工业电解法精炼银,装置如图3所示。

(3)①甲池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅱ附近发生的电极反应方程式为___________ 。
②若用10A的电流电解50min后,乙中阴极得到21.6gAg,则该电解池的电解效率为___________ %。(保留小数点后一位)。已知:通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C•mol﹣1
I.汽车尾气中的 NO(g)和 CO(g)在一定条件下可发生反应生成无毒的N2和 CO2:
2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H =-746.5 kJ/mol ①
N2(g)+2CO2(g) △H =-746.5 kJ/mol ①(1)某研究小组在三个容积为 5 L 的恒容密闭容器中,分别充入 0.4mol NO 和 0.4 mol CO,发生反应① 。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图1所示:

①温度:T1
②CO 的平衡转化率:Ⅰ
③反应速率:a 点的 v(逆)
④T2时的平衡常数 Kp=
(2)将 NO和 CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即 NO的转化率)如图2所示。M 点

II.将
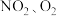 和熔融
和熔融 制成燃料电池,模拟工业电解法精炼银,装置如图3所示。
制成燃料电池,模拟工业电解法精炼银,装置如图3所示。
(3)①甲池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅱ附近发生的电极反应方程式为
②若用10A的电流电解50min后,乙中阴极得到21.6gAg,则该电解池的电解效率为
您最近一年使用:0次
名校
解题方法
9 . CO2是温室气体,CO2的利用是解决温室效应的有效途径。试回答下列问题:
I.CO2催化制CH4
在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应I CO2(g)+4H2(g) CH4(g) + 2H2O(g) △H1
CH4(g) + 2H2O(g) △H1
反应II CO2(g) + H2(g) CO(g) + H2O(g) △H2
CO(g) + H2O(g) △H2
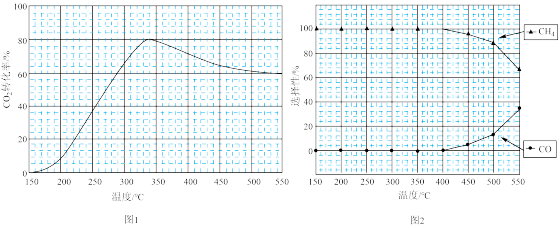
(1)①下列说法不正确的是___________
A.△H1小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
② 350℃时,反应I在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为___________ (用a、V表示)。
II.CO2电化学制CH4
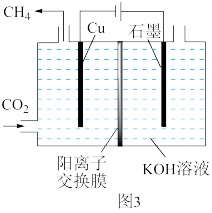
(2)图3表示以KOH溶液作电解质溶液进行电解的示意图,阴极的电极反应方程式为___________ ,电解一段时间后,阳极区KOH溶液的质量分数减小,其原因是___________ 。
(3)甲烷可以做燃料电池,具有广阔的开发和应用前景,某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验(如图4)。
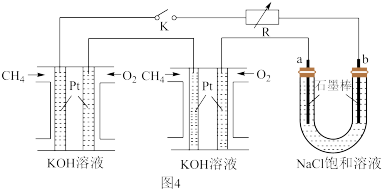
①通入甲烷气体的电极是原电池的___________ 极,其电极反应式为___________ 。
②a电极反应式为___________ 。
③如图4所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量均为22.4ml(标况),且反应完全。则理论上通过电解池的电量为___________ (单个电子的电荷量e=1.6×10-19 C,结果保留三位有效数字),若产生的气体全部逸出,电解后溶液混合均匀,温度恢复为室温,则电解后U形管中溶液的pH为___________ 。
III.CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3
(4)①Na2CO3俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式___________ 。已知25℃时, 第一步水解的水解常数Kh=2×10﹣4mol/L,当溶液中c(
第一步水解的水解常数Kh=2×10﹣4mol/L,当溶液中c( ):c(
):c( )=20:1时,溶液的pH=
)=20:1时,溶液的pH=___________ 。
I.CO2催化制CH4
在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应I CO2(g)+4H2(g)
 CH4(g) + 2H2O(g) △H1
CH4(g) + 2H2O(g) △H1反应II CO2(g) + H2(g)
 CO(g) + H2O(g) △H2
CO(g) + H2O(g) △H2
(1)①下列说法不正确的是
A.△H1小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
② 350℃时,反应I在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为
II.CO2电化学制CH4
(2)图3表示以KOH溶液作电解质溶液进行电解的示意图,阴极的电极反应方程式为

(3)甲烷可以做燃料电池,具有广阔的开发和应用前景,某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验(如图4)。

①通入甲烷气体的电极是原电池的
②a电极反应式为
③如图4所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量均为22.4ml(标况),且反应完全。则理论上通过电解池的电量为
III.CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3
(4)①Na2CO3俗称纯碱,因
 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式 第一步水解的水解常数Kh=2×10﹣4mol/L,当溶液中c(
第一步水解的水解常数Kh=2×10﹣4mol/L,当溶液中c( ):c(
):c( )=20:1时,溶液的pH=
)=20:1时,溶液的pH=
您最近一年使用:0次
名校
解题方法
10 . 利用甲醇燃料电池进行电解的装置如图1,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后断开K,此时A、B两极上生成等物质的量的气体。丙装置溶液中金属阳离子的物质的量(n)与转移电子的物质的量[n(e-)]变化关系如图2。下列说法正确的是
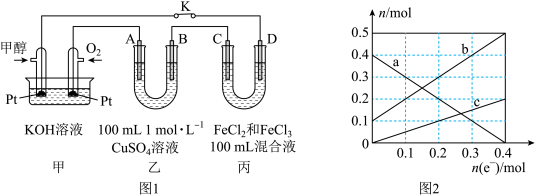

| A.甲池中负极反应为CH3OH- 6e-+ 6OH-= CO2+ 5H2O |
| B.乙池中B电极为阳极 |
| C.乙池中生成的气体在标准状况下总体积为4.48 L |
| D.图2中b线表示的丙池中Cu2+物质的量的变化 |
您最近一年使用:0次
2021-03-08更新
|
555次组卷
|
3卷引用:黑龙江省哈尔滨市哈尔滨第三中学2021届高三下学期第一次模拟考试理综化学试题
黑龙江省哈尔滨市哈尔滨第三中学2021届高三下学期第一次模拟考试理综化学试题(已下线)小题19 多池多室带膜电化学装置 ——备战2021年高考化学经典小题考前必刷(全国通用)江西省大余中学2022-2023学年高二下学期4月期中考试化学试题



