名校
解题方法
1 . 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
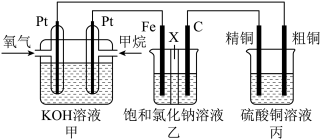
(1)甲是燃料电池,通入甲烷的电极作____ 极(填入“正”或“负”),其电极反应式为:____ 。
(2)乙是____ 池(填“原电池”或“电解池”),乙装置发生电解的总反应离子方程式为____ 。
(3)丙中粗铜作____ 极(填入“阴”或“阳”),若在标准状况下,有2.24L氧气参加反应,丙装置中析出精铜的质量为____ g。

(1)甲是燃料电池,通入甲烷的电极作
(2)乙是
(3)丙中粗铜作
您最近一年使用:0次
2022-10-24更新
|
159次组卷
|
2卷引用:黑龙江省伊春市伊美区第二中学2021-2022学年高二下学期开学考试化学试题
名校
解题方法
2 . 如下所示电解装置中,通电后向石墨电极Ⅱ附近滴加石蕊溶液,出现红色,下列判断错误 的是
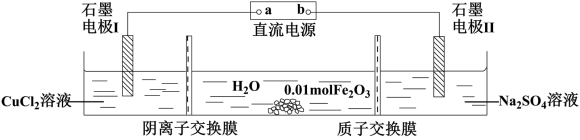

| A.a是电源的负极 |
| B.通电一段时间后,石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解 |
| C.随着电解的进行,CuCl2溶液浓度变大 |
| D.当0.01molFe2O3完全溶解时,至少产生气体336mL(折合成标准状况下) |
您最近一年使用:0次
2022-01-03更新
|
549次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2021-2022学年高二下学期开学考试化学试题
名校
解题方法
3 . 某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量,体积均为1L),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
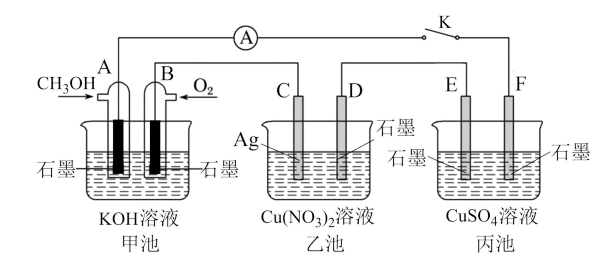
(1)甲、乙、丙三池中为原电池的是___________ (填“甲池”,“乙池”,“丙池”),A电极的电极反应式为___________ 。
(2)丙池中E电极为___________ (填“正极”、“负极”、“阴极”或“阳极”),该池总反应的化学方程式为___________ 。
(3)当甲池中B电极上消耗O2的体积为560mL(标准状况)时,乙池中C极质量理论上减轻___________ g,则丙池溶液的pH为___________
(4)一段时间后,断开电键K,下列物质能使丙池恢复到反应前浓度的是___________ (填选项字母)。

(1)甲、乙、丙三池中为原电池的是
(2)丙池中E电极为
(3)当甲池中B电极上消耗O2的体积为560mL(标准状况)时,乙池中C极质量理论上减轻
(4)一段时间后,断开电键K,下列物质能使丙池恢复到反应前浓度的是___________ (填选项字母)。
| A.Cu | B.CuO | C.CuCO3 | D.Cu(OH)2 |
您最近一年使用:0次
2022-01-02更新
|
660次组卷
|
5卷引用: 黑龙江省大庆市大庆中学2022-2023学年高二下学期开学考试化学试题
黑龙江省大庆市大庆中学2022-2023学年高二下学期开学考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期期末考试化学试题(已下线)专题29 电化学计算的三种常用方法-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)河南省焦作市温县第一高级中学2021-2022学年高二下学期2月月考化学试题(已下线)电化学原理及应用
名校
4 . 氯碱工业是高耗能产业,将电解池与燃料电池串联组合的新工艺可节能,装置图如图所示,下列叙述错误的是(注:假定空气中氧气的体积分数为20%)


| A.X为Cl2,Y为H2 |
| B.c>a>b |
| C.若生成标准状况下22.4LX,则消耗标准状况下空气56L |
| D.两池中阳离子交换膜均可以换为阴离子交换膜 |
您最近一年使用:0次
2021-10-13更新
|
617次组卷
|
6卷引用:黑龙江省大兴安岭实验中学2023-2024学年高二下学期开学考试化学试卷
黑龙江省大兴安岭实验中学2023-2024学年高二下学期开学考试化学试卷内蒙古包头市2022-2023学年高三上学期开学调研考试化学试题湖北省武昌实验中学2022届高三十月阶段性测试化学试题(已下线)专题30 电化学中的交换膜-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题11 电化学-2022年高考化学二轮复习重点专题常考点突破练(已下线)第4讲 电解池 金属的电化学腐蚀与防护
名校
解题方法
5 . 如图是一个电化学原理的示意图。填写下列空白:
(1)请写出甲、乙两池的名称。甲池是_______ ,乙池是_______ 。
(2)甲池中通入 的电极名称是
的电极名称是_______ ,电极反应方程式为_______ ;乙池中 (石墨)电极的名称是
(石墨)电极的名称是_______ 。
(3)电解过程中,乙池溶液 的变化为(“升高”“降低”或“不变”)
的变化为(“升高”“降低”或“不变”)_______ 。
(4)当乙池中 极的质量增加
极的质量增加 时,甲池中理论上消耗
时,甲池中理论上消耗
_______  (标准状况下)。
(标准状况下)。
(5)若乙池中的 换成一定量
换成一定量 溶液,通电一段时间后,向所得的溶液中加入
溶液,通电一段时间后,向所得的溶液中加入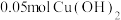 后恰好恢复到电解前的浓度和
后恰好恢复到电解前的浓度和 ,则电解过程中转移的电子数为
,则电解过程中转移的电子数为_______  (忽略溶液体积的变化)。
(忽略溶液体积的变化)。

(1)请写出甲、乙两池的名称。甲池是
(2)甲池中通入
 的电极名称是
的电极名称是 (石墨)电极的名称是
(石墨)电极的名称是(3)电解过程中,乙池溶液
 的变化为(“升高”“降低”或“不变”)
的变化为(“升高”“降低”或“不变”)(4)当乙池中
 极的质量增加
极的质量增加 时,甲池中理论上消耗
时,甲池中理论上消耗
 (标准状况下)。
(标准状况下)。(5)若乙池中的
 换成一定量
换成一定量 溶液,通电一段时间后,向所得的溶液中加入
溶液,通电一段时间后,向所得的溶液中加入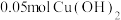 后恰好恢复到电解前的浓度和
后恰好恢复到电解前的浓度和 ,则电解过程中转移的电子数为
,则电解过程中转移的电子数为 (忽略溶液体积的变化)。
(忽略溶液体积的变化)。
您最近一年使用:0次
2021-09-04更新
|
298次组卷
|
5卷引用:黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题
黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题湖北省罗田县第一中学2021-2022学年高二上学期9月月考化学试题(已下线)选择性必修1 综合检测(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)湖南省长沙市宁乡市2021-2022学年高二上学期期末调研考试化学试题河北省石家庄元氏县第四中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
6 . 电化学知识在物质制备领域的应用前景看好。
(1)利用反应6NO2+8NH3= 7N2 + 12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

①A电极的电极反应式为___________ 。
②下列关于该电池的说法正确的是___________ 。
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极上的电极反应式为___________ 。
②若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到11.2 L(标准状况)气体时,消耗甲烷的体积为___________ L(标准状况下)。
(3)阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:

①电解饱和食盐水的化学方程式为___________ 。
②电解结束后,能够脱去阳极液中游离氯的试剂或方法是___________ (填字母序号)。
A.Na2SO4 B.Na2SO3
C.热空气吹出 D.降低阳极区液面上方的气压
(4)按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。

已知一:甲槽电解的是200 mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
①原混合溶液中NaCl的物质的量浓度为___________ mol·L-1,CuSO4的物质的量浓度为___________ mol·L-1。
已知二:乙槽为200 mL CuSO4溶液:
②当C极析出0.64 g物质时,乙槽溶液中生成的H2SO4为___________ mol。电解后,若使乙槽内的溶液完全复原,可向乙槽中加入___________ 。
A.Cu(OH)2 B.CuO C.CuCO3 D.Cu2(OH)2CO3
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为___________ (用NA表示)。
(1)利用反应6NO2+8NH3= 7N2 + 12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

①A电极的电极反应式为
②下列关于该电池的说法正确的是
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极上的电极反应式为
②若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到11.2 L(标准状况)气体时,消耗甲烷的体积为
(3)阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:

①电解饱和食盐水的化学方程式为
②电解结束后,能够脱去阳极液中游离氯的试剂或方法是
A.Na2SO4 B.Na2SO3
C.热空气吹出 D.降低阳极区液面上方的气压
(4)按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。

已知一:甲槽电解的是200 mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
①原混合溶液中NaCl的物质的量浓度为
已知二:乙槽为200 mL CuSO4溶液:
②当C极析出0.64 g物质时,乙槽溶液中生成的H2SO4为
A.Cu(OH)2 B.CuO C.CuCO3 D.Cu2(OH)2CO3
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
您最近一年使用:0次
2021-08-26更新
|
870次组卷
|
2卷引用:黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题
名校
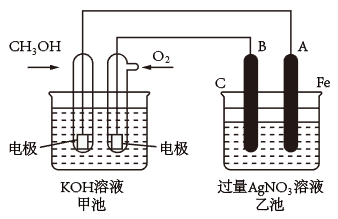
7 . 如图甲是利用一种微生物将废水中的尿素(H2NCONH2)的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是


| A.X电极与铁电极相连接 |
| B.当N电极消耗0.75mol气体时,则铁电极质量增加48g |
| C.乙装置中溶液的颜色不会变浅 |
| D.M电极反应式:H2NCONH2+H2O-6e-=CO2↑+N2↑+6H+ |
您最近一年使用:0次
2021-08-26更新
|
755次组卷
|
4卷引用:黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题
黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题(已下线)第4章 化学反应与电能(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)山东省烟台市福山区第一中学2021-2022学年高三上学期9月月考化学试题.河南省驻马店高级中学2022~2023学年高二下学期第一次月考化学试题
名校
8 . 按如图所示装置进行下列不同的操作,其中不正确的是
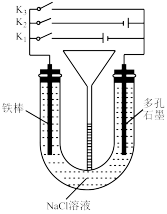

| A.先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降 |
| B.只接通K1,一段时间后,U形管中出现白色沉淀 |
| C.只接通K2,U形管左、右两端液面均下降 |
| D.铁腐蚀的速率由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2 |
您最近一年使用:0次
2021-08-26更新
|
702次组卷
|
6卷引用:黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题
名校
解题方法
9 . 下图是一套模拟工业生产的电化学装置。丙装置中两电极均为惰性电极,电解质溶液为KCl溶液,不考虑气体溶解,且钾离子交换膜只允许钾离子通过。下列说法正确的是
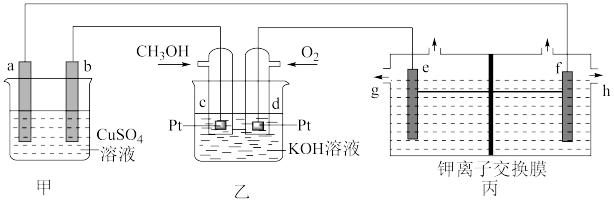

| A.若甲装置中a、b均为惰性电极,一段时间后,两极均有气体产生,则加入CuO一定能使溶液复原 |
| B.若甲装置中b为精铜,a为镀件,则可实现a上镀铜 |
| C.丙装置可以制取KOH溶液,制得的KOH可以通过g口排出 |
| D.当d电极消耗标准状况下1.12LO2时,丙装置中阳极室溶液质量减少14.9g |
您最近一年使用:0次
2021-07-20更新
|
1160次组卷
|
5卷引用:黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题
黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题重庆西南大学附属中学校2020-2021学年高二下学期期末考试化学试题(已下线)1.2.3 电解池的工作原理及应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)山东省烟台市福山区第一中学2021-2022学年高三上学期9月月考化学试题.四川省泸州市泸县第五中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
10 . 以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
I.汽车尾气中的 NO(g)和 CO(g)在一定条件下可发生反应生成无毒的N2和 CO2:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H =-746.5 kJ/mol ①
N2(g)+2CO2(g) △H =-746.5 kJ/mol ①
(1)某研究小组在三个容积为 5 L 的恒容密闭容器中,分别充入 0.4mol NO 和 0.4 mol CO,发生反应① 。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图1所示:
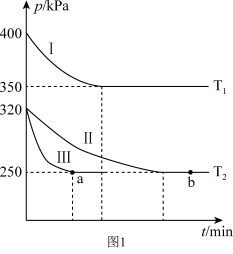
①温度:T1___________ T2(填“<”“=”或“>”)。
②CO 的平衡转化率:Ⅰ___________ Ⅱ___________ Ⅲ(填“<”“=”或“>”)。
③反应速率:a 点的 v(逆)___________ b 点的 v(正) (填“<”“=”或“>”)。
④T2时的平衡常数 Kp=___________ 。(Kp表示用平衡分压表示的平衡常数,各物质的分压=总压×各物质在混合气体中所占的物质的量分数)
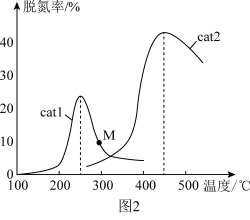
(2)将 NO和 CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即 NO的转化率)如图2所示。M 点___________ (填“是”或“不是”)对应温度下的平衡脱氮率, 说明理由___________ 。
II.将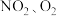 和熔融
和熔融 制成燃料电池,模拟工业电解法精炼银,装置如图3所示。
制成燃料电池,模拟工业电解法精炼银,装置如图3所示。

(3)①甲池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅱ附近发生的电极反应方程式为___________ 。
②若用10A的电流电解50min后,乙中阴极得到21.6gAg,则该电解池的电解效率为___________ %。(保留小数点后一位)。已知:通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C•mol﹣1
I.汽车尾气中的 NO(g)和 CO(g)在一定条件下可发生反应生成无毒的N2和 CO2:
2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H =-746.5 kJ/mol ①
N2(g)+2CO2(g) △H =-746.5 kJ/mol ①(1)某研究小组在三个容积为 5 L 的恒容密闭容器中,分别充入 0.4mol NO 和 0.4 mol CO,发生反应① 。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图1所示:

①温度:T1
②CO 的平衡转化率:Ⅰ
③反应速率:a 点的 v(逆)
④T2时的平衡常数 Kp=
(2)将 NO和 CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测量的脱氮率(脱氮率即 NO的转化率)如图2所示。M 点

II.将
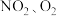 和熔融
和熔融 制成燃料电池,模拟工业电解法精炼银,装置如图3所示。
制成燃料电池,模拟工业电解法精炼银,装置如图3所示。
(3)①甲池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅱ附近发生的电极反应方程式为
②若用10A的电流电解50min后,乙中阴极得到21.6gAg,则该电解池的电解效率为
您最近一年使用:0次



