名校
解题方法
1 . 液体锌电池是一种电压较高的二次电池,具有成本低、安全性强、可循环使用等特点,其放电过程示意图如图。下列说法不正确 的是
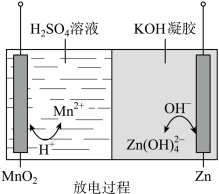
已知:① ;②KOH凝胶中允许离子存在、生成或迁移。
;②KOH凝胶中允许离子存在、生成或迁移。

已知:①
 ;②KOH凝胶中允许离子存在、生成或迁移。
;②KOH凝胶中允许离子存在、生成或迁移。A.充电过程中,阴极的电极反应: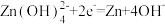 |
B.放电过程中,正极的电极反应: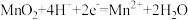 |
C.放电过程中, 由正极向负极迁移 由正极向负极迁移 |
D.在充、放电过程中,凝胶中的 可再生 可再生 |
您最近半年使用:0次
2024-01-04更新
|
503次组卷
|
7卷引用:北京市西城区2020届高三上学期期末考试化学试题
名校
2 . NiSO4主要用于电镀工业,作为电镀镍和化学镍的主要原料,也用于生产其他镍盐(如氧化镍、硫酸镍铵、碳酸镍等),从矿渣[含NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如图:
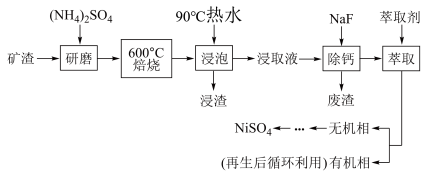
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________ (写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为___________ 。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L﹣1),当溶液中c(F﹣)=2.0×10-3.5mol•L-1时,除钙率为___________ [Ksp(CaF2)=4.0×10-11]。
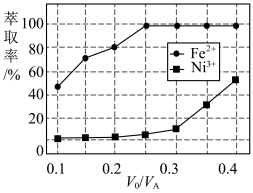
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相) FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 ___________ 。在 ___________ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO 。
。
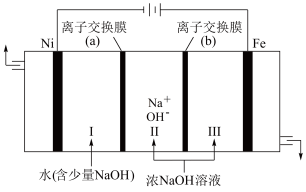
①电解时阳极的电极反应式为___________ ,离子交换膜(b)为 ___________ (填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为___________ 。

已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L﹣1),当溶液中c(F﹣)=2.0×10-3.5mol•L-1时,除钙率为
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相)
 FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO
 。
。
①电解时阳极的电极反应式为
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为
您最近半年使用:0次
2023-10-03更新
|
436次组卷
|
6卷引用:【市级联考】山东省威海市2019届高三下学期5月高考模拟考试理科综合化学试题
3 . 利用电化学原理,将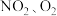 和熔融
和熔融 制成燃料电池,模拟工业电解法来处理含
制成燃料电池,模拟工业电解法来处理含 的废水,如图所示;电解过程中溶液发生反应:
的废水,如图所示;电解过程中溶液发生反应: 。
。
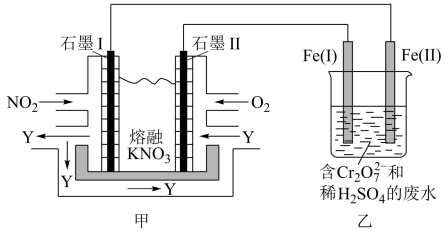
(1)甲池工作时, 转变成绿色硝化剂Y,Y是
转变成绿色硝化剂Y,Y是 ,可循环使用。则石墨II是电池的
,可循环使用。则石墨II是电池的_______ (填“正”或“负”)极;石墨I附近发生的电极反应式为_______ 。
(2)工作时,甲池内的 向
向_______ (填“石墨I”或“石墨II”)极移动;在相同条件下,消耗的 和
和 的体积比为
的体积比为_______ 。
(3)乙池中 (I)棒上发生的电极反应为
(I)棒上发生的电极反应为_______ 。
(4)若溶液中减少了 ,则电路中至少转移了
,则电路中至少转移了_______  电子。
电子。
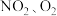 和熔融
和熔融 制成燃料电池,模拟工业电解法来处理含
制成燃料电池,模拟工业电解法来处理含 的废水,如图所示;电解过程中溶液发生反应:
的废水,如图所示;电解过程中溶液发生反应: 。
。
(1)甲池工作时,
 转变成绿色硝化剂Y,Y是
转变成绿色硝化剂Y,Y是 ,可循环使用。则石墨II是电池的
,可循环使用。则石墨II是电池的(2)工作时,甲池内的
 向
向 和
和 的体积比为
的体积比为(3)乙池中
 (I)棒上发生的电极反应为
(I)棒上发生的电极反应为(4)若溶液中减少了
 ,则电路中至少转移了
,则电路中至少转移了 电子。
电子。
您最近半年使用:0次
2023-02-14更新
|
192次组卷
|
7卷引用:福建省南安第一中学2017-2018学年高二上学期期中考试化学试题
福建省南安第一中学2017-2018学年高二上学期期中考试化学试题山东师范大学附属中学2021届高三上学期期中考试(11月)化学试题(已下线)第19讲 电解池 金属的电化学腐蚀与防护(精练)-2022年高考化学一轮复习讲练测天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题(已下线)第六章 化学反应与能量 第38练 电解原理的综合应用(已下线)热点题型训练 电化学串联装置的两大模型(已下线)电化学原理及应用
名校
解题方法
4 . 如图所示装置可间接氧化工业废水中的含氮离子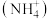 。下列说法不正确的是
。下列说法不正确的是
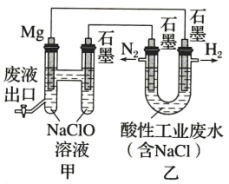
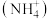 。下列说法不正确的是
。下列说法不正确的是
| A.乙是电能转变为化学能的装置 |
B.含氮离子被氧化时的离子方程式为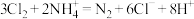 |
C.若生成 和 和 的物质的量之比为3∶1,则处理后废水的 的物质的量之比为3∶1,则处理后废水的 减小 减小 |
D.电池工作时,甲池中的 移向 移向 电极 电极 |
您最近半年使用:0次
2023-02-14更新
|
277次组卷
|
6卷引用:四川达州市普通高中2018届第一次诊断性测试化学试题
四川达州市普通高中2018届第一次诊断性测试化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题08 电解池类选择题解题方法和策略2020届高三化学化学二轮复习——高考常考题型:原电池、电解池串联的分析和计算【精编选择30题】黑龙江省牡丹江市第三中学2021-2022学年高三上学期第三次月考理综化学试题(已下线)第六章 化学反应与能量 第38练 电解原理的综合应用(已下线)专题八 电化学的相关计算
21-22高二上·江苏扬州·阶段练习
名校
解题方法
5 . 太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1- xFePO4 LiFePO4+C6,下列说法正确的是
LiFePO4+C6,下列说法正确的是
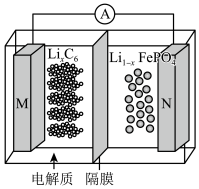
 LiFePO4+C6,下列说法正确的是
LiFePO4+C6,下列说法正确的是
A.放电时Li+从左边移向右边, 从右边移向左边 从右边移向左边 |
| B.放电时,正极反应式为 Li1-xFePO4+xLi++xe- =LiFePO4 |
C.充电时M极连接电源的负板,电极反应式为C6+xe-=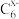 |
| D.充电时电路中通过2.0 mol电子,产生28 gLi |
您最近半年使用:0次
2023-01-26更新
|
481次组卷
|
11卷引用:2020年山东卷化学高考真题变式题11-15
(已下线)2020年山东卷化学高考真题变式题11-15江苏省扬州中学2021-2022学年高二上学期10月阶段检测化学试题福建省福州格致中学2021-2022学年高二上学期第一阶段测试化学试题(10月)新疆维吾尔自治区疏附县第一中学2021-2022学年高三上学期期中考试化学试题湖南省长沙市周南中学2021-2022学年高二上学期(12月)第三次阶段检测卷化学试题江西省九江市第一中学2021-2022学年高二上学期第二次月考化学试题(已下线)高中化学-高二上-10浙江省杭州高级中学2022-2023学年高三上学期模拟考试化学试题浙江省杭州外国语学校2022-2023学年高二上学期期中考试 化学试题山东省郓城第一中学2023-2024学年高二上学期开学考试化学试题江苏省南通市如东县2023-2024学年高二上学期期中学情检测化学试题
9-10高二下·河北·阶段练习
名校
解题方法
6 . 下面有关电化学的图示,完全正确的是
A.Cu-Zn原电池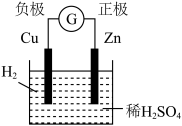 | B.粗铜的精炼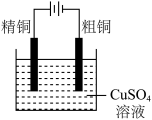 |
C.铁片镀锌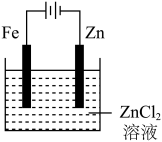 | D.验证NaCl溶液(含酚酞)电解产物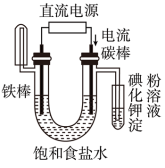 |
您最近半年使用:0次
2022-12-21更新
|
636次组卷
|
59卷引用:2009—2010学年存瑞中学第二学期第二阶段考试高二化学试题
(已下线)2009—2010学年存瑞中学第二学期第二阶段考试高二化学试题2015届江西省吉安市白鹭洲中学高三上学期期中化学试卷2015届上海市虹口区高三上学期期末考试化学试卷2014-2015湖南省娄底市湘中名校高二上学期期末化学(理)试卷2014-2015学年福建省晋江市季延中学高二下学期期中考试化学试卷2015-2016学年河北省成安一中高二上学期1月月考化学试卷2015-2016学年黑龙江东部地区高二上学期期末联考化学试卷2015-2016学年广西钦州港经济开发区中学高一上学期期末化学试卷2016-2017学年山东省寿光中学高二上10月月考化学卷2017届宁夏石嘴山三中高三上期中化学试卷2016-2017黑龙江牡丹江第一高级中学高二上期末化学卷内蒙古包头市铁路一中2016-2017学年高二下学期期末考试化学试题山东省寿光现代中学2017-2018学年高二上学期开学考试化学试题河北省承德市第一中学2017-2018学年高二上学期第一次月考化学试题安徽省蚌埠市第二中学2017-2018学年高二上学期期中考试化学试题河南省安阳市2016-2017学年高二上学期期末考试化学试题青海省西宁市第四高级中学2017-2018学年高二上学期期末考试化学试题山东省德州市2017-2018学年高二上学期期末考试化学试题四川省什邡中学2017-2018学年高二春秋招班第三次月考化学试题云南省腾冲市第八中学2017-2018学年高二下学期期末考试化学试题河南省郑州市第一中学2018-2019学年高二上学期入学测试化学试题高二人教版选修4 第四章 第三节 电解池【全国百强校】福建省莆田市第一中学2018-2019学年高二上学期期中考试化学试题山东省泰安第四中学2018-2019学年高二上学期12月月考化学试题【校级联考】江西省吉安市几所重点中学2018-2019学年高二上学期联考化学试题【全国百强校】江西省临川第一中学2018-2019学年高二上学期12月月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二上学期期末考试化学试题【全国百强校】黑龙江省大庆市第一中学2018-2019学年高二下学期第三次阶段考试化学试题重庆市第三十中学2018-2019学年高二上学期第三次月考化学试题广东省深圳科学高中2019-2020学年高二上学期开学考试化学试题浙江省宁波市余姚中学2019-2020学年高二上学期期中考试化学试题【全国百强校】上海市复旦大学附属中学2019—2020学年高三上学期期中考试化学试题黑龙江省大庆市第十中学2019-2020学年高二上学期期末考试化学试题陕西省咸阳市2019—2020学年高二上学期期末考试化学试题湖南广益实验中学2019-2020学年高二上学期期末考试化学试题四川省新津中学2019-2020学年高二下学期4月月考(入学)化学试题江西省上饶市2018-2019学年高二下学期期末教学质量测试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2019-2020学年高二上学期开学考试(8月)化学试题宁夏银川市宁夏大学附属中学2021届高三上学期第一次月考化学试题(已下线)【浙江新东方】43山东省泰安市宁阳一中2020-2021学年高二上学期10月学习质量检测化学试题 山东省泰安市宁阳县宁阳一中2020-2021学年高二上学期第一阶段考试化学试题(已下线)【浙江新东方】绍兴qw124安徽省六安市舒城县舒州中学2020-2021学年高二上学期12月月考化学试题福建省宁德第一中学2020-2021学年高二上学期第一次月考化学试题宁夏石嘴山三中2015~2016学年度高二上学期期末化学试卷【解析版】内蒙古北京八中乌兰察布分校2020-2021学年高二上学期期末考试化学试题安徽省淮北市树人高级中学2020-2021学年高二下学期第一次阶段考试化学试题江苏省吴江汾湖高级中学2020-2021学年高二下学期阶段性教学质量检测化学试题内蒙古集宁新世纪中学2020-2021学年高二下学期质量检测月考化学试题安徽省泗县第一中学2021-2022学年高二上学期第二次月考化学试题河北省邢台市第一中学2021-2022学年高二上学期第三次月考化学试题陕西省安康市六校联考2021-2022学年高二上学期期末考试化学试题四川省凉山州2021-2022学年高二上学期期末考试化学试题陕西省西安市西航一中2021-2022学年高二上学期期末考试化学试题(已下线)第29讲 第四章《化学反应与电能》单元测试(基础巩固)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)辽宁省锦州市黑山县黑山中学2021-2022学年高二上学期12月月考化学试题广东省兴宁市下堡中学2021-2022学年高二上学期期末质量检测化学试题(已下线)专题突破卷07 化学反应与能量?-2024年高考化学一轮复习考点通关卷(新教材新高考)
名校
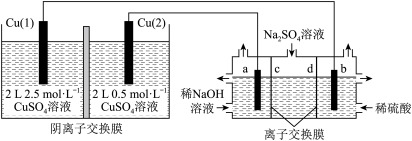
7 . 相同金属在其不同浓度盐溶液中可形成浓差电池。它是通过一种物质从高浓度状态向低浓度状态的转移而获得电动势。如图所示装置是利用浓差电池电解 溶液(a、b电极均为石墨电极),可以制得
溶液(a、b电极均为石墨电极),可以制得 、
、 、
、 和
和 。下列说法不正确的是
。下列说法不正确的是
 溶液(a、b电极均为石墨电极),可以制得
溶液(a、b电极均为石墨电极),可以制得 、
、 、
、 和
和 。下列说法不正确的是
。下列说法不正确的是
A.a电极的电极反应为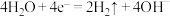 |
| B.c、d离子交换膜依次为阳离子交换膜和阴离子交换膜 |
C.电池放电过程中,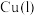 电极上的电极反应为 电极上的电极反应为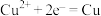 |
D.电池从开始工作到停止放电,电解池理论上可制得320g |
您最近半年使用:0次
2022-11-23更新
|
414次组卷
|
24卷引用:山东省烟台市2020年高考诊断性测试(高三一模)化学试题
山东省烟台市2020年高考诊断性测试(高三一模)化学试题湖南省常德市第一中学2021届高三第四次月水平检测试化学试题山东省青岛第二中学2020-2021学年高二上学期期中考试化学试题(已下线)江苏省常州市前黄高级中学、溧阳中学2021届高三上学期期末联合考试化学试题(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)【浙江新东方】高中化学20210323-001【高三下】(已下线)小题19 多池多室带膜电化学装置 ——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)押全国卷理综第11题 电化学基础-备战2021年高考化学临考题号押题(课标全国卷)(已下线)课时33 多池多室带膜电化学装置-2022年高考化学一轮复习小题多维练(全国通用)山东省济南市历城第二中学2021-2022学年(2022届)高三上学期开学考试(B)化学试题山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题(已下线)2022年新高考化学时事热点情境化考题---电化学专题(已下线)专题11 电化学-备战2022年高考化学学霸纠错(全国通用)山东省实验中学2021-2022学年高三上学期第三次诊断考试化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题12 化学反应与电能-2023年高考化学一轮复习小题多维练(全国通用)湖南省蓝山县第二中学2021-2022学年高三下学期4月月考化学试题浙江省北仑中学2022-2023学年高二上学期期中检测化学试题武汉市第六中学2022-2023学年高二上学期第二次月考化学试题(已下线)热点题型训练 电化学串联装置的两大模型山东省青岛第二中学2021-2022学年高二上学期10月月考化学试题河南省南阳市第一中学校2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
8 . 利用所学电化学反应原理,解决以下问题:
(1)如图是电解未知浓度的硝酸银溶液的示意图,请根据要求答题。

①Fe电极叫做____ 极,C电极的反应式为____ 。
②当某电极的固体质量增重21.6g时,整个装置共产生气体(标准状况下)体积2.24L,推断该气体的组成____ 。
(2)图中甲池的总反应式为____ 。
①甲池中负极上的电极反应式为____ 。
②乙池中石墨电极上发生的反应为____ 。
③要使乙池恢复到电解前的状态,应向溶液中加入适量的____ 。
A.CuOB.Cu(OH)2C.CuCO3D.CuSO4
(3)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:____ 。
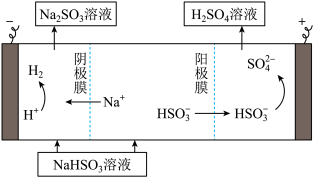
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如图。请写出开始时阳极反应的电极反应式:____ 。
(1)如图是电解未知浓度的硝酸银溶液的示意图,请根据要求答题。

①Fe电极叫做
②当某电极的固体质量增重21.6g时,整个装置共产生气体(标准状况下)体积2.24L,推断该气体的组成
(2)图中甲池的总反应式为

①甲池中负极上的电极反应式为
②乙池中石墨电极上发生的反应为
③要使乙池恢复到电解前的状态,应向溶液中加入适量的
A.CuOB.Cu(OH)2C.CuCO3D.CuSO4
(3)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如图。请写出开始时阳极反应的电极反应式:

您最近半年使用:0次
2022-10-30更新
|
260次组卷
|
3卷引用:安徽省滁州市新锐学校2019-2020学年高二上学期期末考试理综化学试卷
名校
解题方法
9 . 甲池、乙池和丙池三个装置如图连接,下列有关说法正确的是
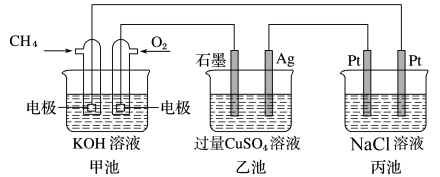

| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池中消耗280mL(标准状况下)O2,此时乙池中银电极增重1.6g |
C.甲池通入CH4的电极反应为:CH4-8e-+3H2O=CO +10H+ +10H+ |
| D.反应一段时间后,向丙池中加入一定量盐酸,能使NaCl溶液恢复到原状态 |
您最近半年使用:0次
2022-10-28更新
|
85次组卷
|
2卷引用:山东省青岛第二中学2020-2021学年高二上学期期中考试化学试题
名校
10 . 已知下列热化学为程式:
① Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
② 3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) △H2=﹣47 kJ·mol-1
③ Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H3=﹢19 kJ·mol-1
(1)写出 FeO(s)被CO还原成Fe和CO2的热化学方程式_______ 。
(2)常温常压下,一定量C2H5OH燃烧生成气态CO2和液态水时放出136.7kJ热量,将燃烧产物通入足量澄清石灰水生成20克沉淀,表示该反应的热化学方程式为_______ 。
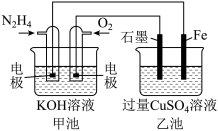
(3)如图是乙醇燃料电池工作时的示意图,甲池使用Pt作电极材料,乙池中的两个电极一个是石墨,一个是铁,工作时M、N两个电极的质量都不减少,回答下列问题:

①乙池为_______ 装置,M的电极材料是_______ ,N为_______ 极,电极反应式为_______ ,甲池通入氧气的一端为_______ 极,通乙醇的电极上发生的电极反应式为_______ 。
②工作中当电路中通过0.04mol电子时,甲池中理论上消耗氧气_______ L(STP),乙池中的M极会得到 _______ (写出生成物质的名称及质量)。
① Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H1=﹣25 kJ·mol-1
② 3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) △H2=﹣47 kJ·mol-1
③ Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H3=﹢19 kJ·mol-1
(1)写出 FeO(s)被CO还原成Fe和CO2的热化学方程式
(2)常温常压下,一定量C2H5OH燃烧生成气态CO2和液态水时放出136.7kJ热量,将燃烧产物通入足量澄清石灰水生成20克沉淀,表示该反应的热化学方程式为
(3)如图是乙醇燃料电池工作时的示意图,甲池使用Pt作电极材料,乙池中的两个电极一个是石墨,一个是铁,工作时M、N两个电极的质量都不减少,回答下列问题:

①乙池为
②工作中当电路中通过0.04mol电子时,甲池中理论上消耗氧气
您最近半年使用:0次



