1 . 某研究性学习小组设计了一组实验验证元素周期律。
I.甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相同的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的:验证同一主族,从上到下金属元素原子失电子能力逐渐增强;同一周期主族元素从左到右金属元素原子失电子能力逐渐_______ 。
(2)烧杯中反应最剧烈的金属是_______(填字母)。
(3)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法_______(填字母)。
II.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题。
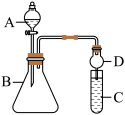
(4)实验装置:
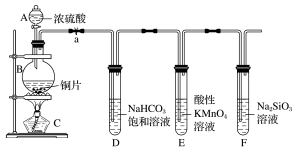
仪器B的名称为_______ 。
(5)实验步骤:连接仪器、_______ 、加药品,打开a,然后滴入浓硫酸,加热。
(6)问题探究:(已知酸性亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是_______ ;装置E中酸性KMnO4溶液的作用是_______ 。
②能说明碳元素的非金属性比硅元素的非金属性强的实验现象是_______ ;试管F中发生反应的离子方程式为_______ 。
③依据试管D中的反应,能否证明S的非金属性强于C的非金属性?_______ (填“能”或“否”)。说明理由_______ 。
I.甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相同的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的:验证同一主族,从上到下金属元素原子失电子能力逐渐增强;同一周期主族元素从左到右金属元素原子失电子能力逐渐
(2)烧杯中反应最剧烈的金属是_______(填字母)。
| A.钠 | B.镁 | C.铝 | D.钾 |
| A.把镁、铝的金属块换成金属粉末 | B.把烧杯中的冷水换成热水 |
| C.把烧杯中的冷水换成等量的同浓度的盐酸 | D.把烧杯中的冷水换成氢氧化钠溶液 |
II.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题。
(4)实验装置:

仪器B的名称为
(5)实验步骤:连接仪器、
(6)问题探究:(已知酸性亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是
②能说明碳元素的非金属性比硅元素的非金属性强的实验现象是
③依据试管D中的反应,能否证明S的非金属性强于C的非金属性?
您最近一年使用:0次
解题方法
2 . 某兴趣小组的同学拟采用以下装置制备氯气并进行一系列相关探究实验的装置。请回答下列问题:

(1)装置A中a仪器的名称:______ ,用装置A制氯气所发生反应的离子方程式为______ ,反应中氧化剂与还原剂的物质的量之比为______ 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入______ (填字母)。
(3)设计装置D、E的目的是比较氯、溴、碘的非金属性。实验过程:
I.打开弹簧夹,打开a的活塞,滴加浓盐酸。
II.当D和F中的溶液都变为黄色时,夹紧弹簧夹。
III.当D中溶液由黄色变为红棕色时,关闭a的活塞。
IV.打开活塞b,将少量F中溶液滴入E中,关闭活塞b,取下E振荡,静置后CCl4层变为紫红色
①过程IV的现象能证明溴的氧化性强于碘,反应的离子方程式是______ 。
②过程III实验的目的是_____ 。
③氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下______ ,得电子能力逐渐减弱。

(1)装置A中a仪器的名称:
(2)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
I.打开弹簧夹,打开a的活塞,滴加浓盐酸。
II.当D和F中的溶液都变为黄色时,夹紧弹簧夹。
III.当D中溶液由黄色变为红棕色时,关闭a的活塞。
IV.打开活塞b,将少量F中溶液滴入E中,关闭活塞b,取下E振荡,静置后CCl4层变为紫红色
①过程IV的现象能证明溴的氧化性强于碘,反应的离子方程式是
②过程III实验的目的是
③氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下
您最近一年使用:0次
名校
解题方法
3 . 某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)反应最剧烈的烧杯中金属是_______ (填字母序号);
A.钠 B.镁 C.铝 D.钾
(2)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法_______ (填字母序号)。
A.把烧杯中的冷水换成热水
B.把烧杯中的冷水换成盐酸
C.把烧杯中的冷水换成浓硝酸
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题实验装置:(已知酸性强弱:亚硫酸>碳酸)

(3)铜与浓硫酸反应的化学方程式是_______ ;
(4)能说明碳元素的非金属性比硅元素非金属性强的实验现象是_______ ;试管F中发生反应的离子方程式为_______ 。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)反应最剧烈的烧杯中金属是
A.钠 B.镁 C.铝 D.钾
(2)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法
A.把烧杯中的冷水换成热水
B.把烧杯中的冷水换成盐酸
C.把烧杯中的冷水换成浓硝酸
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题实验装置:(已知酸性强弱:亚硫酸>碳酸)

(3)铜与浓硫酸反应的化学方程式是
(4)能说明碳元素的非金属性比硅元素非金属性强的实验现象是
您最近一年使用:0次
2021-04-29更新
|
200次组卷
|
2卷引用:山东省济南外国语学校2022-2023学年高一3月月考化学试题
名校
4 . 某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学设计了如图的装置来一次性完成元素 非金属性强弱比较的实验研究。
非金属性强弱比较的实验研究。
可选用的实验药品有:1.0mol/LHCl(挥发性强酸)、1.0mol/LHClO4(挥发性强酸)、碳酸钙(固体)、1.0mol/L水玻璃。打开A处的活塞后,可看到有大量气泡产生,烧杯中可观察到白色沉淀生成。
(1)图一中A的仪器名称为___________ ,所装的试剂为___________ (只填化学式)。

(2)B中发生反应的离子方程式为___________ 。
(3)乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个洗气装置,洗气瓶中盛装的液体为___________
Ⅱ.丙同学设计了如图的装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉-KI试纸、沾有NaOH溶液的棉花。

(4)A处反应的离子方程式:___________ ,B处的实验现象为___________ ,C处沾有NaOH溶液的棉花的作用为___________ 。
(5)该实验___________ 验证非金属性Cl>Br>I(填“能”或“不能”)
Ⅰ.甲同学设计了如图的装置来一次性完成元素
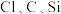 非金属性强弱比较的实验研究。
非金属性强弱比较的实验研究。可选用的实验药品有:1.0mol/LHCl(挥发性强酸)、1.0mol/LHClO4(挥发性强酸)、碳酸钙(固体)、1.0mol/L水玻璃。打开A处的活塞后,可看到有大量气泡产生,烧杯中可观察到白色沉淀生成。
(1)图一中A的仪器名称为

(2)B中发生反应的离子方程式为
(3)乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个洗气装置,洗气瓶中盛装的液体为
Ⅱ.丙同学设计了如图的装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉-KI试纸、沾有NaOH溶液的棉花。

(4)A处反应的离子方程式:
(5)该实验
您最近一年使用:0次
名校
解题方法
5 . 硫和硒(34Se)在元素周期表中位于同一主族,均是生产生活中重要的非金属元素。
I.生成SO2并检验性质:点燃酒精灯,试管ⅰ中有白雾生成,铜丝表面产生气泡;试管ⅱ中溶液红色褪去,一段时间后,将铜丝抽离硫酸并停止加热。
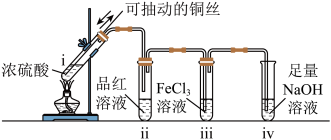
(1)i中发生反应的化学反应方程式为___________ 。
(2)ii中现象说明SO2具有___________ 作用。
(3)SO2能使溴水褪色,说明SO2具有的化学性质是___________ ,写出发生反应的离子方程式___________ 。
(4)将SO2通入FeCl3溶液中,下列实验事实能够证实FeCl3和SO2一定发生了反应的是___________ (填字母)。
a.加入酸性高锰酸钾,高锰酸钾褪色
b.取反应后的溶液少许,加入BaCl2溶液,产生白色沉淀
c.取反应后的溶液,加入Ba(OH)2溶液,产生沉淀,加入足量盐酸后,沉淀部分溶解。
II.以工业硒为原料制备高纯硒时的主要物质转化如图。
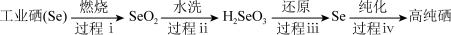
(5)下列说法不正确的是___________ (填字母序号)。
a.稳定性:H2Se>H2S b.过程ⅰ中硒被氧化
c.SeO2属于酸性氧化物 d.酸性:H2SeO4>H2SO4
(6)过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2。理论上,过程ⅰ消耗的O2与过程iii消耗的N2H4·nH2O的物质的量之比为___________ (工业硒中杂质与O2的反应可忽略)。
(7)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式___________ 。
I.生成SO2并检验性质:点燃酒精灯,试管ⅰ中有白雾生成,铜丝表面产生气泡;试管ⅱ中溶液红色褪去,一段时间后,将铜丝抽离硫酸并停止加热。

(1)i中发生反应的化学反应方程式为
(2)ii中现象说明SO2具有
(3)SO2能使溴水褪色,说明SO2具有的化学性质是
(4)将SO2通入FeCl3溶液中,下列实验事实能够证实FeCl3和SO2一定发生了反应的是
a.加入酸性高锰酸钾,高锰酸钾褪色
b.取反应后的溶液少许,加入BaCl2溶液,产生白色沉淀
c.取反应后的溶液,加入Ba(OH)2溶液,产生沉淀,加入足量盐酸后,沉淀部分溶解。
II.以工业硒为原料制备高纯硒时的主要物质转化如图。
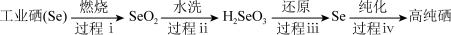
(5)下列说法不正确的是
a.稳定性:H2Se>H2S b.过程ⅰ中硒被氧化
c.SeO2属于酸性氧化物 d.酸性:H2SeO4>H2SO4
(6)过程ⅲ中使用的还原剂为N2H4·nH2O,对应产物是N2。理论上,过程ⅰ消耗的O2与过程iii消耗的N2H4·nH2O的物质的量之比为
(7)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式
您最近一年使用:0次
解题方法
6 . Ⅰ.已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的3倍,Y和Z可以形成两种以上气态化合物。则:
(1)X是__________ (填元素名称,下同),Y是__________ ,Z是__________ 。
(2)画出Z的离子结构示意图__________ 。
(3)由Y和Z组成,且Y和Z质量比为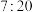 的化合物的化学式是
的化合物的化学式是__________ 。
(4)由这三种元素或任意两种组成的三核10电子的分子的化学式为__________ ,四核10电子的分子的化学式是_______ 。
(5)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为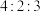 ,该盐的化学式是
,该盐的化学式是_____ 。
Ⅱ.某同学利用如图装置可验证同主族元素非金属性的变化规律。
(6)仪器A的名称为__________ ,干燥管D的作用为__________ 。
(7)若要证明非金属性: ,C中为淀粉碘化钾混合溶液,B中装有
,C中为淀粉碘化钾混合溶液,B中装有 固体,则A中试剂为
固体,则A中试剂为__________ ,观察到C中溶液__________ (填现象),即可证明非金属性: 。从环境保护的角度考虑,此装置缺少尾气处理装置,可用
。从环境保护的角度考虑,此装置缺少尾气处理装置,可用__________ 吸收尾气。
(1)X是
(2)画出Z的离子结构示意图
(3)由Y和Z组成,且Y和Z质量比为
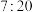 的化合物的化学式是
的化合物的化学式是(4)由这三种元素或任意两种组成的三核10电子的分子的化学式为
(5)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为
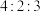 ,该盐的化学式是
,该盐的化学式是Ⅱ.某同学利用如图装置可验证同主族元素非金属性的变化规律。

(6)仪器A的名称为
(7)若要证明非金属性:
 ,C中为淀粉碘化钾混合溶液,B中装有
,C中为淀粉碘化钾混合溶液,B中装有 固体,则A中试剂为
固体,则A中试剂为 。从环境保护的角度考虑,此装置缺少尾气处理装置,可用
。从环境保护的角度考虑,此装置缺少尾气处理装置,可用
您最近一年使用:0次
2023-03-24更新
|
105次组卷
|
2卷引用:河南省南阳市六校2022-2023学年高一下学期第一次联考化学试题
解题方法
7 . 为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持装置已略去,装置气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)写出A中产生黄绿色气体的反应的离子方程式_______ 。
(2)能证明氯气的氧化性强于碘的实验现象是_______ 。
(3)B中发生反应的离子方程式是_______ 。
(4)为验证溴的氧化性强于碘,过程Ⅳ步骤如下:打开活塞b,使少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后观察到_______ 现象,证明溴的氧化性强于碘。
(5)过程Ⅲ的实验目的是_______ 。
(6)氯、溴和碘单质的氧化性逐渐减弱的原因:同主族元素从上到下原子核外电子层数依次增多,_______ ,得电子能力逐渐减弱。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)写出A中产生黄绿色气体的反应的离子方程式
(2)能证明氯气的氧化性强于碘的实验现象是
(3)B中发生反应的离子方程式是
(4)为验证溴的氧化性强于碘,过程Ⅳ步骤如下:打开活塞b,使少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后观察到
(5)过程Ⅲ的实验目的是
(6)氯、溴和碘单质的氧化性逐渐减弱的原因:同主族元素从上到下原子核外电子层数依次增多,
您最近一年使用:0次
名校
解题方法
8 . 某同学利用以下装置探究非金属元素性质的递变规律,并验证氯气的性质。
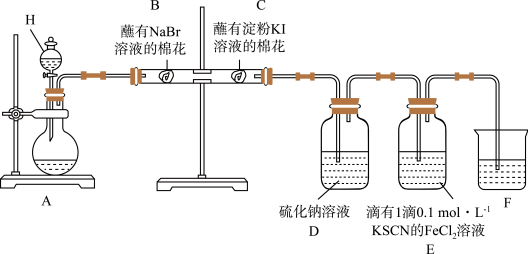
回答下列问题:
(1)仪器H的名称为_______ 。
(2)能说明氯气的氧化性强于溴的实验现象为_______ 。
(3)氯气进入D中,反应的离子方程式为_______ 。
(4)E中溶液先变为红色,后红色褪去,为探究E中溶液褪色的原因,该同学提出两种假设:a. 被氧化:b.
被氧化:b._______ ,设计实验方案验证以上假设,向褪色后的溶液中滴加_______ ,若观察到_______ ,可验证假设b成立。
(5)实验结束后,取出B处的棉花与另一个蘸有淀粉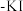 溶液的棉花G接触,棉花G变蓝。通过以上实验可以得出的结论正确的是_______(填标号)。
溶液的棉花G接触,棉花G变蓝。通过以上实验可以得出的结论正确的是_______(填标号)。

回答下列问题:
(1)仪器H的名称为
(2)能说明氯气的氧化性强于溴的实验现象为
(3)氯气进入D中,反应的离子方程式为
(4)E中溶液先变为红色,后红色褪去,为探究E中溶液褪色的原因,该同学提出两种假设:a.
 被氧化:b.
被氧化:b.(5)实验结束后,取出B处的棉花与另一个蘸有淀粉
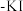 溶液的棉花G接触,棉花G变蓝。通过以上实验可以得出的结论正确的是_______(填标号)。
溶液的棉花G接触,棉花G变蓝。通过以上实验可以得出的结论正确的是_______(填标号)。A.氧化性: | B.同主族元素从上到下非金属性减弱 |
| C.同周期元素从左到右非金属性减弱 | D. 对应含氧酸酸性逐渐减弱 对应含氧酸酸性逐渐减弱 |
您最近一年使用:0次
2023-04-21更新
|
287次组卷
|
2卷引用:山东省日照市2022-2023学年高一下学期期中校际联合考试化学试题
名校
9 . 为研究同主族元素性质的递变规律,某小组以第VIIA元素为例用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。

已知: 的氧化性大于
的氧化性大于
(1)仪器X的名称为___________ ,A中反应的离子方程式___________ 。
(2)探究卤素单质氧化性的相对强弱,将实验现象填写在下表对应的空格里:
(3)操作步骤III的实验目的是___________ 。
(4)结合元素周期律解释氯、溴、碘单质的氧化性逐渐减小的原因:___________ 。
(5)实验中若氯气的通入量过多,淀粉碘化钾试纸会逐渐褪色,可能的原因____ 。

已知:
 的氧化性大于
的氧化性大于
(1)仪器X的名称为
(2)探究卤素单质氧化性的相对强弱,将实验现象填写在下表对应的空格里:
| 操作步骤 | 实验现象 |
| I.打开弹簧夹、活塞a,滴加浓盐酸。 II.当B和C中分液漏斗中的溶液都变为黄色时,夹紧弹簀夹。 | 湿润的淀粉碘化钾试纸 |
| III.当B中溶液由黄色变为棕色时,关闭活塞a。 IV.打开活塞b,将少量溶液滴入C中,关闭活塞b,取下C振荡。 | 试管C中的现象为 |
(4)结合元素周期律解释氯、溴、碘单质的氧化性逐渐减小的原因:
(5)实验中若氯气的通入量过多,淀粉碘化钾试纸会逐渐褪色,可能的原因
您最近一年使用:0次
2022-05-10更新
|
380次组卷
|
4卷引用:山东省潍坊第四中学2022-2023学年高一下学期第一次月考化学试题
解题方法
10 . 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。

(1)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理,请说明理由?___________ 。
(2)根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。利用装置图1一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究。
①实验中A选用的物质名称为___________ ,B中为碳酸钙固体,C选用的物质名称为___________ ;
②装置B中出现的现象为___________ 。
③但有同学认为该装置有缺陷,如何改进?___________ 。
(3)继续利用装置图1证明非金属性氯大于硫,选择合适药品设计实验验证。实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,选择合适药品设计实验验证氯的非金属性大于硫:装置B中所装药品为KMnO4,装置B中发生反应的化学方程式为___________ , 装置C中的实验现象为有淡黄色沉淀生成,离子方程式为___________ 。

(1)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理,请说明理由?
(2)根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。利用装置图1一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究。
①实验中A选用的物质名称为
②装置B中出现的现象为
③但有同学认为该装置有缺陷,如何改进?
(3)继续利用装置图1证明非金属性氯大于硫,选择合适药品设计实验验证。实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,选择合适药品设计实验验证氯的非金属性大于硫:装置B中所装药品为KMnO4,装置B中发生反应的化学方程式为
您最近一年使用:0次
2021-05-11更新
|
140次组卷
|
2卷引用:实验活动3 同周期、同主族元素性质的递变



