名校
解题方法
1 . 门捷列夫在研究周期表时预言了“类硅”元素锗和“类铝”元素镓等11种元素。锗及其化合物应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含 、
、 )的工艺如下:
)的工艺如下:

已知:i. 与碱反应生成
与碱反应生成 ;
; 与碱反应生成
与碱反应生成 。
。
ii. 极易水解生成
极易水解生成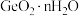 ;
; 沸点
沸点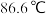 。
。
(1) 位于同主族
位于同主族 的下一周期,
的下一周期, 在周期表中的位置是
在周期表中的位置是_______ 。
(2)从原子结构角度解释金属性 比
比 强的原因
强的原因_______ 。
(3)“氧化”过程是将 氧化为
氧化为 ,其离子方程式为
,其离子方程式为_______ 。
(4)加盐酸蒸馏生成 ,生成
,生成 的化学方程式为
的化学方程式为_______ 。
(5)高纯二氧化锗的含量常采用碘酸钾 滴定法进行测定。步骤如下:
滴定法进行测定。步骤如下:
a.称取 高纯二氧化锗样品,加入氢氧化钠在电炉溶解,生成
高纯二氧化锗样品,加入氢氧化钠在电炉溶解,生成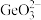
b.加入次亚磷酸钠溶液还原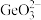 为
为
c.以淀粉为指示剂,用 的碘酸钾标准溶液滴定,当消耗碘酸钾溶液
的碘酸钾标准溶液滴定,当消耗碘酸钾溶液 时,溶液变蓝色,半分钟内溶液颜色不变。资料:
时,溶液变蓝色,半分钟内溶液颜色不变。资料: ;
;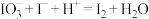 (未配平)。(
(未配平)。( 以下,次亚磷酸钠与
以下,次亚磷酸钠与 和
和 均不反应,
均不反应, 消耗的
消耗的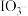 忽略不计)
忽略不计)
①配平离子方程式_______ 。

②此样品中二氧化锗的质量分数是_______ (用含w、c、V的数学表达式表示)。
 、
、 )的工艺如下:
)的工艺如下:
已知:i.
 与碱反应生成
与碱反应生成 ;
; 与碱反应生成
与碱反应生成 。
。ii.
 极易水解生成
极易水解生成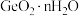 ;
; 沸点
沸点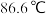 。
。(1)
 位于同主族
位于同主族 的下一周期,
的下一周期, 在周期表中的位置是
在周期表中的位置是(2)从原子结构角度解释金属性
 比
比 强的原因
强的原因(3)“氧化”过程是将
 氧化为
氧化为 ,其离子方程式为
,其离子方程式为(4)加盐酸蒸馏生成
 ,生成
,生成 的化学方程式为
的化学方程式为(5)高纯二氧化锗的含量常采用碘酸钾
 滴定法进行测定。步骤如下:
滴定法进行测定。步骤如下:a.称取
 高纯二氧化锗样品,加入氢氧化钠在电炉溶解,生成
高纯二氧化锗样品,加入氢氧化钠在电炉溶解,生成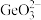
b.加入次亚磷酸钠溶液还原
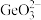 为
为
c.以淀粉为指示剂,用
 的碘酸钾标准溶液滴定,当消耗碘酸钾溶液
的碘酸钾标准溶液滴定,当消耗碘酸钾溶液 时,溶液变蓝色,半分钟内溶液颜色不变。资料:
时,溶液变蓝色,半分钟内溶液颜色不变。资料: ;
;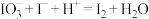 (未配平)。(
(未配平)。( 以下,次亚磷酸钠与
以下,次亚磷酸钠与 和
和 均不反应,
均不反应, 消耗的
消耗的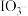 忽略不计)
忽略不计)①配平离子方程式

②此样品中二氧化锗的质量分数是
您最近一年使用:0次
2022-05-01更新
|
431次组卷
|
2卷引用:福建省厦门外国语学校2022-2023学年高一下学期期中限时训练化学试题
名校
解题方法
2 . 某兴趣小组的同学模拟侯德榜制碱法制取纯碱,流程如图:

(1)向饱和NaCl溶液中通入 和氨气时,应先通入
和氨气时,应先通入___________ (填化学式)。操作①的名称为___________ 。
(2)写出反应①的化学方程式:___________ 。
(3)该流程中可循环利用的物质是___________ (填化学式)。
(4)现将 和
和 的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中
的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中 和
和 的物质的量之比为
的物质的量之比为___________ 。
(5)下列选项中哪种方法可以鉴别 溶液和
溶液和 溶液___________。
溶液___________。
(6)下列实验方案中,不能测定出 和
和 的混合物中
的混合物中 质量分数的是_______。
质量分数的是_______。
(7)钠是一种典型的碱金属元素,下列性质的递变规律正确,且能作为碱金属元素金属性递变规律判断依据的是___________(填字母)。

(1)向饱和NaCl溶液中通入
 和氨气时,应先通入
和氨气时,应先通入(2)写出反应①的化学方程式:
(3)该流程中可循环利用的物质是
(4)现将
 和
和 的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中
的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中 和
和 的物质的量之比为
的物质的量之比为(5)下列选项中哪种方法可以鉴别
 溶液和
溶液和 溶液___________。
溶液___________。| A.加入澄清石灰水 | B.加入氢氧化钠溶液 |
| C.加热 | D.逐滴加入稀盐酸 |
(6)下列实验方案中,不能测定出
 和
和 的混合物中
的混合物中 质量分数的是_______。
质量分数的是_______。| A.取ag混合物充分加热,质量减少bg |
| B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| C.取ag混合物与足量NaOH溶液充分反应,得到bg溶液 |
| D.取ag混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加bg |
(7)钠是一种典型的碱金属元素,下列性质的递变规律正确,且能作为碱金属元素金属性递变规律判断依据的是___________(填字母)。
| A.Li、Na、K的原子半径和密度都随原子序数的增加而增大 |
B.碱性: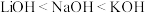 |
C.还原性: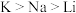 ,故K可以从NaCl溶液中置换出金属钠 ,故K可以从NaCl溶液中置换出金属钠 |
D.熔、沸点: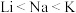 |
您最近一年使用:0次
2023-12-23更新
|
142次组卷
|
3卷引用:湖南省长沙市南雅中学2023-2024学年高一上学期第三次12月月考化学试卷
名校
解题方法
3 . 海水是资源宝库,可利用海水提溴:
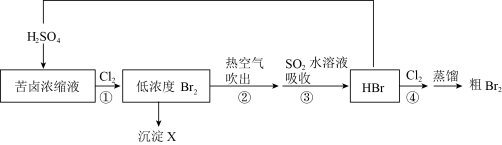
资料:常用提溴原料
(1)选用苦卤浓缩液而不是天然海水作为提溴原料的原因是___________ 。
(2)海水中溴元素的存在形式是Br—,从原子结构角度解释反应①能发生的原因:___________ 。
(3)步骤③反应的化学方程式是___________ 。
(4)在海水提溴生产工艺中,通常通过蒸馏法实现溴和水的分离(蒸馏是利用物质的沸点不同而实现分离的办法)。在蒸馏的过程中,温度应控制在80~90℃,温度过高或过低都不利于生产,请解释其原因___________ 。
(5)若步骤④中通入960g SO2,实际产出Br2的质量为1920g,则实际产量Br2的产率为___________ 。(产率=实际产量/理论产量×100%)

资料:常用提溴原料
| 提溴原料 | 天然海水 | 苦卤浓缩液(浓缩海水) |
| 溴含量(g·L-1) | 0.045 | 7.270 |
(1)选用苦卤浓缩液而不是天然海水作为提溴原料的原因是
(2)海水中溴元素的存在形式是Br—,从原子结构角度解释反应①能发生的原因:
(3)步骤③反应的化学方程式是
(4)在海水提溴生产工艺中,通常通过蒸馏法实现溴和水的分离(蒸馏是利用物质的沸点不同而实现分离的办法)。在蒸馏的过程中,温度应控制在80~90℃,温度过高或过低都不利于生产,请解释其原因
(5)若步骤④中通入960g SO2,实际产出Br2的质量为1920g,则实际产量Br2的产率为
您最近一年使用:0次
4 . 已知X、Y为短周期中的两种元素,原子序数X>Y,且X、Y的最外层电子数都是5个,Y元素的单质在空气中的含量最高,则:
(1)X是___________ (填元素符号);
(2)Y最简单氢化物的化学式是___________ ;
(3)X、Y两种元素的非金属性强弱是X___________ Y(填“>”或“<”);
(4)Y的简单氢化物与其最高价氧化物对应的水化物反应的离子方程式为___________ 。
(1)X是
(2)Y最简单氢化物的化学式是
(3)X、Y两种元素的非金属性强弱是X
(4)Y的简单氢化物与其最高价氧化物对应的水化物反应的离子方程式为
您最近一年使用:0次
5 . 元素周期表被认为是“科学共同的语言”,它的发现使化学学习和研究变得有规律可循。其简洁有序的背后,是众多科学家艰苦奋斗的结果。下图是元素周期表的一部分,请按要求回答下列问题:

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷的原子结构示意图为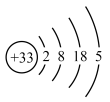 ,砷在周期表中的位置是
,砷在周期表中的位置是___________ 。我国“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。原子半径:Ga___________ As(填“>”或“<”)。
(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。硅元素位于元素周期表金属与非金属的分界处,请写出硅单质的一种用途___________ 。
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硫化硒(SeS)可用于治疗脂溢性皮炎。硫元素和硒元素简单气态氢化物热稳定性较强的为___________ (填化学式)。
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是___________ 。
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力着。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族,有关“类钫”的预测说法正确的是
(6)小赵同学在研究元素周期表时发现,碳元素有“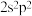 ”这一信息,观察元素周期表后,寻找规律,推测某元素“
”这一信息,观察元素周期表后,寻找规律,推测某元素“ ”中
”中 可能的含义是
可能的含义是___________ 。

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷的原子结构示意图为
 ,砷在周期表中的位置是
,砷在周期表中的位置是(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。硅元素位于元素周期表金属与非金属的分界处,请写出硅单质的一种用途
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硫化硒(SeS)可用于治疗脂溢性皮炎。硫元素和硒元素简单气态氢化物热稳定性较强的为
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力着。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族,有关“类钫”的预测说法正确的是
| A.“类钫”在化合物中显+1价 |
| B.“类钫”单质具有强氧化性 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 |
| D.“类钫”单质能与冷水剧烈反应 |
(6)小赵同学在研究元素周期表时发现,碳元素有“
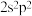 ”这一信息,观察元素周期表后,寻找规律,推测某元素“
”这一信息,观察元素周期表后,寻找规律,推测某元素“ ”中
”中 可能的含义是
可能的含义是
您最近一年使用:0次
名校
解题方法
6 . 人体必需的一些元素在周期表中的分布情况如下:______ 。 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将 通入水中,可以得到一种具有漂白性的分子,写出它的结构式
通入水中,可以得到一种具有漂白性的分子,写出它的结构式________ 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是________ ,原子序数为____ 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性 溶液中加入
溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ 。
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。

 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将
 通入水中,可以得到一种具有漂白性的分子,写出它的结构式
通入水中,可以得到一种具有漂白性的分子,写出它的结构式(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性
 溶液中加入
溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。
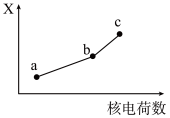
| A.若a、b、c表示氧族元素,则X表示对应氢化物的沸点 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第ⅠA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第ⅡA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
2024-01-24更新
|
70次组卷
|
2卷引用:山东省邹城市第二中学2023-2024学年高一上学期12月月考化学试题
7 . X、Y、Z、W为原子序数依次增大的主族元素。X的原子核外L层电子数比K层多5;Y元素的原子失去1个电子,所得到的微粒具有与氖原子相同的电子层结构;Z是地壳中含量最多的金属元素;W与Y同主族。下列说法正确的是
| A.原子半径:W>Z>Y>X | B.X的最高价氧化物的化学式可表示为X2O7 |
| C.Z的最高价氧化物的水化物属于强碱 | D.单质与O2或H2O反应的剧烈程度:Y<W |
您最近一年使用:0次
解题方法
8 . Ⅰ.铁元素在地壳中含量居于第四位。铁是目前产量最大,使用最广泛的金属。我国目前发现最早的人工冶铁制品是河南三门峡出土的西周晚期的玉柄铁剑。
(1)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,请用化学方程式解释____________________________________________ 。
(2)铁是人体必需微量元素中含量最多的一种。当人体贫血时,可以服用含FeSO4的补血剂,搭配维C效果更好,维C在这个过程中的作用是做___________ 剂。
(3)电子工业中常用FeCl3溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有Fe3+,可选择下列试剂中的_______ (填编号,下同)进行检验,现象是______________________ 。
A.KSCN 溶液 B.酸性 KMnO4溶液 C.新制氯水
(4)高铁酸钠 是一种新型绿色消毒剂,其一种制备原理如下: _____
是一种新型绿色消毒剂,其一种制备原理如下: _____ ____
____ _____=_____
_____=_____ ______
______ _____
_____
请将方程式补充完整并配平该方程式____ 。
Ⅱ.氯是一种重要的成盐元素,在自然界中主要以NaCl的形式大量存在于海水中。氯的单质氯气是一种重要的化工原料。实验室利用下图所示装置制取并收集氯气:
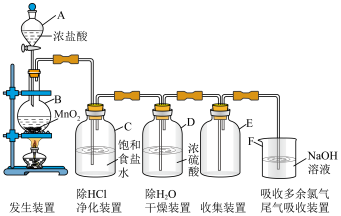
(5)装置A的名称是______________
(6)氯气除了可以用向上排空气法收集,还可以用排_______________ 溶液的方法收集。
Ⅲ.元素周期表是学习化学的重要工具,它揭示了元素间的内在联系。
(7)卤素是元素周期表中第ⅦA族元素, 按F、Cl 、Br 、I的顺序非金属性逐渐减弱,下列关于卤素的说法错误的是
(1)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,请用化学方程式解释
(2)铁是人体必需微量元素中含量最多的一种。当人体贫血时,可以服用含FeSO4的补血剂,搭配维C效果更好,维C在这个过程中的作用是做
(3)电子工业中常用FeCl3溶液作为“腐蚀液”腐蚀覆铜板。为了检验反应后所得混合溶液中还有Fe3+,可选择下列试剂中的
A.KSCN 溶液 B.酸性 KMnO4溶液 C.新制氯水
(4)高铁酸钠
 是一种新型绿色消毒剂,其一种制备原理如下: _____
是一种新型绿色消毒剂,其一种制备原理如下: _____ ____
____ _____=_____
_____=_____ ______
______ _____
_____
请将方程式补充完整并配平该方程式
Ⅱ.氯是一种重要的成盐元素,在自然界中主要以NaCl的形式大量存在于海水中。氯的单质氯气是一种重要的化工原料。实验室利用下图所示装置制取并收集氯气:

(5)装置A的名称是
(6)氯气除了可以用向上排空气法收集,还可以用排
Ⅲ.元素周期表是学习化学的重要工具,它揭示了元素间的内在联系。
(7)卤素是元素周期表中第ⅦA族元素, 按F、Cl 、Br 、I的顺序非金属性逐渐减弱,下列关于卤素的说法错误的是
| A.单质颜色随核电荷数的增加而加深 |
| B.氢化物的稳定性随核电荷数的增加而增大 |
| C.原子半径随核电荷数的增加而增大 |
| D.单质的氧化性随核电荷数的增大而增强 |
您最近一年使用:0次
名校
解题方法
9 . 人体必需的一些元素在周期表中的分布情况如下:

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是_______ 。 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为_______ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将 通入NaOH溶液中,可以得到一种漂白液,上述反应的离子方程式为
通入NaOH溶液中,可以得到一种漂白液,上述反应的离子方程式为_______ 。
(3)钙元素和磷元素促进了我们骨骼发育与牙齿的正常生长。从物质分类的角度看,羟基磷灰石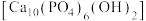 属于
属于_______ (填“酸”、“碱”、“盐”或“氧化物”)。Ca与Mg在元素周期表同一族,化学性质相似同时也有递变性,试写出Ca与 反应的化学方程式:
反应的化学方程式:_______ 。
(4)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是_______ ,原子序数为_______ 。
(5)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性 溶液中加入
溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为_______ 。
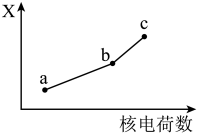
(6)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是
 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将
 通入NaOH溶液中,可以得到一种漂白液,上述反应的离子方程式为
通入NaOH溶液中,可以得到一种漂白液,上述反应的离子方程式为(3)钙元素和磷元素促进了我们骨骼发育与牙齿的正常生长。从物质分类的角度看,羟基磷灰石
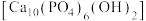 属于
属于 反应的化学方程式:
反应的化学方程式:(4)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(5)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性
 溶液中加入
溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为(6)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。

| A.若a、b、c表示碱金属元素,则X表示对应单质的密度 |
| B.若a、b、c表示第ⅡA族元素,则X表示最高价氧化物对应水化物的碱性 |
| C.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| D.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
您最近一年使用:0次
2023-10-13更新
|
245次组卷
|
2卷引用:湖北省百校联盟2023-2024学年高三上学期10月联考化学试题
10 . 现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大。相关信息如下表:
下列说法正确的是
| 元素 | 相关信息 |
| X | 最外层电子数是核外电子总数的一半 |
| Y | 在地壳中含量居第三位 |
| Z | 单质为淡黄色固体,常存在于火山喷口附近 |
| Q | 同周期元素中原子半径最小 |
| A.常温时,X单质能与水发生剧烈反应 |
| B.工业上常用电解熔融的YQ3来制备Y |
| C.因为Q元素的氢化物酸性比Z强,所以非金属性:Q>Z |
| D.第5周期且与Q同主族元素的单质在常温常压下呈固态 |
您最近一年使用:0次



